Benzeno cl2 šviesa. Fizinės ir cheminės benzeno savybės
C6H6 + Cl2 → C6H6Cl + HCl
Šiuo atveju katalizatorius paprastai yra geležies (III) chloridas arba bromidas. Kaip katalizatoriai taip pat gali būti naudojami kitų metalų, tokių kaip AlCl3, SbCl3, SbCl5, taip pat jodas, chloridai.
Katalizatoriaus vaidmuo yra suaktyvinti (poliarizuoti) halogeną, kuris vykdo elektrofilinį pakaitalą benzeno žiede. Esant FeCl3
chlorinimas yra, pavyzdžiui, pagal schemą:
FeCl3 +: Cl :: Cl: ↔ FeCl-4 + Cl: +
۠۠۠ ۠ ۠۠۠۠۠ ۠ ۠ ۠۠
C6H6 + Cl + → C6H5Cl + H +;
H + + Cl2 → HCl + Cl + ir kt.
Halogenas gali būti įvedamas į šoninę grandinę, jei nėra katalizatorių šviesoje arba kaitinant. Šiuo atveju pakeitimo mechanizmas yra radikalus. Toluenui šias transformacijas galima išreikšti schema:
Halogenai priklauso pirmosios rūšies pakaitalams, todėl halogeninant benzeną antrasis halogeno atomas daugiausia patenka į pirmojo n padėtį. Tačiau halogenai, skirtingai nuo kitų pirmos rūšies pakaitų, apsunkina pakaitalus (palyginti su benzenu).
Kai chlorinamas p-fluorchlorbenzenas, trečiasis halogeno atomas patenka į fluoro, o ne fluoro, o o padėtį. Vadinasi, indukcinis halogeno poveikis turi lemiamą įtaką pakaitų tvarkai (fluoro atomo o padėtis turi didelį teigiamą krūvį, nes –IF\u003e -ICl): AAAAAAAAAAAAAAAAAAAAAAAAAAAAA

2. Aminogrupės pakeitimas halogenu tarpiniu diazo junginių susidarymu. Šis metodas leidžia gauti bet kokius halogeno darinius, įskaitant fluoro darinius:
─── → C6H5Cl + N2
C6H5NH2─── → C6H5N2Cl ───── → C6H5I + KCl + N2
─── → C6H5Br + Cu2Cl2 + N2
BF4 → C6H5F + N2 + BF3
2.2 Adamantanas
Struktūrinės adamantano savybės lemia jo neįprastą fizinę ir cheminės savybės... Adamantane yra aukščiausia angliavandenilių lydymosi temperatūra, lygi 269 ° C, o tankis 1,07 g / cm3. Kaitinant iki 660 ° C, jis yra termiškai stabilus, nesant deguonies. Esant 20 kilobarų slėgiui ir 480 ° C ir aukštesnei temperatūrai, jis palaipsniui grafituoja. Adamantanas yra ypač atsparus agresyviai cheminei aplinkai ir net esant aukštai temperatūrai nesąveikauja su kalio permanganatu, chromu ir koncentruota azoto rūgštimi.
1 lentelėje parodyta adamantano išeities priklausomybė nuo naudojamo katalizatoriaus.
1 lentelė. TMNB skystos fazės izomerizacijos į adamantaną rezultatai
|
Reakcijos sąlygos |
Adamantano derlius,% |
|
BF3, HF, 23 esant H2, 50 ° C | |
|
SbF5, HF, 120 ° C, 5 val | |
|
A1C13, HC1,40 H2, 120 ° C temperatūroje | |
|
A1C13, HC1, tret-C4H9Cl | |
|
A1Br3, tret-C4H9Bg |
TMNB izomerizavimas į adamantaną atliekamas pagal schemą:

Dėl erdvinių priežasčių tik endo izomeras sugeba toliau persitvarkyti į adamantaną, o jo pusiausvyros koncentracija yra apie 0,5 masės. %.
Kinetiniu požiūriu endo-TMNB izomerizacija yra viena iš lėčiausių sočiųjų angliavandenilių pertvarkymų tokiomis sąlygomis: geometrinė TMNB izomerizacija (Wagnerio-Meerweino pertvarkymas) vyksta maždaug 10 000 kartų greičiau.
Šis sintezės metodas tapo pramoninės adamantano technologijos pagrindu. Šio pertvarkymo lengvumas paaiškinamas dideliu adamantano termodinaminiu stabilumu, todėl apdorojus visus žinomus C10H16 izomerus Lewis rūgštimis, neišvengiamai susidaro šis policiklinis karkaso angliavandenilis.
Adamantano sintezė karboksirūgštys
Norint gauti adamantano serijos rūgštis, plačiai naudojama Koch-Haaf reakcija. Pradinės medžiagos yra adamantanas, 1-brom-, 1-hidroksiadamantanas ir 1-hidroksiadamantano nitratas.
Adamantano -1-karboksirūgštis gaunama reaguojant 1-brom- arba 1-hidroksiadamantaną su skruzdžių rūgštimi sieros rūgštyje arba adamantane su skruzdžių ar sieros rūgštimi, esant tretiniam butilo alkoholiui.
Buvo įrodyta, kad maksimalus adamantano-1-karboksirūgšties derlius pasiekiamas santykiu AdOH: HCOOH: H2SO4 \u003d 1: 1: 24. Derlius sumažėja, kai trūksta skruzdžių rūgšties.
Adamantano-1-karboksirūgštį galima gauti iš adamantano 20% oleume. Manoma, kad reakcija vyksta formuojant adamantilo katijoną
Norint gauti karboksirūgštis iš adamantano, naudojama jo reakcija su CO2 sieros rūgštyje arba oleume (autoklavas, 90–160 ° C) . Tokiu būdu susidaro adamantano-1-karboksirūgšties ir adamantan-1,3-dikarboksirūgšties mišinys santykiu 1: 6.
Sintezė (1-adamantilas) acto rūgštiss iš 1-bromo arba 1-hidroksiadamantano ir dichloretileno atliekami 80–100% H2SO4, esant BF3 0–15 ° C temperatūroje. 
Kai adamantanas ir jo dariniai reaguoja su trichloretilenu dalyvaujant 90% sieros rūgščiai, susidaro atitinkamos α-chloracto rūgštys.

3-alkiladamantan-1-karboksirūgštys gaunamos iš alkiladamantanų sieros rūgštyje, esant tret-butilo alkoholiui ir 95% skruzdžių rūgščiai.
Adamantano nitratai.
Adamantano reakcija su 96-98% azoto rūgšties pertekliumi sukelia 1-nitroksiadamantaną kaip pagrindinį 1-os reakcijos produktą. 3-dinitroxi-adamantanas.

Adamantanas su azoto ir acto rūgščių mišiniu reaguoja mažesniu greičiu nei su azoto rūgštimi, o maksimalus 80% nitratų kiekis gaunamas per 3 valandas. Vienintelis šalutinis reakcijos produktas yra adamantolis-1.
APIBRĖŽIMAS
Benzenas (cikloheksatrienas - 1,3,5) yra organinė medžiaga, paprasčiausia daugelio aromatinių angliavandenilių atstovė.
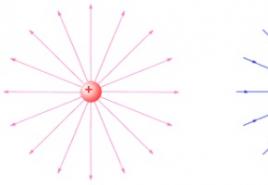
Formulė - C 6 H 6 (struktūrinė formulė - 1 pav.). Molekulinė masė - 78, 11.
Paveikslėlis: 1. Benzeno struktūrinės ir erdvinės formulės.
Visi šeši benzeno molekulės anglies atomai yra hibridinėje sp 2 būsenoje. Kiekvienas anglies atomas sudaro 3σ ryšius su dviem kitais anglies atomais ir vienu vandenilio atomu, esančiais toje pačioje plokštumoje. Šeši anglies atomai sudaro taisyklingą šešiakampį (benzeno molekulės σ-skeletas). Kiekvienas anglies atomas turi vieną nehibridizuotą p-orbitą, kurioje yra vienas elektronas. Šeši p-elektronai sudaro vieną π-elektronų debesį (aromatinę sistemą), kuris pavaizduotas kaip apskritimas šešių narių cikle. Angliavandenilių radikalas, gautas iš benzeno, vadinamas C6H5 - - fenilu (Ph-).
Cheminės benzeno savybės
Benzenui būdingos pakaitų reakcijos, vykstančios pagal elektrofilinį mechanizmą:
- halogeninimas (benzenas sąveikauja su chloru ir bromu dalyvaujant katalizatoriams - bevandenis AlCl 3, FeCl 3, AlBr 3)
C6H6 + Cl2 \u003d C6H5-Cl + HCl;
- nitrinimas (benzenas lengvai reaguoja su nitratiniu mišiniu - koncentruotų azoto ir sieros rūgščių mišiniu)

- alkilinimas alkenais
C6H6 + CH2 \u003d CH-CH3 → C6H5-CH (CH3) 2;
Papildomos benzeno reakcijos sunaikina aromatinę sistemą ir vyksta tik sunkiomis sąlygomis:
- hidrinimas (reakcija vyksta kaitinant, katalizatorius yra Pt)

- chloro pridėjimas (gaunamas veikiant UV spinduliuotei, susidarant kietam produktui - heksachlorcikloheksanas (heksachloranas) - C 6 H 6 Cl 6)

Kaip ir bet kuris kitas organinis junginys benzenas patenka į degimo reakciją ir susidaro anglies dioksidas ir vanduo kaip reakcijos produktai (jis dega dūminė liepsna):
2C6H6 + 15O2 → 12CO2 + 6H2O
Fizinės benzeno savybės
Benzenas yra bespalvis skystis, bet turintis specifinį aštrų kvapą. Jis sudaro azeotropinį mišinį su vandeniu, gerai sumaišomas su eteriais, benzinu ir įvairiais organiniais tirpikliais. Virimo temperatūra - 80,1 ° C, lydymosi temperatūra - 5,5 ° C. Toksiškas, kancerogenas (t. Y. Prisideda prie vėžio vystymosi).
Benzeno gavimas ir naudojimas
Pagrindiniai benzeno gamybos metodai:
- heksano dehidrociklinimas (katalizatoriai - Pt, Cr 3 O 2)
CH3- (CH2) 4-CH3 → C6H6 + 4H2;
- cikloheksano dehidrinimas (reakcija vyksta kaitinant, katalizatorius yra Pt)
C6H12 → C6H6 + 4H2;
- acetileno trimeravimas (reakcija vyksta kaitinant iki 600 ° C, katalizatorius yra aktyvuota anglis)
3HC≡CH → C6H6.
Benzenas tarnauja kaip žaliava gaminant homologus (etilbenzeną, kumeną), cikloheksaną, nitrobenzolą, chlorbenzeną ir kitas medžiagas. Anksčiau benzinas buvo naudojamas kaip priedas prie benzino, kad padidėtų jo oktaninis skaičius, tačiau dabar dėl didelio toksiškumo benzeno kiekis degaluose yra griežtai standartizuotas. Kartais kaip tirpiklis naudojamas benzenas.
Problemų sprendimo pavyzdžiai
1 PAVYZDYS
| Užduotis | Užrašykite lygtis, kuriomis galite atlikti šias transformacijas: CH 4 → C 2 H 2 → C 6 H 6 → C 6 H 5 Cl. |
| Sprendimas | Norint gauti acetileną iš metano, naudojama ši reakcija: 2CH4 → C2H2 + 3H2 (t \u003d 1400C). Benzeno gamyba iš acetileno yra įmanoma acetileno trimeravimo reakcijos būdu, kaitinant (t \u003d 600 ° C) ir esant aktyvintai angliai: 3C2H2 → C6H6. Benzeno chlorinimo reakcija, siekiant gauti chlorbenzeną kaip produktą, atliekama dalyvaujant geležies (III) chloridui: C6H6 + Cl2 → C6H5Cl + HCl. |
2 PAVYZDYS
| Užduotis | Į 39 g benzeno, dalyvaujant geležies (III) chloridui, pridedama 1 mol bromo vandens. Kokį kiekį medžiagos ir kiek gramų kokių produktų gavote? |
| Sprendimas | Parašykime benzolio brominimo reakcijos, esant geležies (III) chloridui, reakcijos lygtį: C6H6 + Br2 → C6H5Br + HBr. Reakcijos produktai yra brombenzenas ir vandenilio bromidas. Molinė benzolo masė apskaičiuota pagal lentelę cheminiai elementai DI. Mendelejevas - 78 g / mol. Raskime benzeno medžiagos kiekį: n (C6H6) \u003d m (C6H6) / M (C6H6); n (C6H6) \u003d 39/78 \u003d 0,5 mol. Pagal problemos sąlygą benzenas reagavo su 1 moliu bromo. Taigi benzeno trūksta, todėl atliksime tolesnius benzeno skaičiavimus. Pagal reakcijos lygtį n (C 6 H 6): n (C 6 H 5 Br): n (HBr) \u003d 1: 1: 1, todėl n (C 6 H 6) \u003d n (C 6 H 5 Br) \u003d: n (HBr) \u003d 0,5 mol. Tada brombenzeno ir vandenilio bromido masės bus lygios: m (C6H5Br) \u003d n (C6H5Br) × M (C6H5Br); m (HBr) \u003d n (HBr) × M (HBr). Brombenzeno ir vandenilio bromido molinės masės, apskaičiuotos naudojant D. I. cheminių elementų lentelę. Mendelejevas - atitinkamai 157 ir 81 g / mol. m (C6H5Br) \u003d 0,5 x 157 \u003d 78,5 g; m (HBr) \u003d 0,5 × 81 \u003d 40,5 g. |
| Atsakymas | Reakcijos produktai yra brombenzenas ir vandenilio bromidas. Brombenzeno ir vandenilio bromido masė yra atitinkamai 78,5 ir 40,5 g. |
Fizinės savybės
Benzenas ir artimiausi jo homologai yra bespalviai skysčiai, turintys specifinį kvapą. Aromatiniai angliavandeniliai yra lengvesni už vandenį ir jame netirpsta, tačiau lengvai ištirpsta organiniuose tirpikliuose - alkoholyje, eteryje, acetone.
Benzenas ir jo homologai patys yra geri tirpikliai daugeliui organinės medžiagos... Dėl visų arenų dega dūminė liepsna didelis turinys anglies jų molekulėse.
Kai kurių arenų fizinės savybės pateikiamos lentelėje.
Lentelė. Kai kurių arenų fizinės savybės
|
vardas |
Formulė |
t °. pl., |
t °. virti, |
|
Benzenas |
C 6 H 6 |
5,5 |
80,1 |
|
Toluolas (metilbenzenas) |
C6H5CH3 |
95,0 |
110,6 |
|
Etilbenzenas |
C6H5C2H5 |
95,0 |
136,2 |
|
Ksilenas (dimetilbenzenas) |
C6H4 (CH3) 2 |
||
|
orto- |
25,18 |
144,41 |
|
|
meta- |
47,87 |
139,10 |
|
|
pora- |
13,26 |
138,35 |
|
|
Propilo benzenas |
C6H5 (CH2) 2CH3 |
99,0 |
159,20 |
|
Kumenas (izopropilbenzenas) |
C6H5CH (CH3) 2 |
96,0 |
152,39 |
|
Stirenas (vinilbenzenas) |
C6H5CH \u003d CH2 |
30,6 |
145,2 |
Benzenas - mažai verdantis ( t ryšulys\u003d 80,1 ° C), bespalvis skystis, netirpus vandenyje
Dėmesio! Benzenas - nuodai, veikia inkstus, keičia kraujo formulę (ilgai veikiant), gali sutrikdyti chromosomų struktūrą.
Dauguma aromatinių angliavandenilių kelia pavojų gyvybei ir yra toksiški.
Arenų (benzeno ir jo homologų) gavimas
Laboratorijoje
1. Benzenkarboksirūgšties druskų susiliejimas su kietais šarmais
C6H5-COONa + NaOH t →C6H6 + Na2C03
natrio benzoatas
2. Würzui tinkanti reakcija: (čia G yra halogenas)
C 6H 5 -G + 2Na + R-G →C 6 H 5 - R + 2 NaD
NUO 6 H5-Cl + 2Na + CH3-Cl → C6H5-CH3 + 2NaCl
Pramonėje
- izoliuotas nuo naftos ir anglies frakciniu distiliavimu, reformuojant;
- iš akmens anglių deguto ir kokso krosnies dujų
1. Alkanų dehidrociklinimas turintys daugiau nei 6 anglies atomus:
C 6 H 14 t , kat→ C6H6 + 4H2
2. Trimetinimas acetilenu (tik benzolui) - r. Zelinskis:
3C 2 H 2 600 ° C , Aktas. anglis → C6H6
3. Dehidrinimas cikloheksanas ir jo homologai:
Sovietų akademikas Nikolajus Dmitrijevičius Zelinskis nustatė, kad benzenas susidaro iš cikloheksano (dehidrinti
C 6 H 12 t, kat→ C6H6 + 3H2

C6H11-CH3 t , kat→ C6H5-CH3 + 3H2
metilcikloheksantholuenas
4. Benzeno alkilinimas (gauti benzeno homologus) - p Friedel-Crafts.
C6H6 + C2H5 -Cl t, AlCl3→ C6H5 -C2H5 + HCl
chloretanas etilbenzenas

Cheminės arenų savybės
Aš... OKSIDAVIMO REAKCIJOS
1. Degimas (dūminė liepsna):
2C6H6 + 15O2 t → 12CO 2 + 6H 2 O + Q
2. Normaliomis sąlygomis benzenas nekeičia bromo vandens ir kalio permanganato vandeninio tirpalo
3. Benzeno homologai oksiduojami kalio permanganatu (nuspalvina kalio permanganatą):
A) į rūgšti aplinka į benzenkarboksirūgštį
Veikiant kalio permanganatui ir kitiems stipriems oksidatoriams benzeno homologams, šoninės grandinės oksiduojasi. Nesvarbu, kokia sudėtinga yra pakaitinė grandinė, ji yra sunaikinta, išskyrus a-anglies atomą, kuris oksiduojamas iki karboksilo grupės.
Benzeno homologai su viena šonine grandine suteikia benzenkarboksirūgštį:
Homologai, turintys dvi šonines grandines, suteikia dviejų rūgščių rūgštis:
5C 6 H 5 -C 2 H 5 + 12KMnO 4 + 18H 2 SO 4 → 5C 6 H 5 COOH + 5CO 2 + 6K 2 SO 4 + 12MnSO 4 + 28H 2 O
5C6H5-CH3 + 6KMnO4 + 9H2SO4 → 5C6H5COOH + 3K2SO4 + 6MnSO4 + 14H2O
Supaprastinta :
C6H5-CH3 + 3O KMnO4→ C6H5COOH + H20
B) neutraliose ir šiek tiek šarminėse benzino rūgšties druskose
C6H5-CH3 + 2KMnO4 → C6H5COOК + K ОН + 2MnO 2 + H 2 O
II... PAPILDOMOS REAKCIJOS (sunkiau nei alkenai)
1. Halogeninimas
C6H6 + 3Cl2 h ν → C6H6Cl6 (heksachlorcikloheksanas - heksachloranas)
2. Hidrinimas
C6H6 + 3H2 t , Pt arba Ni → C6H12 (cikloheksanas)
3. Polimerizacija
III. PAKEITIMO REAKCIJOS - joninis mechanizmas (lengvesni už alkanus)
1. Halogeninimas -
a ) benzenas
C6H6 + Cl2 AlCl 3 → C6H5-Cl + HCl (chlorbenzenas)
C6H6 + 6Cl2 t, AlCl3→ C6Cl6 + 6HCl( heksachlorbenzenas)
C6H6 + Br2 t, FeCl3→ C6H5-Br + HBr( brombenzenas)
b) benzeno homologai švitinant ar kaitinant
Pagal chemines savybes alkilo radikalai yra panašūs į alkanus. Juose esančius vandenilio atomus laisvųjų radikalų mechanizmas pakeičia halogenu. Todėl, jei kaitinant ar švitinant UV spinduliais nėra katalizatoriaus, šoninėje grandinėje vyksta radikalaus pakaitalo reakcija. Benzeno žiedo poveikis alkilo pakaitalams lemia tai, kad vandenilio atomas ties anglies atomu, tiesiogiai sujungtu su benzeno žiedu (a-anglies atomas), visada pakeičiamas.
1) C6H5-CH3 + Cl2 h ν → C6H5-CH2-Cl + HCl
c) benzeno homologai, esant katalizatoriui
C6H5-CH3 + Cl2 AlCl 3 → (orto mišinys, darinių pora) + HCl
2. Nitratavimas (su azoto rūgštimi)
C6H6 + HO-NO2 t, H2SO4→ C6H5-NO2 + H20
nitrobenzenas - kvapas migdolai!
C6H5-CH3 + 3HO-NO2 t, H2SO4→ NUO H3-C6H2 (NO2) 3 + 3H202,4,6-trinitrotoluenas (tol, TNT)
Benzeno ir jo homologų naudojimas
Benzenas C6H6 yra geras tirpiklis. Benzenas kaip priedas gerina variklių degalų kokybę. Tarnauja kaip žaliava daugeliui aromatinių organinių junginių - nitrobenzenas C 6 H 5 NO 2 (tirpiklis, iš jo gaunamas anilinas), chlorbenzenas C 6 H 5 Cl, fenolis C 6 H 5 OH, stirenas ir kt.
Toluolas C 6 H 5 – CH 3 yra tirpiklis, naudojamas dažų, vaistų ir sprogmenų gamybai (TNT (tol) arba 2,4,6-trinitrotolueno TNT).
KsilenasC6H4 (CH3) 2. Techninis ksilenas yra trijų izomerų mišinys ( orto-, meta- ir pora- ksilenai) - naudojamas kaip tirpiklis ir pradinis produktas daugelio organinių junginių sintezei.
Izopropilbenzenas C6H5-CH (CH3) 2 naudojamas fenoliui ir acetonui gauti.
Benzeno chloro dariniai naudojamas augalų apsaugai. Taigi, benzeno H atomų pakeitimo chloro atomais produktas yra heksachlorbenzenas С 6 Сl 6 - fungicidas; jis naudojamas sausiems kviečių ir rugių sėklų padažams nuo kietų purvų. Chloro pridėjimo į benzeną produktas yra heksachlorcikloheksanas (heksachloranas) C 6 H 6 Cl 6 - insekticidas; jis naudojamas kovai kenksmingi vabzdžiai... Minėtos medžiagos priklauso pesticidams - cheminėms medžiagoms, kovojančioms su mikroorganizmais, augalais ir gyvūnais.
Stirenas C 6 H 5 - CH \u003d CH 2 labai lengvai polimerizuojasi, susidaro polistirenas ir kopolimerizuojasi su butadieno - stireno butadieno kaučiukais.
VIDEO PATIRTIS