Cheminės alkenų savybės. 1. Alkenų fizinės savybės, panaudojimas, gamybos metodai
Alkenai yra nesotieji angliavandeniliaikurie turi vieną dvigubą ryšį tarp atomų. Kitas jų pavadinimas yra olefinai, jis siejamas su šios klasės junginių atradimo istorija. Iš esmės šių medžiagų nėra gamtoje, tačiau jas sintezuoja žmonės praktiniais tikslais. IUPAC nomenklatūroje šių junginių pavadinimas formuojamas pagal tą patį principą, kaip ir alkanams, tik priesaga „an“ pakeičiama „en“.
Susisiekia su
Alkenų struktūra
Du anglies atomai, dalyvaujantys dvigubos jungties formavime, visada yra h2 hibridizacijoje, o kampas tarp jų yra lygus 120 laipsnių. Dvigubas ryšys susidaro persidengiant π -π orbitalėms, ir jis nėra labai stiprus, todėl šį ryšį yra pakankamai lengva nutraukti, kuris naudojamas cheminėms medžiagų savybėms.
Izomerija
Lyginant su ribojančiaisiais, šiuose angliavandeniliuose tai įmanoma daugiau tipų, tiek erdvinės, tiek struktūrinės. Struktūrinę izomerizmą taip pat galima suskirstyti į keletą tipų.
Pirmasis taip pat egzistuoja alkanams ir susideda iš kitokios anglies atomų jungimo tvarkos. Taigi izomerai gali būti penten-2 ir 2-metilbuten-2. Antrasis - dvigubos jungties padėties pasikeitimas.
Šių junginių erdvinė izomerija yra įmanoma dėl dvigubo ryšio atsiradimo. Jis yra dviejų tipų - geometrinis ir optinis.
Geometrinis izomerizmas yra viena iš labiausiai paplitusių rūšių gamtoje, o beveik visada geometriniai izomerai turės radikaliai skirtingas fizines ir chemines savybes. Išskirti cis ir trans izomerai.Pirmieji pakaitalai yra vienoje daugybinis ryšys, o trans izomerams jie yra skirtingose \u200b\u200bplokštumose.
Alkenų gamyba
 Jie, kaip ir daugelis kitų medžiagų, pirmą kartą buvo gauti visiškai atsitiktinai.
Jie, kaip ir daugelis kitų medžiagų, pirmą kartą buvo gauti visiškai atsitiktinai.
Pabaigoje vokiečių chemikas ir tyrėjas Becheris ištyrė sieros rūgšties poveikį etilo alkoholiui ir suprato, kad gavo nežinomas dujas, kuris yra labiau reaktyvus nei metanas.
Vėliau panašių tyrimų atliko dar keli mokslininkai, jie taip pat sužinojo, kad šios dujos, sąveikaudamos su chloru, sudaro riebią medžiagą.
Todėl iš pradžių ši junginių klasė buvo suteiktas olefinų pavadinimas, kuris verčiamas kaip riebi. Tačiau vis dėlto mokslininkams nepavyko nustatyti šio junginio sudėties ir struktūros. Tai įvyko tik praėjus beveik dviem šimtmečiams, XIX amžiaus pabaigoje.
Šiuo metu yra daug būdų gauti alkenus.
Pramoniniai metodai
Gaunasi pramoniniai metodai:
- Sočiųjų angliavandenilių dehidrinimas. Ši reakcija įmanoma tik veikiant aukštai temperatūrai (apie 400 laipsnių) ir katalizatoriams - arba chromo oksido 3, arba aliuminio oksido ir platinos katalizatoriams.
- Dihaloalkanų dehalogeninimas. Pasitaiko tik esant cinkui ar magniui ir esant aukštai temperatūrai.
- Halogenalkanų dehidrogeninimas. Jis atliekamas naudojant organinių rūgščių natrio arba kalio druskas aukštesnėje temperatūroje.
Svarbu! Šie alkenų gavimo metodai neduoda gryno produkto; reakcijos rezultatas bus nesočiųjų angliavandenilių mišinys. Tarp jų vyraujantis junginys nustatomas naudojant Zaicevo taisyklę. Jame sakoma, kad vandenilis greičiausiai atsiskiria nuo anglies atomo, kuris turi mažiausiai ryšių su vandeniliais.
Alkoholių dehidracija. Jis gali būti atliekamas tik kaitinant ir esant stiprių mineralinių rūgščių, turinčių vandenį šalinančių savybių, tirpalams.
Alkinų hidrinimas. Galima tik esant paladžio katalizatoriams.
Cheminės alkenų savybės
Alkenai yra labai chemiškai aktyvių medžiagų.Tai daugiausia lemia dvigubo ryšio buvimas. Šiai junginių klasei būdingiausios reakcijos yra elektrofilinis ir radikalus sujungimas.
- Alkenų halogeninimas - reiškia klasikines elektrofilinio pridėjimo reakcijas. Jis atsiranda tik esant inertiniams organiniams tirpikliams, dažniausiai anglies tetrachloridui.
- Hidrohalogeninimas. Šio tipo prisijungimas atliekamas pagal Markovnikovo taisyklę. Jonas prisijungia prie labiau hidrintos anglies, esančios šalia dvigubo ryšio, ir atitinkamai, halogenido jonas prisijungia prie antrosios anglies. Ši taisyklė pažeidžiama esant peroksido junginiams - Harrosh efektui. Vandenilio halogenidas pridedamas visiškai priešingai Markovnikovo taisyklei.
- Hidroboruojantis. Ši reakcija turi didelę praktinę reikšmę. Todėl mokslininkas, kuris ją atrado ir ištyrė, netgi gavo Nobelio premiją. Ši reakcija atliekama keliais etapais, o boro jonų pridėjimas neatitinka Markovnikovo taisyklės.
- Alkenų hidratacija arba papildymas. Ši reakcija taip pat vyksta pagal Markovnikovo taisyklę. Hidroksido jonas yra prijungtas prie mažiausiai hidrinto anglies atomo dviguboje jungtyje.
- Alkilinimas yra kita reakcija, dažniausiai naudojama pramonėje. Jį sudaro prisotinti angliavandeniliai prie nesočiųjų, veikiant žemai temperatūrai, ir katalizatoriai, kad padidėtų junginių atominė masė. Stiprios mineralinės rūgštys dažniausiai yra katalizatorius. Taip pat ši reakcija gali vykti laisvųjų radikalų mechanizmu.
- Alkenų polimerizacija yra dar viena reakcija, nebūdinga sočiųjų angliavandenilių. Tai apima daugelio molekulių sujungimą tarpusavyje, siekiant sukurti tvirtą ryšį, kuris skiriasi savo fizinėmis savybėmis.
 n šioje reakcijoje yra molekulių, kurios užmezgė ryšį, skaičius. Būtina įgyvendinimo sąlyga yra rūgšti aplinka, padidėjusi temperatūra ir padidėjęs slėgis.
n šioje reakcijoje yra molekulių, kurios užmezgė ryšį, skaičius. Būtina įgyvendinimo sąlyga yra rūgšti aplinka, padidėjusi temperatūra ir padidėjęs slėgis.
Taip pat alkenams būdingos kitos elektrofilinės prisijungimo reakcijos, kurios negavo tokio plataus praktinio platinimo.
Pavyzdžiui, alkoholių pridėjimo reakcija į eterių susidarymą.
Arba pridėjus rūgščių chloridų, gaunant nesočiųjų ketonų - Kondakovo reakcija.
Atkreipkite dėmesį!Ši reakcija įmanoma tik esant cinko chlorido katalizatoriui.
Kita pagrindinė alkenams būdinga reakcijų klasė yra radikalios adityvinės reakcijos. Šios reakcijos įmanomos tik tada, kai laisvieji radikalai susidaro veikiami aukštos temperatūros, radiacijos ir kitų veiksmų. Būdingiausia radikalų prijungimo reakcija yra hidrinimas, kad susidarytų sotieji angliavandeniliai. Jis atsiranda tik veikiant temperatūrai ir esant platinos katalizatoriui.
Dėl dvigubo ryšio buvimo alkenai yra labai būdingi įvairiems oksidacijos reakcijos.
- Degimas yra klasikinė oksidacijos reakcija. Jis gerai veikia be katalizatorių. Priklausomai nuo deguonies kiekio, galimi skirtingi galutiniai produktai: nuo anglies dioksido iki anglies.
- Oksidavimas kalio permanganatu neutralioje terpėje. Produktai yra daugiasluoksniai alkoholiai ir rudasis mangano dioksidas. Ši reakcija laikoma kokybiška alkenams.
- Taip pat silpna oksidacija gali būti vykdoma vandenilio peroksidu, osmio oksidu 8 ir kitais oksidatoriais neutralioje aplinkoje. Lengvai oksiduojant alkenus, būdingas tik vienas jungties lūžis; paprastai reakcijos produktas yra daugiasluoksniai alkoholiai.
- Taip pat galimas stiprus oksidavimas, kurio metu nutrūksta abu ryšiai ir susidaro rūgštys ar ketonai. Būtina sąlyga yra rūgštinė aplinka, dažniausiai naudojama sieros rūgštiesnes kitos rūgštys taip pat gali oksiduotis, kad susidarytų šalutiniai produktai.
Fizinės alkenų savybės
 Vienintelės dujos normaliomis sąlygomis yra etilenas, propenas ir butenas.
Vienintelės dujos normaliomis sąlygomis yra etilenas, propenas ir butenas.
Nuo penteno iki heptodeceno visi alkenai yra skystos būsenos.
Ir visa kita yra kietosios medžiagos.
Lydymosi ir virimo temperatūros proporcingai didėja didėjant molekulinei masei, tačiau izomerams gali skirtis.
Visi alkenai netirpinkite vandenyje, bet gerai ištirpsta inertiškuose organiniuose tirpikliuose.
Alkenų naudojimas
Alkenai yra plačiai naudojami pramonėje ir naudojami daugeliui medžiagų sintezei. Pavyzdžiui, etileno pagalba sintetinamas polivinilchloridas (PVC), stirenas, etilenglikolis, etanolis, polietilenas, gumos ir daugelis kitų medžiagų. Didžiausias propileno tūris naudojamas polipropilenui gaminti.
Alkenai - sandara, savybės, taikymas
Mes tiriame chemiją - alkenų savybes, pritaikymą pramonėje
Išvada
Apskritai galime tikrai pasakyti, kad alkenai dėl savo cheminių savybių yra labai paklausūs pramonėje. Jie užsiima įvairiausių plastikų, gumų ir daugelio kitų medžiagų gamyba.
Žemesnieji alkenai (C 2 - C 5) pramoniniu mastu gaunami iš dujų, susidariusių termiškai apdorojant aliejų ir naftos produktus. Alkenų taip pat galima gauti taikant laboratorinius sintezės metodus.
4.5.1. Dehidrohalogeninimas
Kai halogenalkanai yra apdorojami bazėmis bevandeniuose tirpikliuose, pavyzdžiui, pašalinamas kalio natrio druskos, vandenilio halogenido, tirpalas.
4.5.2. Dehidratacija
Kaitinant alkoholius sieros arba fosforo rūgštimis, vyksta molekulinė dehidracija ( - pašalinimas).
Vyraujanti reakcijos kryptis, kaip ir dehidrohalogeninimo atveju, yra stabiliausio alkeno susidarymas (Zaicevo taisyklė).
Alkoholių dehidracija gali būti atliekama perleidžiant alkoholio garus per katalizatorių (aliuminio arba torio oksidus) 300 - 350 o C temperatūroje.
4.5.3. Vicinalinių dihalidų dehalogeninimas
Veikiant cinkui alkoholyje, dibromidai, turintys halogenų prie kaimyninių atomų (vicinalo), gali būti paversti alkenais.

4.5.4. Alkinų hidrinimas
Kai alkinos hidrinamos dalyvaujant platinos ar nikelio katalizatoriams, kurių aktyvumas sumažėja pridedant nedidelį kiekį švino junginių (katalizinių nuodų), susidaro alkenas, kurio toliau redukuoti nereikia.
4.5.5. Redukuojantis aldehidų ir ketonų derinys
Apdorojus ličio aliuminio hidridu ir titano (III) chloridu, iš dviejų aldehido arba ketono molekulių išeiga susidaro di- arba tetras pakeisti alkenai.

5. ALKINAS
Alkinai yra angliavandeniliai, turintys trigubą anglies-anglies jungtį –CC–.
Bendroji paprastųjų alkinų formulė yra C n H 2n-2. Paprasčiausias alkinų klasės atstovas yra acetilenas H - CC - H, todėl alkinai dar vadinami acetileno angliavandeniliais.
5.1. Acetileno struktūra
Acetileno anglies atomai yra sp-hibridinė būsena. Pavaizduokime tokio atomo orbitinę konfigūraciją. Kai hibridizuojama 2s-sorbitalos ir 2p-orbitalus formuoja du ekvivalentai sp-hibridinės orbitos, esančios vienoje tiesioje linijoje, ir dvi nehibridizuotos r-orbitalas.

Paveikslėlis: 5.1 schemaformavimassp -hibridinės anglies atomo orbitos
Orbitų kryptys ir formos sr-hibridizuotas anglies atomas: hibridizuotos orbitos yra lygiavertės, maksimaliai nutolusios viena nuo kitos
Acetileno molekulėje paprastas ryšys ( - ryšys) tarp anglies atomų susidaro persidengiant dviem sp-hibridizuotos orbitos. Dvi viena kitai statmenos - obligacijos atsiranda tada, kai dvi poros nesusiję 2p-orbitos, - elektronų debesys padengia skeletą taip, kad elektronų debesys turi simetriją, artimą cilindriniam. Ryšiai su vandenilio atomais susidaro dėl sp-hibridinės anglies atomo orbitos ir 1 svandenilio atomo orbitomis, acetileno molekulė yra tiesinė.

Paveikslėlis: 5.2 Acetileno molekulė
a - šono sutapimas 2porbitos duoda du -jungtys;
b - molekulė yra tiesinė, - debesis yra cilindro formos
Propina yra paprastas ryšys ( - bendravimas su sp -NUO sp3 trumpesnis už analoginį ryšį C sp -NUO sp2 alkenuose tai yra dėl to, kad sp-orbita arčiau šerdies nei sp 2 - orbita .
Triguba anglies-anglies jungtis C C yra trumpesnė už dvigubą jungtį, o bendra trigubos jungties energija yra maždaug lygi vienos paprastos C - C jungties (347 kJ / mol) ir dviejų - obligacijų (259 · 2 kJ / mol) (5.1 lentelė).
Paprasčiausias organiniai junginiai yra sočiųjų ir nesočiųjų angliavandenilių. Tai apima alkanų, alkinų, alkenų klasės medžiagas.
Jų formulėse yra vandenilio ir anglies atomai tam tikra seka ir kiekiu. Jie yra bendro pobūdžio.
Alkenų nustatymas
Kitas jų pavadinimas yra olefinai arba etileno angliavandeniliai. Taip ši junginių klasė buvo vadinama XVIII a., Kai buvo atrastas aliejinis skystis - etileno chloridas.
Alkenai yra medžiagos, susidedančios iš vandenilio ir anglies elementų. Jie klasifikuojami kaip acikliniai angliavandeniliai. Jų molekulėje yra viena dviguba (nesočioji) jungtis, jungianti du anglies atomus vienas su kitu.
Alkenų formulės
Kiekviena junginių klasė turi savo cheminį pavadinimą. Juose elementų simboliai periodinė sistema nurodoma kiekvienos medžiagos sudėtis ir jungčių struktūra.

Bendroji alkenų formulė žymima taip: C n H 2n, kur skaičius n yra didesnis arba lygus 2. Dešifruojant jį galima pastebėti, kad kiekvienam anglies atomui yra du vandenilio atomai.
Homologinių serijų alkenų molekulinės formulės yra tokios: C 2 H 4, C 3 H 6, C 4 H 8, C 5 H 10, C 6 H 12, C 7 H 14, C 8 H 16, C9H18, C10H20. Galima pastebėti, kad kiekviename sekančiame angliavandenilyje yra dar viena anglis ir dar 2 vandenilis.
Yra grafinis vietos ir tvarkos žymėjimas cheminiai junginiai tarp atomų molekulėje, kurį parodo struktūrinė alkenų formulė. Valentinių brūkšnių pagalba nurodomas anglies ryšys su vandeniliais.
Struktūrinė alkenų formulė gali būti parodyta išplėstine forma, kai viskas cheminiai elementai ir bendravimas. Glaustesnė olefinų išraiška nerodo anglies ir vandenilio junginio, naudojant valentinius brūkšnelius.
Griaučių formulė žymi paprasčiausią struktūrą. Pertraukta linija žymi molekulės pagrindą, kuriame anglies atomus vaizduoja jos viršūnės ir galai, o jungtys nurodo vandenilį.
Kaip formuojasi olefinų pavadinimai
CH3-HC \u003d CH2 + H2O → CH3-OHCH-CH3.
Kai alkenai yra veikiami sieros rūgšties, vyksta sulfoninimo procesas:
CH3-HC \u003d CH2 + HO-OSO-OH → CH3-CH3CH-O-SO2 -OH.
Reakcija vyksta susidarant rūgštiniams esteriams, pavyzdžiui, izopropilsulfato rūgščiai.
Alkenai, degdami veikiami deguonies, gali oksiduotis, kad susidarytų vanduo ir anglies dioksido dujos:
2CH3-HC \u003d CH2 + 9O2 → 6CO2 + 6H2O.
Olefino junginių ir praskiesto kalio permanganato sąveika tirpalo pavidalu lemia glikolių arba diatominių alkoholių susidarymą. Ši reakcija taip pat yra oksidacinė, susidarant etilenglikoliui ir tirpalo spalvos pokyčiams:
3H 2C \u003d CH2 + 4H2O + 2KMnO4 → 3OHCH-CHOH + 2MnO2 + 2KOH.
Alkenų molekulės gali būti įtrauktos į polimerizaciją laisvųjų radikalų arba katijoninių-anijoninių mechanizmų pagalba. Pirmuoju atveju, veikiant peroksidams, gaunamas polietileno tipo polimeras.
Pagal antrąjį mechanizmą rūgštys veikia kaip katijoniniai katalizatoriai, o organinės metalinės medžiagos yra anijoninės, išskiriant stereoselektyvų polimerą.
Kas yra alkanai
Jie taip pat vadinami parafinais arba sočiaisiais acikliniais angliavandeniliais. Jie turi linijinę arba šakotą struktūrą, kurioje yra tik prisotintos paprastos jungtys. Visi šios klasės atstovai turi bendrą formulę C n H 2n + 2.

Juose yra tik anglies ir vandenilio atomai. Bendroji alkenų formulė yra kilusi iš sočiųjų angliavandenilių žymėjimo.
Alkanų pavadinimai ir jų savybės
Paprasčiausias šios klasės atstovas yra metanas. Po jo eina tokios medžiagos kaip etanas, propanas ir butanas. Jų pavadinimas pagrįstas skaičiaus šaknis graikų kalba, prie kurios pridedama galūnė -an. Alkano pavadinimai yra išvardyti IUPAC nomenklatūroje.
Bendra alkenų, alkinų, alkanų formulė apima tik dviejų tipų atomus. Tai apima anglies ir vandenilio elementus. Anglies atomų skaičius visose trijose klasėse yra vienodas, skirtumas pastebimas tik vandenilio skaičiuje, kurį galima atskirti arba prijungti. Iš gauti nesočiųjų junginių. Parafinų atstovuose molekulėje yra 2 vandenilio atomai daugiau nei olefinų, o tai patvirtina bendra alkanų, alkenų formulė. Alkenų struktūra laikoma nesočiąja dėl dvigubo ryšio.
Jei koreliuosime vandens ir anglies atomų skaičių al-ka-nah, tai vertė bus max-si-mal-ny, palyginti su kitomis ang-le-vo-do-ro-dov klasėmis .
Nuo metano iki butano (nuo C 1 iki C 4) medžiagos yra dujinės formos.
Skystoje pavidalu pateikiami angliavandeniliai, kurių homologinis diapazonas yra nuo C5 iki C16. Pradedant alkanu, kurio pagrindinėje grandinėje yra 17 anglies atomų, vyksta fizinės būsenos perėjimas į kietą formą.
Jiems būdinga anglies skeleto izomerija ir molekulės optinės modifikacijos.

Parafinuose laikoma, kad anglies valentus visiškai užima kaimyniniai kampai arba vanduo prie strypų, susidarant σ tipo ryšiui. Chi-ch-ch požiūriu tai lemia silpnąsias jų savybes, todėl alkanai vadinami pre-del-ny-x arba n-sy-schen-x ug-le-vo-do-ro- balandžiais giminystės.
Jie pradeda pakaitines reakcijas, susijusias su radikaliu molekulės halogeninimu, sulfochlorinimu arba nitrinimu.
Parafinai oksiduojasi, deginami arba skyla esant aukštai temperatūrai. Veikiant reakcijos greitintuvams, vandenilio atomai pašalinami arba alkanai dehidrinami.
Kas yra alkinai
Jie taip pat vadinami acetileniniais angliavandeniliais, kurie anglies grandinėje turi trigubą jungtį. Alkinų struktūra apibūdinama bendrąja formule C nH2 n-2. Iš jo matyti, kad, skirtingai nei alkanai, acetileniniuose angliavandeniliuose trūksta keturių vandenilio atomų. Juos pakeičia triguba jungtis, suformuota dviejų π junginių.
Ši struktūra lemia šios klasės chemines savybes. Struktūrinė alkenų ir alkinų formulė aiškiai rodo jų molekulių nesotumą, taip pat dvigubų (H2C꞊CH2) ir trigubų (HC≡CH) ryšių buvimą.
Alkinų pavadinimas ir jų ypatybės
Paprasčiausias pavyzdys yra acetilenas arba HC≡CH. Jis taip pat vadinamas etinu. Jis kilęs iš prisotinto angliavandenilio pavadinimo, kuriame pašalinama galūnė -an ir pridedama -in. Ilgųjų alkinų pavadinimuose skaičius nurodo trigubos jungties vietą.
Žinant sočiųjų ir nesočiųjų angliavandenilių struktūrą, galima nustatyti, po kuria raide nurodyta bendroji alkinų formulė: a) CnH2n; c) CnH2n + 2; c) CnH2n-2; d) CnH2n-6. Trečias variantas yra teisingas atsakymas.
Pradedant acetilenu ir baigiant butanu (nuo C 2 iki C 4), medžiagos turi dujinį pobūdį.

Angliavandeniliai, kurių homologinis diapazonas yra nuo C 5 iki C 17, yra skysti. Pradedant alkinu, kurio pagrindinėje grandinėje yra 18 anglies atomų, vyksta fizinės būsenos perėjimas į kietą formą.
Jiems būdinga izomerija anglies skelete, trigubos jungties padėtyje, taip pat molekulės modifikacijos tarp klasių.
Iki cheminės savybės acetileniniai angliavandeniliai yra panašūs į alkenus.
Jei alkinas turi galutinį trigubą ryšį, tada jie veikia kaip rūgštis susidarant alkinido druskoms, pavyzdžiui, NaC≡CNa. Dėl dviejų π jungčių natrio acetiledino molekulė tampa stipriu nukleofilu, kuris patenka į pakaitines reakcijas.
Acetilenas chloruojamas dalyvaujant vario chloridui, kad gautų dichloracetileną. Kondensuojasi veikiant halogenalkinams, išsiskiriant diacetileno molekulėms.
Alkinai dalyvauja reakcijose, kurių principas yra halogeninimo, hidrohalogeninimo, hidratacijos ir karboninimo pagrindas. Tačiau tokie procesai yra silpnesni nei dvigubą jungtį turinčių alkenų.
Acetileniniams angliavandeniliams yra galimos alkoholio, pirminio amino ar vandenilio sulfido molekulių nukleofilinės adicijos reakcijos.
4.3.b. Vandenilio halogenidų pridėjimas (hidrogenogeninimas)
Kita svarbi elektrofilinio prisijungimo prie alkenų reakcija yra gerai žinoma alkenų hasrogenogenizacija.
Žemiau pateikiami tipiški HCl, HBr ir HI pridėjimo į įvairius alkenus pavyzdžiai.


Alkilo pakaitų poveikis dvigubam ryšiui prisijungimo greičiui apibūdinamas tokia seka:
R2 C \u003d CHR\u003e RCH \u003d CHR\u003e RCH \u003d CH2
Tai atitinka mechanizmą, kai reakcijos greitį nustatančiame etape susidaro karbokacija, nes tretinio\u003e antrinio\u003e pirminio laipsnio alkilkatijonų stabilumas sumažėja. Taigi, papildymo mechanizmas turi apimti tarpinį laisvos karbokacijos, kuri yra retai pastebima, arba tarpinio, turinčio karbokacijos pobūdį, susidarymą. Pastarasis atvejis yra tipiškiausias.
Jei įpylimas įvyko per „laisvą karbokaciją“, reakcija būtų visiškai ne stereoselektyvi, nes alkilo katijonai turi plokščią struktūrą. Tačiau hidrohalogeninimas paprastai vyksta stereoselektyviai ir, atsižvelgiant į alkeno tipą, anti-jungimas, atrankinis sin- arba mišrus sin-anti-sujungti.
Alkenams, kuriuose dvigubas ryšys nėra konjuguotas su aromatiniu žiedu, jis būdingas anti- vandenilio halogenido pridėjimas. Anti- vandenilio chlorido ir vandenilio bromido, deuterio chlorido ir bromido priedai pastebimi cikloheksene, ciklopentene, 1,2-dimetilheksene, 1,2-dimetilpentene, cis- ir transas-buten-2, heksen-3 ir daugelis kitų paprastų alkenų ir cikloalkenų.

Papildomame produkte tie patys pakaitai (metilo grupės) yra skirtingose \u200b\u200bcikloheksano žiedo vidurio plokštumos pusėse, todėl jis priklauso transas- kartu. Anti-papildymas vargu ar yra suderinamas su mechanizmu, kuriame daroma prielaida, kad susidaro diskreti karbokacija. Plokščiajai karbokacijai nukleofilinė halogeno jonų ataka yra vienodai tikėtina abiejose plokštumos pusėse, o tai turėtų sukelti produktų mišinio susidarymą. sin- ir anti-jungimas. Alkeno hidrohalogeninimo kinetika taip pat rodo sudėtingesnį pridėjimo mechanizmą. Nekonjuguotiems alkenams reakcijos greitis apibūdinamas trečios eilės lygtimi su antrosios eilės vandenilio halogenidu, t.y., jis atitinka Ad E 3 mechanizmą.
v \u003d k [alkenas] 2
Anti-addicija ir antroji reakcijos tvarka vandenilio halogenido atžvilgiu gerai sutampa su Ad E 3 mechanizmu, kuriame alkenas sąveikauja su dviem vandenilio halogenido molekulėmis, iš kurių viena veikia kaip elektrofilinis agentas, o kita - kaip nukleofilinis agentas.

Šis trimolekulinis mechanizmas daro prielaidą, kad iš pradžių susidaro alkeno ir vienos vandenilio halogenido molekulės kompleksas, po kurio antroji HX molekulė atakuoja šį kompleksą su antipusių, nesudarant atskiros karbokacijos. Reikėtų ypač pažymėti, kad bet koks trimolekulinis mechanizmas turėtų susidaryti iš dviejų vienas po kito einančių etapų, nes trijų molekulių susidūrimas vienu metu yra labai mažai tikėtinas.

Anti-addicija rodo pageidautiną nukleofilinę vandenilio halogenido ataką iš priešingos pusės nei ta, iš kurios protonuojamas alkenas. Vietoj vandenilio halogenido nukleofilinio agento funkciją paskutiniame etape taip pat gali atlikti halogeno jonas. Tiesą sakant, reakcijos greitis paprastai didėja tiesiogiai proporcingai halogeno jonų, įneštų į reakcijos mišinį tetraalkilamonio halogenidų NR 4+ X, koncentracijai. - arba ličio LiX. Šiuo atveju yra stereospecifinis anti-sujungti.
Alkanams, kuriuose dvigubas ryšys yra konjuguotas su aromatiniu žiedu, tai būdinga sin-sujungimas arba sumaišymas sin-anti- vandenilio halogenido pridėjimas, pavyzdžiui:

Sin-prieraišumas yra dominuojantis procesas cis- ir transas1-fenilpropeno, 1-fenil-4-alkilciklohekseno, acenaftileno, indeno izomerai. Kai tokie alkenai yra protonuojami, susidaro benzilo tipo karbokacijos, kurios yra stabilesnės nei grynai alkilo katijonai, atsirandantys dėl įprastų alkenų ir cikloalkenų protonavimo. Reakcijos kinetika šiuo atveju paprastai apibūdinama paprastesne antros eilės lygtimi v \u003d k [alkenas], ty ji atitinka bimolekulinį Ad E 2 mechanizmą. Ad E 2 - mechanizmas apima jonų poros susidarymą, įskaitant karbokaciją ir halogenidą.

Negalima tikėtis, kad papildymo mechanizmas, susijęs su jonų poromis, bus labai stereoselektyvus. Jei jonų pora greičiau virs galutiniu produktu, nei sukasi aplink paprastą anglies-anglies jungtį, galutinis rezultatas yra sin-priedas, kai protonas ir halogenido jonas yra prijungti prie tos pačios dvigubos jungties pusės. Priešingu atveju produktų susidarymas pastebimas kaip sin- ir antijungtis HX. Šis atvejis realizuojamas hidrohalogeninant porapakeistieji stirenai Z-C6H4 -CH \u003d CH2. Čia pastebėtas modelis sin-papildymas būdingas tik tiems olefinams, kurie, protonavus, sukelia santykinai stabilią karbokaciją, t. y. donorų pakaitų Z atveju.
Hidrohalogeninimo reakcijoms, vykstančioms Ad E 2 mechanizmu, būdinga konjuguoto pridėjimo ir pertvarkymo procesų konkurencija, nes karbokacija arba jonų pora susidaro kaip tarpinė.

Kaip pertvarkymų su alkilo grupės ir hidrido jonų 1,2 migracija pavyzdį pateikiame atitinkamai tret-butiletileno ir izopropiletileno hidrohalogeninimo reakcijas.

Vykdant tą pačią reakciją be tirpiklio šaltyje (-78 0 С), susidaro 33% įprastų ir 67% nenormalių (pertvarkytų) pridėjimo produktų mišinys.

4.3.c. Orientacija. Markovnikovo valdžia
Skirtingai nuo simetriškų elektrofilų (Hal 2), vandenilio halogenidai yra asimetriniai elektrofiliniai reagentai. Į nesimetrišką alkeną pridėjus bet kokį nesimetrišką elektrofilą (HBr, ICl, H 2 O, Hg (OAc) 2 ir kt.), Iš principo galima gauti dviejų alternatyvių produktų mišinį, tačiau praktiškai dažniausiai susidaro tik vienas iš jų. Kaip pavyzdį apsvarstykite vandenilio bromido pridėjimą į propileną.

Dar 1870 m. V.V. Markovnikovas suformulavo nykščio taisyklę, pagal kurią asimetriniai alkenai yra prijungti prie HX taip, kad daugiausia susidaro produktas, kuriame vandenilis yra prijungtas prie mažiausiai pakeisto galo, o X - prie labiausiai pakeisto dvigubo ryšio galo.
Paprastai Markovnikovo taisyklė paaiškinama dviejų alternatyvių karbokacijų stabilumo skirtumu. Pavyzdžiui, aukščiau pateiktame pavyzdyje įprasta n-propilkatijonas yra daug mažiau stabilus nei izopropilkatijonas, todėl reakcija vyksta antruoju keliu.
Markovnikovo taisyklė iš pradžių buvo naudojama tik tais atvejais, kai HX buvo pridėta prie angliavandenilių substratų, tačiau iš esmės ją galima išplėsti ir į kitų pakeistų alkenų reakcijas. Taigi HCl pridedant prie CF3CH \u003d CH2 gaunama " anti-markovnik "produktas CF 3 CH 2 CH 2 Cl. To reikia tikėtis, nes katijonas CF 3 CH + CH 3 yra mažiau stabilus nei katijonas CF 3 CH 2 CH 2+ dėl stipraus (-I)-CF 3 grupės poveikio Daugiausia susidaro katijonas CF 3 CH 2 CH 2+, tačiau jį, nors ir kiek mažiau, destabilizuoja indukcinis CF 3 grupės poveikis, dėl kurio HCl į trifluormetiletileną dedama daug lėčiau nei į nepakeistą etileną.
Dėl panašios priežasties viniltrialkilamonio katijonai prideda HBr taip pat prieš Markovnikovo taisyklę:
HX pridėjimas prie alkenų, turinčių stiprių (-I) ir (-M) pakaitų, pavyzdžiui, į akrilnitrilą ar nitroetileną, taip pat turėtų prieštarauti Markovnikovo taisyklei. Tačiau šiuo atveju dvigubas ryšys yra taip stipriai išjungtas elektrofilinių reagentų atžvilgiu, kad šios reakcijos vyksta tik labai atšiauriomis sąlygomis. Vinilo chloridas CH 2 \u003d CHCl visada duoda tik „Markovnikovo aduktus“. Pavyzdžiui, kai jis reaguoja su HCl, susidaro tik 1,1-dichloretanas (geminalinis dichloridas) CH 3 CHCl 2. Chloras, panašiai kaip CF 3 grupės, turi stiprų (-I) efektą, ir iš pirmo žvilgsnio atrodo, kad dėl šios priežasties priedas turėtų būti nukreiptas antimarkoviškai, nes + CH 2 CH 2 Cl katijonas turėtų būti stabilesnis nei katijonas CH3CH + Cl. Tačiau, priešingai nei CF 3 grupės, chloras, be (-I) -efekto, taip pat turi priešingą (+ M) -efektą (nes jis turi pavienes poras). Patirtis rodo, kad mezomerinio efekto pakanka norint sumažinti 1-chloretilo katijono energiją žemiau 2-chloretilo katijono energijos lygio, kuriame + M poveikis nepasireiškia.
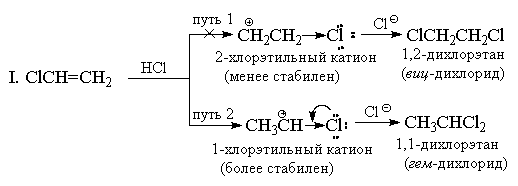
II. Rezonanso teorijos požiūriu 1-chloretilo katijono struktūra gali būti pavaizduota taip:
Nepaisant to, tomis pačiomis sąlygomis į vinilo chloridą dedama lėčiau nei į etileną, t. Y. Pagal bendrą poveikį (-I\u003e + M) chloras, palyginti su vandeniliu, lieka elektroną pašalinančiu pakaitalu, o 1-chloretilo katijonas yra mažiau stabilus. nei C2H5 +. Kiti vinilo halogenidai panašiai reaguoja su HX.
Vinilo eteriai CH 2 \u003d CHOR prideda HX (X \u003d Hal) pagal Markovnikovo taisyklę daug didesniu greičiu nei visi aukščiau išvardyti pakaitiniai alkenai. Taip yra dėl reikšmingo RO grupės + M efekto. Priešingai nei chloro atomas, RО grupė pagal bendrą elektroninį efektą (+ M\u003e -I) yra stiprus elektronų donorų pakaitalas, kuris efektyviai stabilizuoja kaimyninį karbokacijos centrą. Karbokacijos struktūra šiuo atveju taip pat gali būti pavaizduota kaip dviejų rezonansinių struktūrų rinkinys
Oksonio katijono atakas su halogenido anijonu lemia CH 3 CH (Hal) OR tipo α-haloesterių susidarymą.
4.3.y. Alkenų hidratacija
Rūgštimi katalizuojamas alkenų hidratavimas lemia alkoholių susidarymą. Alkenų hidratacijos kryptį nustato Markovnikovo taisyklė, todėl daroma prielaida, kad šioje reakcijoje karbokacija susidaro kaip tarpinė dalelė.
Antrinių alkilo karbokacijų pertvarkymo tendencija neleidžia naudoti alkenų hidratacijos, norint gauti antrinius alkoholius.

Šis metodas laboratorijoje nustatė ribotą taikymo sritį tik tretinių alkoholių gamybai. Šiuo atveju hidratacijos reakcija iš esmės yra grįžtama, o tretiniai alkoholiai susidaro iš mažų derlių (40–45%).


Paprasčiausių alkenų, etileno ir propileno, drėkinimas yra svarbus pramoninis etilo ir izopropilo alkoholių gamybos metodas.

Laboratorinėje praktikoje tiesioginis alkenų hidratavimas nebuvo plačiai pritaikytas tiek dėl atšiaurių sąlygų, tiek dėl didelio izomerinių alkoholių susidarymo. Šiuo metu regioselektyviai alkoholių gamybai iš alkenų paprastai naudojama susijusi hidroksimetrikacijos reakcija, demerkuracija.
4.3.d. Hidroksimerizacija-demerkurizacija
Elektrofilinį alkeno dvigubo ryšio užpuolimą gali įvykdyti metalo jonai, tarp kurių gyvsidabrio (II) katijonas užima ypatingą poziciją. Gyvsidabrio acetatas labai lengvomis sąlygomis 20 ° C temperatūroje prideda alkenų vandeniniame tetrahidrofurane (THF) arba vandeninėje acto rūgštyje, kad susidarytų organiniai gyvsidabrio junginiai. Gyvsidabrio acetato pridėjimas prie dvigubos jungties vyksta regiospecifiškai, griežtai laikantis Markovnikovo taisyklės, t.y., gyvsidabrio katijonas yra prijungtas prie mažiausiai pakeisto anglies atomo.
Gyvsidabrio organiniuose junginiuose esantį C-Hg ryšį galima lengvai suardyti veikiant natrio borohidridu NaBH 4, susidarant gyvsidabriui ir naujiems bendravimas C-H... Daroma prielaida, kad alkilo gyvsidabrio hidridas gaunamas kaip nestabilus tarpinis produktas, kuris toliau suyra radikaliai išsiskirdamas metaliniam gyvsidabriui.

Iš viso šis dviejų pakopų hidroksimercuracijos-demerkuravimo procesas galiausiai reiškia regiospecifinį alkeno hidrataciją pagal Markovnikovo taisyklę itin švelniomis sąlygomis, kai šalutinių produktų susidarymas sumažėja iki maksimalaus įmanomo minimumo. Tai galima aiškiai iliustruoti naudojant šiuos pavyzdžius, kuriuose bendras reakcijos produktų išeiga yra 90-98%. Pateikti skaitmeniniai duomenys šiuo atveju reiškia ne gautų junginių išeigas, o jų santykį mišinyje.




Kaip matyti iš aukščiau pateiktų pavyzdžių, alkenų hidroksimerizacija-demerkurizacija daugeliu atvejų suteikia regiospecifinį alkenų hidrataciją, susidarant praktiškai tik vienam iš dviejų izomerinių alkoholių. Reikėtų pažymėti, kad gyvsidabrio organinio junginio atskirti nereikia ir abu procesus galima atlikti tiesiogiai vienas po kito.
Nesimetriškų alkenų hidroksimerizacija, matyt, prasideda nuo AcOHg + katijono atakos ir nesimetrinio ciklinio merkurinio katijono kaip tarpinio produkto susidarymo (asimetrinio halogenonio jono analogas), kuris tada atsidaro dėl nukleofilinės vandens atakos labiausiai pakeistame anglies atome, kuris turi didesnį teigiamą krūvį.

Tiltinį gyvsidabrio joną galima užfiksuoti ne nukleofilinėje stiprioje rūgštyje net 20 ° C temperatūroje, pridedant stipresnio elektrofilinio agento - gyvsidabrio trifluoracetato fluorosulfonrūgšties ir stibio pentafluorido mišinyje.

Gyvsidabrio katijoną galima padalyti ne tik veikiant vandenį, bet ir kitais elektronų donorų tirpikliais: alkoholiais, acto rūgštis, acetonitrilas ir kt. Šiuo atveju galutinis reakcijos produktas bus atitinkamai eteriai, acetatai arba N-pakeisti acto rūgšties amidai, pavyzdžiui:


Kai alkoksimerizacijos-demerkuracijos reakcijoje naudojami šakotieji antriniai arba tretiniai alkoholiai, trifluoracetatas Hg (OCOCF 3) 2 arba gyvsidabrio triflatas Hg (OSO 2 CF 3) 2 yra efektyvesni už gyvsidabrio acetatą.

Taigi, hidroksi- ir alkoksimercuravimo-demerkuravimas yra vienas iš geriausių paruošiamųjų alkoholių ir eterių su išsišakojusiais alkilo radikalais sintezės metodų.
Gyvsidabrio druskų pridėjimas prie alkenų yra ryškiausias konjuguoto pridėjimo prie dvigubo ryšio pavyzdys, kai tirpiklis veikia kaip išorinis nukleofilinis agentas. Dvigubos hidroksimercuracijos-demercuracijos proceso stereochemija priklauso nuo kiekvieno atskiro žingsnio stereocheminio rezultato. Hidroksimerizacijai būdinga anti-papildymas, kaip ir kitoms reakcijoms, susijusioms su cikliniu katijonu. Tačiau radikalus demercuration nėra labai stereoselektyvus. Todėl visas procesas kaip visuma taip pat nėra stereospecifinis.
4.3.e. Alkenų pridėjimas (katijoninė dimerizacija ir alkenų polimerizacija)
Įdomiausias tokio tipo reakcijos pavyzdys yra izobutileno dimerizavimas ir polimerizavimas, esant sieros rūgščiai.

Techninis šio alkenų mišinio pavadinimas yra „diizobutilenas“. Ši reakcija vyksta katijoniniu mechanizmu, panašiu į mineralų rūgščių pridėjimo į dvigubą alkenų jungtį mechanizmą. Pirmajame etape į izobutileno molekulę pridedamas protonas, kad susidarytų gana stabilus trina-butilo katijonas. Toliau susiformavo trinaβ-butilo katijonas (Lewiso rūgštis) reaguoja su izobutileno molekule (Lewiso bazė) ir sudaro naują stabilų tretinį oktilo katijoną.

Šiomis sąlygomis, veikiant bazėms (H 2 O, HSO 4 - jonams), oktilkarbonacija greitai praranda protoną ir virsta izomerinių pentenų mišiniu, nes protonas atsiskiria iš dviejų skirtingų padėčių:

Vyraujantis termodinamiškai mažiau stabilaus alkeno - 2,4,4-trimetilpenteno-1 susidarymas (80% reakcijos mišinyje) yra susijęs su didesniu metilo grupių erdviniu pasiekiamumu bazės atakai, palyginti su metileno grupės vandenilio atomais. Pramonėje „diizobutilenas“ hidrinamas ant Ni-Raney ir gaunamas „izooktanas“ (techninis 2,2,4-trimetilpentano angliavandenilio pavadinimas), kuris naudojamas kaip didelio oktano skaičiaus kuras vidaus degimo varikliams.
Esant didelei sieros rūgšties koncentracijai (daugiau nei 80%), katijoninė izobutileno polimerizacija susidaro polimerui, vadinamam poliizobutilenu (-CH2C (CH3) 2 -) n. Šis guminis polimeras naudojamas antikorozinėms ir hidroizoliacinėms dangoms, sandarikliams ir kt.
Be izobutileno, katijoniniu mechanizmu polimerizuojami 3-metilbuten-1, vinileteriai ir kai kurie stireno dariniai, galintys sudaryti gana stabilias karbokacijas. Vandenilio fluoridas ir Lewiso rūgštys taip pat naudojamos kaip katijoninės polimerizacijos katalizatoriai: BF 3, AlCl 3, AlBr 3 ir kt., Esant labai mažam vandens kiekiui.
4.3.j. Alkanų pridėjimas (alkenų alkilinimas)
Kitas pramoninis "izooktano" sintezės metodas pagrįstas izobutileno sąveika su izobutano pertekliumi esant koncentruotai sieros rūgščiai arba bevandeniame vandenilio fluoride 0 10 0 C temperatūroje.

Ši reakcija taip pat vyksta katijoniniu mechanizmu ir, kas yra ypač įdomu, yra grandininio katijoninio proceso pavyzdys. Pirma, izobutilenas dimerizuojasi reakcijos sąlygomis ir susidaro tretinis oktilo katijonas (CH3) 3CCH2C + (CH3) 2. Jo susidarymo mechanizmas išsamiai aprašytas ankstesniame skyriuje. Be to, vyksta greitas vandenilio (hidrido jonų pavidalu) perkėlimas iš izobutano į oktilo katijoną, susidarant „izooktano“ molekulei ir naujam tret-butilo katijonui, kuris savo ruožtu greitai reaguoja su izobutilenu, kad susidarytų naujas oktilo katijonas ir kt.

Be izooktano sintezės, šis alkilinimo metodas yra naudojamas naftos chemijos pramonėje sintetinant labai verdančius išsišakojusius angliavandenilius iš išsišakojusių alkenų ir mažai verdančių alkanų terminio krekingo frakcijos būdu.
Alkenai yra nesotieji alifatiniai angliavandeniliai, turintys vieną ar daugiau anglies-anglies dvigubų jungčių. Dvigubas ryšys transformuoja du anglies atomus į plokščią struktūrą, kurios jungimosi kampai tarp gretimų jungčių yra 120 ° C:
Homologinė alkenų serija turi bendrą formulę; pirmieji du jos nariai yra etenas (etilenas) ir propenas (propilenas):

Keturių ar daugiau anglies atomų turinčių alkenų serijos nariai turi jungties padėties izomerizmą. Pavyzdžiui, formulės formulės alkenas turi tris izomerus, iš kurių du yra jungties padėties izomerai:
Atkreipkite dėmesį, kad alkenų grandinė yra sunumeruota nuo to galo, kuris yra arčiau dvigubo ryšio. Dvigubos jungties padėtį rodo apatinis iš dviejų skaičių, kurie atitinka du anglies atomus, sujungtus dviguba jungtimi. Trečiasis izomeras turi šakotą struktūrą:

Bet kurio alkeno izomerų skaičius didėja priklausomai nuo anglies atomų skaičiaus. Pavyzdžiui, heksenas turi tris jungties padėties izomerus:
dienai yra buta-1,3-dienas arba tiesiog butadienas:
Junginiai, turintys tris dvigubus ryšius, vadinami trienais. Junginiai, turintys kelis dvigubus ryšius, bendrai vadinami polienais.
Fizinės savybės
Alkenų lydymosi ir virimo temperatūros yra šiek tiek žemesnės nei atitinkamų alkanų. Pavyzdžiui, pentanas turi virimo temperatūrą. Kambario temperatūroje ir normaliame slėgyje etilenas, propenas ir trys buteno izomerai yra dujiniai. Alkenai, kurių anglies atomų skaičius yra nuo 5 iki 15, normaliomis sąlygomis yra skystoje būsenoje. Jų lakumas, kaip ir alkanų, didėja, kai anglies grandinėje yra šakojasi. Alkenai, turintys daugiau nei 15 anglies atomų, yra kietosios medžiagos normaliomis sąlygomis.
Gavimas laboratorinėmis sąlygomis
Du pagrindiniai alkenų paruošimo laboratorijoje metodai yra alkoholių dehidracija ir halogenalkanų dehidrohalogeninimas. Pavyzdžiui, etileną galima gauti dehidratuojant etanolį veikiant koncentruotos sieros rūgšties perteklių 170 ° C temperatūroje (žr. 19.2 skyrių):
Etilenas taip pat gali būti gaunamas iš etanolio, praleidžiant etanolio garus per pašildyto aliuminio oksido paviršių. Šiuo tikslu galite naudoti diegimą, schematiškai parodytą Fig. 18.3.
Antrasis plačiai paplitęs alkenų gavimo būdas pagrįstas halogenalkanų dehidrohalogeninimu bazinės katalizės sąlygomis.
Šio tipo eliminacijos reakcijos mechanizmas aprašytas sek. 17.3.
Alkenų reakcijos
Alkenų turi daug daugiau reaktyvumasnei alkanai. Taip yra dėl dvigubo ryšio -elektronų gebėjimo pritraukti elektrofilus (žr. 17.3 skyrių). Todėl būdingos alkenų reakcijos daugiausia yra elektrofilinio prisijungimo prie dvigubo ryšio reakcijos:

Daugelis šių reakcijų turi joninius mechanizmus (žr. 17.3 skyrių).
Hidrinimas
Jei koks nors alkenas, pavyzdžiui, etilenas, sumaišomas su vandeniliu ir šis mišinys kambario temperatūroje praleidžiamas per platinos katalizatoriaus paviršių arba apie 150 ° C temperatūros nikelio katalizatorių, tada bus dedama
vandenilis ant alkeno dvigubos jungties. Tai sudaro atitinkamą alkaną:

Šio tipo reakcijos yra heterogeninės katalizės pavyzdys. Jo mechanizmas aprašytas sek. 9.2 ir schematiškai parodyta fig. 9.20.
Halogenų pritvirtinimas
Chloras arba bromas lengvai prisijungia prie dvigubo alkeno jungties; ši reakcija vyksta nepoliniuose tirpikliuose, tokiuose kaip tetrachlormetanas arba heksanas. Reakcija vyksta joniniu mechanizmu, kuris apima karbokacijos susidarymą. Dvigubas ryšys poliarizuoja halogeno molekulę, paversdamas ją dipoliu:

Todėl suplakti su alkenu bromo tirpalas heksane arba tetrachlormetane keičia spalvą. Tas pats atsitinka, jei alkenas suplakamas su bromo vandeniu. Bromo vanduo yra bromo tirpalas vandenyje. Šiame tirpale yra hipobromo rūgšties. Hipobromo rūgšties molekulė prisijungia prie dvigubo alkeno jungties ir sudaro bromo alkoholį. pavyzdžiui

Vandenilio halogenidų sujungimas
Šio tipo reakcijos mechanizmas aprašytas sek. 18.3. Apsvarstykite vandenilio chlorido pridėjimą į propeną:
Atkreipkite dėmesį, kad šios reakcijos produktas yra 2-chloropropanas, o ne 1-chloropropanas:
![]()
Tokiose papildymo reakcijose prie anglies atomo, sujungto su
mažiausias vandenilio atomų skaičius. Šis modelis vadinamas Markovnikovo taisykle.
Pageidautinas elektronegatyvaus atomo ar grupės prijungimas prie anglies atomo, sujungto su mažiausią vandenilio atomų skaičiumi, yra dėl padidėjusio karbokacijos stabilumo, nes ant alkio padidėja alkilo pakaitų skaičius. Savo ruožtu šis stabilumo padidėjimas paaiškinamas indukciniu poveikiu, atsirandančiu alkilo grupėse, nes jie yra elektronų donorai:

Esant bet kokiam organiniam peroksidui, propenas reaguoja su vandenilio bromidu, formuodamasis, t. Y. Ne pagal Markovnikovo taisyklę. Toks produktas vadinamas anti-Markovnikovu. Jis susidaro dėl radikalios reakcijos, o ne dėl joninio mechanizmo.
Drėkinimas
Alkenai reaguoja su šalta koncentruota sieros rūgštimi ir susidaro alkilo vandenilio sulfatai. pavyzdžiui

Ši reakcija yra papildymas, nes ji apima rūgšties pridėjimą prie dvigubo ryšio. Tai yra atvirkštinė reakcija į etanolio dehidrataciją, kad susidarytų etilenas. Šios reakcijos mechanizmas yra panašus į vandenilio halogenidų pridėjimo prie dvigubos jungties mechanizmą. Tai apima tarpinio karbokacijos susidarymą. Jei šios reakcijos produktas atskiedžiamas vandeniu ir atsargiai pašildomas, jis hidrolizuojasi, kad gautų etanolį:
Sieros rūgšties pridėjimas prie alkenų paklūsta Markovnikovo taisyklei:

Reakcija su parūgštintu kalio permanganato tirpalu
Violetinė parūgštinto kalio permanganato tirpalo spalva išnyksta, jei šis tirpalas sukratomas mišinyje su bet kokiu alkenu. Alkenas hidroksilinamas (įvedama oksidacijos metu susidariusi hidroksi grupė), kuris paverčiamas diolu. Pavyzdžiui, kai perteklinis etileno kiekis sukratomas parūgštintu tirpalu, susidaro etan-1,2-diolis (etilenglikolis).

Jei alkenas suplakamas su pertekliniu β-jonų tirpalo kiekiu, oksidacinis skilimas alkenas, dėl kurio susidaro aldehidai ir ketonai:
Gauti aldehidai toliau oksiduojasi, kad susidarytų karboksirūgštys.
Alkenų hidroksilinimą, kad susidarytų dioliai, taip pat galima atlikti naudojant šarminis tirpalas kalio permanganatas.
Reakcija su perbenzoine rūgštimi
Alkenai reaguoja su peroksirūgštimis (rūgštimis), tokiomis kaip perbenzenkarboksirūgštis, susidaro cikliniai eteriai (epoksidiniai junginiai). pavyzdžiui

Kai epoksidanas atsargiai kaitinamas praskiestu rūgšties tirpalu, susidaro etan-1,2-diolis:

Reakcijos su deguonimi
Kaip ir visi kiti angliavandeniliai, alkenai dega ir, patekę į orą, sudaro anglies dioksidą ir vandenį:
Esant ribotam patekimui į orą, degant alkenams susidaro anglies monoksidas ir vanduo:
Kadangi alkenų santykinis anglies kiekis yra didesnis nei atitinkamų alkanų, jie degina, kad sukurtų rūkymo liepsną. Taip yra dėl anglies dalelių susidarymo:
Sumaišius alkeną su deguonimi ir praleidus šį mišinį per sidabro katalizatoriaus paviršių, esant maždaug 200 ° C temperatūrai, susidaro epoksidanas:
Ozonolizė
Kai dujinis ozonas praeina per alkeno tirpalą trichlormetane arba tetrachlormetane žemesnėje nei 20 ° C temperatūroje, susidaro atitinkamo alkeno (oksirano) ozonidas.

Ozonidai yra nestabilūs junginiai ir gali būti sprogstamieji. Jie hidrolizuojami, kad susidarytų aldehidai arba ketonai. pavyzdžiui

Šiuo atveju dalis metanalo (formaldehido) reaguoja su vandenilio peroksidu ir susidaro metano (skruzdžių) rūgštis:
Polimerizacija
Paprasčiausi alkenai gali polimerizuotis, kad susidarytų didelės molekulinės masės junginiai, turintys tą pačią empirinę formulę kaip ir pradinis alkenas:
Ši reakcija vyksta esant aukštam 120 ° C slėgiui ir esant deguoniui, kuris veikia kaip katalizatorius. Tačiau etileno polimerizaciją galima atlikti esant žemesniam slėgiui, naudojant Ziegler katalizatorių. Vienas iš labiausiai paplitusių „Ziegler“ katalizatorių yra trietilo aliuminio ir titano tetrachlorido mišinys.
Alkenų polimerizacija išsamiau aptariama sek. 18.3.








