Chemické vlastnosti prípravy alkénov, možnosť 1. Fyzikálne vlastnosti alkénov, použitie, spôsoby výroby
Alkény sú nenasýtené uhľovodíkyktoré majú jednu dvojitú väzbu medzi atómami. Ich ďalšie meno je olefíny, spája sa s históriou objavu tejto triedy zlúčenín. Tieto látky sa v zásade nenachádzajú v prírode, ale sú syntetizované ľuďmi na praktické účely. V nomenklatúre IUPAC sa názov týchto zlúčenín vytvára podľa rovnakého princípu ako v prípade alkánov, iba prípona „an“ sa nahrádza slovom „en“.
V kontakte s
Alkénova štruktúra
Dva atómy uhlíka, ktoré sa zúčastňujú na vytváraní dvojitej väzby, sú vždy v hybridizácii sp2 a uhol medzi nimi je rovný 120 stupňov. Dvojitá väzba je tvorená prekrývajúcimi sa π -π orbitálmi a nie je veľmi pevná, takže sa táto väzba dostatočne ľahko rozbije, čo sa využíva pri chemických vlastnostiach látok.
Izoméria
V porovnaní s obmedzujúcimi látkami je to v týchto uhľovodíkoch možné viac druhov, priestorové aj štrukturálne. Štrukturálny izomerizmus možno tiež rozdeliť do niekoľkých typov.
Prvý tiež existuje pre alkány a spočíva v inom poradí spojenia atómov uhlíka. Takže izomérmi môžu byť pentén-2 a 2-metylbutén-2. A druhou je zmena polohy dvojitej väzby.
Priestorová izoméria v týchto zlúčeninách je možná z dôvodu vzhľadu dvojitej väzby. Je to dva typy - geometrický a optický.
Geometrický izomerizmus je jedným z najrozšírenejších druhov v prírode, zatiaľ čo takmer vždy budú mať geometrické izoméry radikálne odlišné fyzikálne a chemické vlastnosti. Rozlišovať cis a trans izoméry.Pri prvom sú substituenty umiestnené na jednej strane viacnásobné pripojenie, zatiaľ čo pre trans izoméry sú v rôznych rovinách.
Výroba alkénov
 Najprv sa získali, rovnako ako mnohé iné látky, úplne náhodne.
Najprv sa získali, rovnako ako mnohé iné látky, úplne náhodne.
Nemecký chemik a výskumník Becher na konci 17. storočia skúmal vplyv kyseliny sírovej na etylalkohol a uvedomil si, že prijal neznámy plyn, ktorý je reaktívnejší ako metán.
Neskôr podobné štúdie uskutočnené niekoľkými ďalšími vedcami sa tiež dozvedeli, že tento plyn pri interakcii s chlórom vytvára olejovitú látku.
Preto spočiatku táto trieda zlúčenín bola dostal meno olefíny, čo sa prekladá ako mastná. Napriek tomu vedci nedokázali určiť zloženie a štruktúru tejto zlúčeniny. Stalo sa tak až takmer o dve storočia neskôr, na konci devätnásteho storočia.
V súčasnosti existuje veľa spôsobov, ako alkény získať.
Priemyselné metódy
Príjem priemyselné metódy:
- Dehydrogenácia nasýtených uhľovodíkov. Táto reakcia je možná iba za pôsobenia vysokých teplôt (asi 400 stupňov) a katalyzátorov - buď katalyzátorov na báze oxidu chrómu 3 alebo alumina-platiny.
- Dehalogenácia dihalogénalkánov. Vyskytuje sa iba v prítomnosti zinku alebo horčíka a pri vysokých teplotách.
- Dehydrohalogenácia halogénalkánov. Vykonáva sa za použitia sodných alebo draselných solí organických kyselín pri zvýšených teplotách.
Dôležité! Tieto spôsoby získavania alkénov neposkytujú čistý produkt; výsledkom reakcie bude zmes nenasýtených uhľovodíkov. Prevažujúce spojenie medzi nimi sa určuje pomocou Zaitsevovho pravidla. Hovorí sa v ňom, že vodík sa s najväčšou pravdepodobnosťou odštiepi od atómu uhlíka, ktorý má najmenej väzieb s vodíkmi.
Dehydratácia alkoholov. Môže sa vykonávať iba pri zahriatí a v prítomnosti roztokov silných minerálnych kyselín s vlastnosťou odstraňovať vodu.
Hydrogenácia alkínov. Možné iba za prítomnosti paladiových katalyzátorov.
Chemické vlastnosti alkénov
Alkény sú veľmi chemicky aktívne látky.Je to do značnej miery spôsobené prítomnosťou dvojitej väzby. Najcharakteristickejšími reakciami pre túto triedu zlúčenín sú elektrofilná a radikálová adícia.
- Halogenácia alkénov - označuje klasické reakcie elektrofilnej adície. Vyskytuje sa iba v prítomnosti inertných organických rozpúšťadiel, najčastejšie chloridu uhličitého.
- Hydrohalogenácia. Tento typ pripojenia sa vykonáva podľa pravidla Markovnikov. Ión sa viaže na viac hydrogenovaný uhlík v blízkosti dvojitej väzby a podľa toho sa halogenidový ión viaže na druhý uhlík. Toto pravidlo je porušené v prítomnosti peroxidových zlúčenín - Harroshov efekt. K pridaniu halogenidu vodíka dochádza úplne opačne k pravidlu Markovnikova.
- Hydroboračné. Táto reakcia má mimoriadny praktický význam. Preto vedec, ktorý ho objavil a študoval dokonca dostal Nobelovu cenu. Táto reakcia sa uskutočňuje v niekoľkých stupňoch, zatiaľ čo pridanie iónu bóru nedodržiava pravidlo Markovnikova.
- Alkény hydratujú alebo pridávajú. Táto reakcia tiež prebieha podľa pravidla Markovnikova. Hydroxidový ión je pripojený k najmenej hydrogenovanému atómu uhlíka v dvojitej väzbe.
- Alkylácia je ďalšou reakciou bežne používanou v priemysle. Spočíva v pridaní nasýtených uhľovodíkov do nenasýtených pod vplyvom nízkych teplôt a katalyzátorov, aby sa zvýšila atómová hmotnosť zlúčenín. Katalyzátorom sú najčastejšie silné minerálne kyseliny. Táto reakcia môže tiež prebiehať mechanizmom voľných radikálov.
- Ďalšou necharakteristickou reakciou nasýtených uhľovodíkov je polymerizácia alkénov. Znamená to vzájomné spojenie mnohých molekúl, aby sa vytvorilo silné spojenie, ktoré sa líši vo svojich fyzikálnych vlastnostiach.
 n v tejto reakcii je počet molekúl, ktoré vstúpili do väzby. Predpokladom pre implementáciu je kyslé prostredie, zvýšená teplota a zvýšený tlak.
n v tejto reakcii je počet molekúl, ktoré vstúpili do väzby. Predpokladom pre implementáciu je kyslé prostredie, zvýšená teplota a zvýšený tlak.
Alkény sa tiež vyznačujú ďalšími elektrofilnými adičnými reakciami, ktoré nedostali tak rozsiahlu praktickú distribúciu.
Napríklad reakcia pridania alkoholov za vzniku éterov.
Alebo pridanie chloridov kyselín s príjmom nenasýtených ketónov - Kondakovova reakcia.
Poznámka!Táto reakcia je možná iba v prítomnosti katalyzátora na báze chloridu zinočnatého.
Ďalšou hlavnou triedou reakcií charakteristických pre alkény sú radikálne adičné reakcie. Tieto reakcie sú možné iba vtedy, ak sa voľné radikály tvoria pod vplyvom vysokých teplôt, žiarenia a iných účinkov. Najcharakteristickejšou adičnou reakciou s radikálmi je hydrogenácia s tvorbou nasýtených uhľovodíkov. Vyskytuje sa výlučne pod vplyvom teploty a v prítomnosti platinového katalyzátora.
Vďaka prítomnosti dvojitej väzby sú alkény veľmi charakteristické pre rôzne látky oxidačné reakcie.
- Spaľovanie je klasická oxidačná reakcia. Bez katalyzátorov to beží dobre. V závislosti od množstva kyslíka sú možné rôzne konečné produkty: od oxidu uhličitého po uhlík.
- Oxidácia manganistanom draselným v neutrálnom prostredí. Produktmi sú viacsýtne alkoholy a hnedý oxid manganičitý. Táto reakcia sa považuje za kvalitatívnu pre alkény.
- Miernu oxidáciu je tiež možné uskutočniť pomocou peroxidu vodíka, oxidu osmičitého 8 a ďalších oxidačných činidiel v neutrálnom prostredí. Pre miernu oxidáciu alkénov je charakteristický iba jeden zlom väzby, reakčným produktom sú spravidla viacsýtne alkoholy.
- Je tiež možná silná oxidácia, pri ktorej sa obidve väzby rozpadajú a vytvárajú sa kyseliny alebo ketóny. Predpokladom je najčastejšie používané kyslé prostredie kyselina sírovápretože iné kyseliny môžu tiež podliehať oxidácii za vzniku vedľajších produktov.
Fyzikálne vlastnosti alkénov
 Jedinými plynmi za normálnych podmienok sú etylén, propén a butén.
Jedinými plynmi za normálnych podmienok sú etylén, propén a butén.
Od penténu po heptodecén sú všetky alkény v tekutom stave.
A všetko ostatné sú pevné látky.
Teploty topenia a varu sa zvyšujú úmerne so zvyšujúcou sa molekulovou hmotnosťou, môžu sa však líšiť pre izoméry.
Všetky alkény nerozpúšťajte vo vode, ale dobre sa rozpúšťajú v inertných organických rozpúšťadlách.
Aplikácia alkénov
Alkény sa široko používajú v priemysle a používajú sa na syntézu veľkého množstva látok. Napríklad etylén sa používa na syntézu polyvinylchloridu (PVC), styrénu, etylénglykolu, etanolu, polyetylénu, gumy a mnohých ďalších látok. Najväčší objem propylénu sa používa na výrobu polypropylénu.
Alkény - štruktúra, vlastnosti, použitie
Študujeme chémiu - vlastnosti alkénov, použitie v priemysle
Záver
Všeobecne môžeme s istotou povedať, že alkény sú kvôli svojim chemickým vlastnostiam v priemysle veľmi žiadané. Podieľajú sa na výrobe širokej škály plastov, gúm a mnohých ďalších látok.
Nižšie alkény (C 2 - C 5) sa vyrábajú v priemyselnom meradle z plynov vznikajúcich pri tepelnom spracovaní ropy a ropných produktov. Alkény je možné získať aj pomocou metód laboratórnej syntézy.
4.5.1. Dehydrohalogenácia
Keď sa na halogénalkány pôsobia zásady v bezvodých rozpúšťadlách, napríklad v alkoholovom roztoku hydroxidu draselného, \u200b\u200bvylučuje sa halogenovodík.
4.5.2. Dehydratácia
Pri zahrievaní alkoholov s kyselinou sírovou alebo fosforečnou dochádza k intramolekulárnej dehydratácii ( - eliminácia).
Hlavným smerom reakcie, ako v prípade dehydrohalogenácie, je tvorba najstabilnejšieho alkénu (Zaitsevovo pravidlo).
Dehydratáciu alkoholov je možné uskutočniť prechodom par alkoholu cez katalyzátor (oxidy hliníka alebo tória) pri teplote 300 - 350 ° C.
4.5.3. Dehalogenácia vicinálnych dihalogenidov
Pôsobením zinku v alkohole sa môžu dibromidy obsahujúce halogény susedných atómov (vicinálnych) premeniť na alkény.

4.5.4. Hydrogenácia alkínov
Keď sa alkíny hydrogenujú v prítomnosti platinových alebo niklových katalyzátorov, ktorých aktivita sa zníži pridaním malého množstva zlúčenín olova (katalytický jed), vytvorí sa alkén, ktorý nepodlieha ďalšej redukcii.
4.5.5. Redukčná kombinácia aldehydov a ketónov
Po pôsobení lítiumalumíniumhydridu a chloridu titaničitého sa z dvoch molekúl aldehydu alebo ketónu vytvárajú v dobrých výťažkoch di- alebo tetrasubstituované alkény.

5. ALKINY
Alkíny sú uhľovodíky obsahujúce trojitú väzbu uhlík-uhlík –CC–.
Všeobecný vzorec jednoduchých alkínov je CnH2n-2. Najjednoduchším predstaviteľom triedy alkínov je acetylén H-CC-H, preto sa alkánom hovorí aj acetylénové uhľovodíky.
5.1. Štruktúra acetylénu
Atómy uhlíka acetylénu sú v sp-hybridný stav. Poďme si predstaviť orbitálnu konfiguráciu takého atómu. Pri hybridizácii 2 s-orbitály a 2 s-orbitály sú tvorené dvoma ekvivalentmi sp-hybridné orbitaly umiestnené na jednej priamke a dva nehybridizované r-orbitálny.

Obrázok: 5.1 Schématvoreniesp -hybridné orbitaly atómu uhlíka
Pokyny a tvary orbitálov sr-hybridizovaný atóm uhlíka: hybridizované orbitaly sú ekvivalentné, maximálne vzdialené od seba
V molekule acetylénu jednoduchá väzba ( - väzba) medzi atómami uhlíka sa vytvára vzájomným prekrývaním sp-hybridizované orbitaly. Dve vzájomne kolmé - väzby vznikajú, keď dva páry nehybridizovaných 2p-orbitaly, - elektrónové oblaky pokrývajú kostru tak, že elektrónový mrak má symetriu blízku valcovitej. Väzby s atómami vodíka sa vytvárajú vďaka sp-hybridné orbitaly atómu uhlíka a 1 s-orbitály atómu vodíka, molekula acetylénu je lineárna.

Obrázok: 5.2 Molekula acetylénu
a - bočné prekrytie 2 sorbitals dáva dva -spojenia;
b - molekula je lineárna, - oblak má valcovitý tvar
V propíne existuje jednoduché spojenie ( - komunikácia s sp -ZO sp3 kratšie ako analogické pripojenie C sp -ZO sp2 v alkénoch je to spôsobené tým, že sp-obežná dráha bližšie k jadru ako sp 2 - orbitálny .
Trojitá väzba uhlík-uhlík C C je kratšia ako dvojitá väzba a celková energia trojitej väzby sa približne rovná súčtu energií jednej jednoduchej väzby C-C (347 kJ / mol) a dvoch väzieb (259,2 kJ / mol) (tabuľka 5.1) ).
Najjednoduchšie organické zlúčeniny sú nasýtené a nenasýtené uhľovodíky. Patria sem látky triedy alkánov, alkínov, alkénov.
Ich vzorce zahŕňajú vodík a atómy uhlíka v určitom poradí a množstve. V prírode sú bežné.
Stanovenie alkénov
Iným názvom sú olefíny alebo etylénové uhľovodíky. Tak sa táto skupina zlúčenín nazývala v 18. storočí, keď bola objavená olejová kvapalina - etylénchlorid.
Alkény sú látky zložené z vodíka a uhlíkových prvkov. Sú klasifikované ako acyklické uhľovodíky. V ich molekule existuje jednoduchá dvojitá (nenasýtená) väzba, ktorá spája dva atómy uhlíka.
Alkénove vzorce
Každá trieda zlúčenín má svoje vlastné chemické označenie. V nich symboly prvkov periodický systém je uvedené zloženie a väzbová štruktúra každej látky.

Všeobecný vzorec alkénov je označený takto: CnH2n, kde počet n je väčší alebo rovný 2. Pri jeho dešifrovaní je zrejmé, že pre každý atóm uhlíka existujú dva atómy vodíka.
Molekulárne vzorce alkénov z homológnej série sú reprezentované nasledujúcimi štruktúrami: C 2 H 4, C 3 H 6, C 4 H 8, C 5 H 10, C 6 H 12, C 7 H 14, C 8 H 16, C 9 H 18, C 10 H 20. Je zrejmé, že každý nasledujúci uhľovodík obsahuje ešte jeden uhlík a ďalšie 2 vodíky.
Je tam grafické označenie miesta a objednávky chemické zlúčeniny medzi atómami v molekule, čo je znázornené štruktúrnym vzorcom alkénov. Pomocou valenčných čiarok je naznačená väzba uhlíkov s vodíkmi.
Štruktúrny vzorec alkénov je možné zobraziť v rozšírenej forme, keď sú všetky chemické prvky a komunikácia. Stručnejší výraz pre olefíny neukazuje zlúčeninu uhlíka a vodíka pomocou valenčných pomlčiek.
Skeletový vzorec označuje najjednoduchšiu štruktúru. Prerušovaná čiara predstavuje bázu molekuly, v ktorej sú atómy uhlíka reprezentované jej vrcholmi a koncami a väzby naznačujú vodík.
Ako sa tvoria názvy olefínov
CH3-HC \u003d CH2 + H20 → CH3-OHCH-CH3.
Keď sú alkény vystavené pôsobeniu kyseliny sírovej, dôjde k procesu sulfonácie:
CH3-HC \u003d CH2 + HO-OSO-OH → CH3-CH3CH-O-SO2-OH.
Reakcia prebieha za tvorby kyslých esterov, napríklad kyseliny izopropylsírovej.
Alkény sú počas spaľovania citlivé na oxidáciu pôsobením kyslíka za vzniku vody a plynného oxidu uhličitého:
2CH 3-HC \u003d CH2 + 9O2 → 6CO2 + 6H20.
Interakcia olefinických zlúčenín a zriedeného manganistanu draselného vo forme roztoku vedie k tvorbe glykolov alebo kremelinových alkoholov. Táto reakcia je tiež oxidačná s tvorbou etylénglykolu a sfarbením roztoku:
3H2C \u003d CH2 + 4H20 + 2KMn04 → 3OHCH-CHOH + 2Mn02 + 2KOH.
Alkénové molekuly môžu byť zapojené do polymerizácie voľnými radikálmi alebo katiónovo-aniónovými mechanizmami. V prvom prípade sa pod vplyvom peroxidov získa polymér polyetylénového typu.
Podľa druhého mechanizmu pôsobia kyseliny ako katiónové katalyzátory a organokovové látky sú aniónové s uvoľňovaním stereoselektívneho polyméru.
Čo sú to alkány
Tiež sa nazývajú parafíny alebo nasýtené acyklické uhľovodíky. Majú lineárnu alebo rozvetvenú štruktúru, ktorá obsahuje iba nasýtené jednoduché väzby. Všetci zástupcovia tejto triedy majú všeobecný vzorec C n H 2n + 2.

Obsahujú iba atómy uhlíka a vodíka. Všeobecný vzorec pre alkény je odvodený od označenia nasýtených uhľovodíkov.
Názvy alkánov a ich vlastnosti
Najjednoduchším zástupcom tejto triedy je metán. Po ňom nasledujú látky ako etán, propán a bután. Ich názov vychádza z koreňa čísla v gréčtine, ku ktorému sa pripája prípona -an. Názvy alkánov sú uvedené v nomenklatúre IUPAC.
Všeobecný vzorec pre alkény, alkíny, alkány obsahuje iba dva typy atómov. Patria sem prvky uhlík a vodík. Počet atómov uhlíka vo všetkých troch triedach je rovnaký, rozdiel sa pozoruje iba v počte vodíka, ktorý je možné odštiepiť alebo pripojiť. Z dostať nenasýtené zlúčeniny. Zástupcovia parafínov v molekule obsahujú o 2 viac atómov vodíka ako olefíny, čo potvrdzuje aj všeobecný vzorec alkány, alkény. Alkénová štruktúra sa považuje za nenasýtenú v dôsledku prítomnosti dvojitej väzby.
Ak korelujeme počet atómov na báze vody a uhlíka v al-ka-nah, potom bude hodnota max-si-mal-ny v porovnaní s inými triedami ang-le-vo-do -ro-dov.
Od metánu po bután (od C1 do C4) existujú látky v plynnej forme.
V tekutej forme sú prezentované uhľovodíky s homológnym rozmedzím od C5 do C16. Počnúc alkánom, ktorý má v hlavnom reťazci 17 atómov uhlíka, dochádza k prechodu fyzikálneho stavu do tuhej formy.
Vyznačujú sa izomériou v uhlíkovom skelete a optickými modifikáciami molekuly.

V parafínoch sa uhlíkové valencie považujú za úplne obsadené susednými uhlami alebo vodnými tyčami s vytvorením väzby typu σ. Z hľadiska chi-ch-ch to určuje ich slabé vlastnosti, a preto sa alkány nazývajú pre-del-n-x alebo n-sy-schen-n-x ug-le-vo-do-ro- holubice bez afinity.
Vstupujú do substitučných reakcií spojených s radikálnou halogenáciou, sulfochloráciou alebo nitráciou molekuly.
Parafíny podliehajú oxidácii, spaľovaniu alebo rozkladu pri vysokých teplotách. Pôsobením urýchľovačov reakcie sa vylučujú atómy vodíka alebo sa dehydrogenujú alkány.
Čo sú to alkyny
Nazývajú sa tiež acetylénové uhľovodíky, ktoré majú trojitú väzbu v uhlíkovom reťazci. Štruktúra alkínov je opísaná všeobecným vzorcom CnH2n-2. Je z neho zrejmé, že na rozdiel od alkánov acetylénovým uhľovodíkom chýbajú štyri atómy vodíka. Sú nahradené trojitou väzbou tvorenou dvoma π-zlúčeninami.
Táto štruktúra určuje chemické vlastnosti tejto triedy. Štruktúrny vzorec alkénov a alkínov jasne ukazuje na nenasýtenie ich molekúl, ako aj na prítomnosť dvojitých (H2C꞊CH2) a trojitých (HC≡CH) väzieb.
Názov alkínov a ich vlastnosti
Najjednoduchším príkladom je acetylén alebo HC≡CH. Hovorí sa mu aj etín. Pochádza z názvu nasýteného uhľovodíka, v ktorom je odstránená prípona -an a pridaná -in. V názvoch dlhých alkínov číslo označuje umiestnenie trojitej väzby.
Ak poznáme štruktúru nasýtených a nenasýtených uhľovodíkov, je možné určiť, pod ktorým písmenom je uvedený všeobecný vzorec alkínov: a) CnH2n; c) CnH2n + 2; c) CnH2n-2; d) CnH2n-6. Treťou možnosťou je správna odpoveď.
Počínajúc acetylénom a končiac butánom (od C2 do C4), majú látky plynnú povahu.

Uhľovodíky s homológnym rozmedzím od C5 do C17 sú v tekutej forme. Počnúc alkínom, ktorý má v hlavnom reťazci 18 atómov uhlíka, dochádza k prechodu fyzikálneho stavu do tuhej formy.
Vyznačujú sa izomériou v uhlíkovom skelete, v polohe trojitej väzby, ako aj v medzitriednych modifikáciách molekuly.
Autor: chemické vlastnosti acetylénové uhľovodíky sú podobné alkénom.
Ak má alkín terminálnu trojitú väzbu, potom vykonáva funkciu kyseliny za tvorby alkynidových solí, napríklad NaC≡CNa. Prítomnosť dvoch π-väzieb robí z molekuly acetyledínu sodného silný nukleofil, ktorý vstupuje do substitučných reakcií.
Acetylén sa podrobí chlorácii v prítomnosti chloridu meďnatého, čím sa získa dichlóracetylén, kondenzácia za pôsobenia halogénalkynov s uvoľnením molekúl diacetylénu.
Alkíny sa zúčastňujú reakcií, ktorých princíp je základom halogenácie, hydrohalogenácie, hydratácie a karbonylácie. Takéto procesy sú však slabšie ako procesy alkénov s dvojnou väzbou.
Pre acetylénové uhľovodíky sú možné nukleofilné adičné reakcie molekuly alkoholu, primárneho amínu alebo sírovodíka.
4.3.b. Pridanie halogenovodíka (hydrohalogenácia)
Ďalšou dôležitou reakciou elektrofilnej adície na alkény je dobre známa hadrohalogenácia alkénov.
Ďalej sú uvedené typické príklady pridania HCl, HBr a HI do rôznych alkénov.


Účinok alkylových substituentov na dvojitú väzbu na rýchlosť pripojenia je opísaný v nasledujúcej postupnosti:
R2C \u003d CHR\u003e RCH \u003d CHR\u003e RCH \u003d CH2
To je v súlade s mechanizmom, v ktorom sa v štádiu určujúcim rýchlosť reakcie vytvára karbokácia, pretože stabilita alkylových katiónov klesá v terciárnom\u003e sekundárnom\u003e primárnom poradí. Adičný mechanizmus by teda mal zahŕňať medziprodukt tvorby buď voľnej karbokácie, ktorá sa zriedka pozoruje, alebo medziproduktu s karbokationovým charakterom. Posledný prípad je najtypickejší.
Ak by sa pridanie uskutočnilo prostredníctvom „voľnej karbokácie“, potom by reakcia bola úplne nestereoselektívna, pretože alkylové katióny majú plošnú štruktúru. Hydrohalogenácia však spravidla prebieha stereoselektívne a v závislosti od typu alkénu selektívne anti-spojenie, selektívne syn- alebo zmiešané syn-anti- ležiaci.
Pre alkény, v ktorých dvojitá väzba nie je konjugovaná s aromatickým kruhom, je charakteristická anti-prídavok halogenovodíka. Anti-pridáva sa chlorovodík a bromid, chlorid deutérium a bromid je pozorovaný pre cyklohexén, cyklopentén, 1,2-dimetylhexén, 1,2-dimetylpentén, cis- a tranzu-butén-2, hexén-3 a mnoho ďalších jednoduchých alkénov a cykloalkénov.

V adičnom produkte sú rovnaké substituenty (metylové skupiny) umiestnené na rôznych stranách stredovej roviny cyklohexánového kruhu, preto patria do tranzu-blízko. Anti-prídavok je ťažko kompatibilný s mechanizmom, v ktorom sa predpokladá tvorba diskrétnej karbokácie. Pre planárnu karbokáciu je nukleofilný útok halogenidového iónu rovnako pravdepodobný na oboch stranách roviny, čo by malo viesť k vytvoreniu zmesi produktov. syn- a anti-pripojenie. Kinetika hydrogénovania alkénu tiež poukazuje na zložitejší mechanizmus pridávania. Pre nekonjugované alkény je reakčná rýchlosť opísaná rovnicou tretieho rádu s halogenovodíkom druhého poriadku, to znamená, že zodpovedá mechanizmu Ad E3.
v \u003d k [alkén] 2
Anti-adícia a druhý poriadok reakcie, pokiaľ ide o halogenovodík, je v dobrej zhode s mechanizmom AdE 3, v ktorom alkén interaguje s dvoma molekulami halogenovodíka, z ktorých jedna pôsobí ako elektrofilné činidlo a druhá ako nukleofilné činidlo.

Tento trimolekulárny mechanizmus predpokladá, že sa pôvodne vytvorí komplex alkénu a jednej molekuly halogenovodíka, po ktorom nasleduje útok druhej molekuly HX na tento komplex s anti- strany bez tvorby diskrétnej karbokácie. Je potrebné osobitne poznamenať, že akýkoľvek trimolekulárny mechanizmus by mal pozostávať z dvoch po sebe nasledujúcich stupňov, pretože zrážka troch molekúl súčasne je mimoriadne nepravdepodobná.

Anti-adícia naznačuje výhodný nukleofilný útok halogenovodíka z opačnej strany ako je protónovaná alkén. Namiesto halogenidu vodíka môže byť funkcia nukleofilného činidla v konečnom štádiu tiež vykonaná pomocou halogenidového iónu. Skutočne sa reakčná rýchlosť zvyčajne zvyšuje priamo úmerne s koncentráciou halogenidového iónu zavedeného do reakčnej zmesi vo forme tetraalkylamóniumhalogenidov NR4+ X - alebo lítium LiX. V tomto prípade existuje stereošpecifický anti- ležiaci.
Pre alkány, v ktorých je dvojitá väzba konjugovaná k aromatickému kruhu, je charakteristická syn- ležiace alebo zmiešané syn-anti- prídavok halogenovodíka, napríklad:

Pripútanie k hriechu je dominantným procesom cis- a tranzu-izoméry 1-fenylpropénu, 1-fenyl-4-alkylcyklohexénu, acenaftylénu, indénu. Keď sú také alkény protonizované, vytvárajú sa karbokationty benzylového typu, ktoré sú stabilnejšie ako čisto alkylové katióny vznikajúce protonáciou bežných alkénov a cykloalkénov. Kinetika reakcie je v tomto prípade obvykle opísaná jednoduchšou rovnicou druhého rádu v \u003d k [alkén], tj. Zodpovedá bimolekulárnemu mechanizmu Ad E2. Ad E 2 - Mechanizmus spočíva v tvorbe iónového páru vrátane karbokácie a halogenidového iónu.

Nemožno očakávať, že mechanizmus pridávania zahŕňajúci iónové páry bude vysoko stereoselektívny. Ak sa iónový pár prevedie na konečný produkt rýchlejšie, ako sa točí okolo jednoduchej väzby uhlík-uhlík, konečný výsledok je syn- prídavok, kde protón a halogenidový ión sú pripojené k rovnakej strane dvojitej väzby. V opačnom prípade sa tvorba produktov pozoruje ako syn- a anti- pripojenie HX. To je prípad hydrohalogenácie pár-substituované styrény Z-C6H4-CH \u003d CH2. Tu pozorovaný vzorec je ten syn-adícia je typická iba pre tie olefíny, ktoré po protonácii poskytujú relatívne stabilnú karbokáciu, to znamená v prípade donorových substituentov Z.
Pre hydrohalogenačné reakcie prebiehajúce mechanizmom Ad E2 je charakteristická konkurencia medzi procesmi konjugovaného pridávania a prešmykov, pretože karbokatiónový alebo iónový pár sa vytvára ako medziprodukt.

Ako príklad prešmykov s 1,2-migráciou alkylovej skupiny a hydridového iónu uvádzame hydrohalogenačné reakcie terc-butyletylénu a izopropyletylénu.

Pri uskutočňovaní tej istej reakcie bez rozpúšťadla za studena (-78 ° C) vzniká zmes 33% normálneho a 67% abnormálneho (preusporiadaného) adičného produktu.

4.3.c. Orientácia. Vláda Markovnikova
Na rozdiel od symetrických elektrofilov (Hal 2) sú halogenovodíky asymetrické elektrofilné činidlá. Pridaním ľubovoľného nesymetrického elektrofilu (HBr, ICl, H20, Hg (OAc) 2 atď.) K nesymetrickému alkénu by sa v zásade mohla získať zmes dvoch alternatívnych produktov, ale v praxi sa zvyčajne tvorí iba jeden z nich. Ako príklad zvážte pridanie bromovodíka k propylénu.

Ešte v roku 1870 V.V. Markovnikov formuloval pravidlo, podľa ktorého sú asymetrické alkény pripojené k HX takým spôsobom, že sa vytvára prevažne produkt, v ktorom je vodík pripojený k najmenej substituovanému koncu dvojitej väzby a X k najsubstituovanejšiemu koncu dvojitej väzby.
Spravidla sa Markovnikovovo pravidlo vysvetľuje rozdielom v stabilite dvoch alternatívnych karbokácií. Napríklad v uvedenom príklade je to normálne n-propylový katión je oveľa menej stabilný ako izopropylový katión, a preto reakcia prebieha druhou cestou.
Markovnikovovo pravidlo sa pôvodne používalo iba pre prípady pridania HX k uhľovodíkovým substrátom, ale v zásade ho možno rozšíriť na reakcie iných substituovaných alkénov. Takže pridaním HCl k CF3CH \u003d CH2 sa získa „ anti-markovnik "produkt CF3CH2CH2CI. Dá sa to očakávať, pretože katión CF3CH + CH3 je menej stabilný ako katión CF3CH2CH2+ z dôvodu silného (-I) -účinku skupiny CF3 Katión CF3CH2CH2+ sa tvorí prevažne, ale tiež sa, aj keď v menšej miere, destabilizuje indukčným účinkom skupiny CF3, v dôsledku čoho je prídavok HCl k trifluórmetyletylénu oveľa pomalší ako pridanie k nesubstituovanému etylénu.
Z podobného dôvodu vinyltrialkylamóniové katióny pridávajú HBr aj proti pravidlu Markovnikova:
Proti pravidlu Markovnikova by malo ísť aj pridanie HX k alkénom so silnými (-I) a (-M) -substituentmi, napríklad k akrylonitrilu alebo nitroetylénu. Avšak v tomto prípade je dvojitá väzba vo vzťahu k elektrofilným činidlám tak silne deaktivovaná, že tieto reakcie prebiehajú iba za veľmi drsných podmienok. Vinylchlorid CH2 \u003d CHCl vždy dáva výlučne „Markovnikovove adukty“. Napríklad keď reaguje s HCl, vzniká iba 1,1-dichlóretán (geminálny dichlorid) CH3CHCI2. Chlór, podobne ako skupina CF 3, má silný (-I) -efekt a na prvý pohľad sa zdá, že z tohto dôvodu by malo mať pridanie anti-Markovovu orientáciu, pretože katión + CH2CH2CI by mal byť stabilnejší ako katión CH3CH + Cl. Avšak na rozdiel od skupiny CF3 má chlór okrem (-I) -efektu aj opačný (+ M) -efekt (pretože má osamelé páry). Prax ukazuje, že veľkosť mezomérneho účinku je celkom dostatočná na to, aby sa energia 1-chlóretyl katiónu znížila pod hladinu energie 2-chlóretyl katiónu, pri ktorej sa účinok + M neprejavuje.
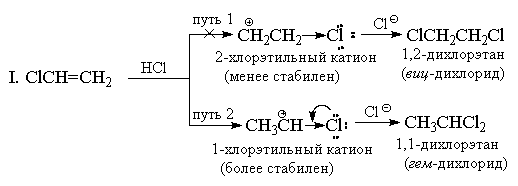
II. Z hľadiska teórie rezonancie možno štruktúru 1-chlóretyl katiónu predstaviť takto:
Napriek tomu k prídavku k vinylchloridu dochádza za rovnakých podmienok pomalšie ako k etylénu, to znamená, že podľa celkového účinku (-I\u003e + M) zostáva chlór v porovnaní s vodíkom substituentom priťahujúcim elektróny a 1-chlóretyl katión je menej stabilný. ako C2H5 +. Ostatné vinylhalogenidy reagujú podobným spôsobom s HX.
Vinylétery CH2 \u003d CHOR pridávajú HX (X \u003d Hal) podľa pravidla Markovnikova oveľa vyššou rýchlosťou ako všetky vyššie uvedené substituované alkény. Je to spôsobené významným + M-účinkom skupiny RO. Na rozdiel od atómu chlóru je skupina RO celkovým elektronickým efektom (+ M\u003e -I) silný substituent donoru elektrónov, ktorý účinne stabilizuje susedné karbokačné centrum. Štruktúra karbokácie v tomto prípade môže byť tiež predstavovaná ako sada dvoch rezonančných štruktúr
Útok oxóniového katiónu halogenidovým aniónom vedie k tvorbe α-halogénesterov typu CH3CH (Hal) OR.
4.3.r. Alkénová hydratácia
Hydratácia alkénov katalyzovaná kyselinami vedie k tvorbe alkoholov. Smer hydratácie alkénov je určený pravidlom Markovnikova; preto sa predpokladá, že pri tejto reakcii vzniká karbokácia ako intermediárna častica.
Tendencia preskupenia sekundárnych alkylkarbokácií zabraňuje použitiu hydratácie alkénov na získanie sekundárnych alkoholov.

Táto metóda v laboratóriu našla obmedzenú oblasť použitia iba na výrobu terciárnych alkoholov. Hydratačná reakcia je v tomto prípade do značnej miery reverzibilná a terciárne alkoholy sa tvoria v nízkych výťažkoch (40 - 45%).


Hydratácia najjednoduchších alkénov, etylénu a propylénu, je dôležitým priemyselným spôsobom výroby etylalkoholov a izopropylalkoholov.

V laboratórnej praxi nenašla priama hydratácia alkénov široké uplatnenie jednak kvôli drsným podmienkam, jednak kvôli tvorbe významného množstva izomérnych alkoholov. V súčasnosti sa na regioselektívnu výrobu alkoholov z alkénov zvyčajne používa príbuzná reakcia hydroxymerurácie, demercurácia.
4.3.d. Hydroxymerkurizácia-demerkurizácia
Elektrofilný útok na dvojitú väzbu alkénu je možné uskutočniť kovovými iónmi, medzi ktorými má špeciálne miesto katión ortuti (II). Acetát ortuťnatý sa za veľmi miernych podmienok pri teplote 20 ° C pridáva k alkénom vo vodnom tetrahydrofuráne (THF) alebo vodnej kyseline octovej za vzniku organ ortuťových zlúčenín. Pridanie octanu ortuťnatého k dvojitej väzbe prebieha regiošpecificky v prísnom súlade s pravidlom Markovnikova, t. J. Katión ortuti je pripojený k najmenej substituovanému atómu uhlíka.
Väzbu C-Hg v organ ortuťnatých zlúčeninách je možné ľahko štiepiť pôsobením borohydridu sodného NaBH4 za vzniku ortuti a nových komunikácia C-H... Predpokladá sa, že alkylhydrid ortuti sa získa ako nestabilný medziprodukt, ktorý sa ďalej rozkladá uvoľňovaním kovovej ortuti radikálnym mechanizmom.

Celkovo tento dvojstupňový proces hydroxymerurácie-demercurácie nakoniec predstavuje regiošpecifickú hydratáciu alkénu podľa pravidla Markovnikova za extrémne miernych podmienok, keď je tvorba vedľajších produktov obmedzená na maximálne možné minimum. To je možné jasne ilustrovať pomocou nasledujúcich príkladov, v ktorých je celkový výťažok reakčných produktov 90 - 98%. Dané digitálne údaje v tomto prípade neznamenajú výťažky výsledných zlúčenín, ale ich pomer v zmesi.




Ako je zrejmé z vyššie uvedených príkladov, hydroxymercurácia-demercurizácia alkénov vo väčšine prípadov poskytuje regiošpecifickú hydratáciu alkénov s tvorbou prakticky iba jedného z dvoch izomérnych alkoholov. Je potrebné poznamenať, že nie je potrebné separovať organ ortuťovú zlúčeninu a obidva procesy je možné uskutočňovať priamo po sebe.
Hydroxymerkurizácia nesymetrických alkénov zjavne začína útokom katiónu AcOHg + a tvorbou asymetrického cyklického katiónu merkurínium ako medziproduktu (analóg asymetrického halogéniového iónu), ktorý sa potom otvára v dôsledku nukleofilného útoku vodou na najsubstituovanejší atóm uhlíka, ktorý nesie vyšší pozitívny náboj.

Preklenovací ortuťový ión je možné fixovať v nenukleofilnom silne kyslom prostredí dokonca pri 20 ° C s prídavkom silnejšieho elektrofilného činidla - trifluóracetátu ortuťnatého v zmesi kyseliny fluórsulfónovej a pentafluoridu antimonitého.

Katión ortuti sa dá štiepiť nielen pôsobením vody, ale aj inými rozpúšťadlami, ktoré poskytujú elektróny: alkoholy, octová kyselina, acetonitril atď. Konečným produktom reakcie v tomto prípade budú étery, acetáty alebo N-substituované amidy kyseliny octovej, napríklad:


Ak sa pri alkoxymerkuračno-demerkuračnej reakcii použijú rozvetvené sekundárne alebo terciárne alkoholy, sú trifluóracetát Hg (OCOCF3) 2 alebo ortuti triflát Hg (OS02CF3) 2 účinnejšie ako octan ortuťnatý.

Teda hydroxy- a alkoxymerkurácia-demerkurácia je jednou z najlepších prípravných metód na syntézu alkoholov a éterov s rozvetvenými alkylovými radikálmi.
Pridanie solí ortuti k alkénom je najvýraznejším príkladom konjugovaného prídavku k dvojnej väzbe, kde rozpúšťadlo pôsobí ako externé nukleofilné činidlo. Stereochémia postupu dvojitej hydroxymerurácie-demercurácie závisí od stereochemického výsledku každého jednotlivého kroku. Hydroxymerkurizácia sa vyznačuje anti- pridanie, ako pri iných reakciách zahŕňajúcich cyklický katión. Radikálna demerkurizácia však nie je veľmi stereoselektívna. Preto je celý proces ako celok tiež nestereošpecifický.
4.3.e. Pridanie alkénov (katiónová dimerizácia a polymerizácia alkénov)
Najzaujímavejším príkladom tohto typu reakcie je dimerizácia a polymerizácia izobutylénu v prítomnosti kyseliny sírovej.

Odborný názov pre túto zmes alkénov je „diizobutylén“. Táto reakcia prebieha katiónovým mechanizmom, ktorý je podobný mechanizmu pridávania minerálnych kyselín k dvojitej väzbe alkénov. V prvom stupni sa k molekule izobutylénu pridá protón, aby sa vytvoril relatívne stabilný trieť-butyl katión. Ďalej formované trieť-butyl katión (Lewisova kyselina) reaguje s izobutylénovou molekulou (Lewisova báza) za vzniku nového stabilného terciárneho oktylového katiónu.

Za týchto podmienok pôsobením zásad (H20, ióny HSO4) oktylová karbokácia rýchlo stráca protón a mení sa na zmes izomérnych penténov, pretože k odštiepeniu protónu dochádza z dvoch rôznych pozícií:

Prevažujúca tvorba termodynamicky menej stabilného alkénu, 2,4,4-trimetylpenténu-1 (80% v reakčnej zmesi), je spôsobená väčšou priestorovou dostupnosťou metylových skupín pre napadnutie bázou v porovnaní s atómami vodíka metylénovej skupiny. V priemysle sa „diizobutylén“ hydrogenuje na Ni-Raneyovi a získa sa „izooktán“ (technický názov pre 2,2,4-trimetylpentánový uhľovodík), ktorý sa používa ako vysokooktánové palivo pre spaľovacie motory.
Pri vysokých koncentráciách kyseliny sírovej (viac ako 80%) dochádza ku katiónovej polymerizácii izobutylénu za vzniku polyméru nazývaného polyizobutylén (-CH2C (CH3) 2 -) n. Tento gumený polymér sa používa na získanie antikoróznych a hydroizolačných náterov, tmelov atď.
Okrem izobutylénu sú polymerizované katiónovým mechanizmom 3-metylbutén-1, vinylétery a niektoré styrénové deriváty schopné vytvárať relatívne stabilné karbokácie. Fluorovodík a Lewisove kyseliny sa tiež používajú ako katalyzátory katiónovej polymerizácie: BF3, AlCl3, AlBr3 atď. V prítomnosti veľmi malého množstva vody.
4.3.j. Pridanie alkánov (alkylácia alkénov)
Ďalšia priemyselná metóda syntézy „izooktánu“ je založená na interakcii izobutylénu s nadbytkom izobutánu v prítomnosti koncentrovanej kyseliny sírovej alebo v bezvodom fluorovodíku pri 0 10 0 C.

Táto reakcia tiež prebieha katiónovým mechanizmom a čo je obzvlášť zaujímavé, je príkladom reťazového katiónového procesu. Najskôr izobutylén dimerizuje za reakčných podmienok za vzniku terciárneho oktylového katiónu (CH3) 3CCH2C + (CH3) 2. Mechanizmus jeho formovania je podrobne popísaný v predchádzajúcej časti. Ďalej dochádza k rýchlemu prenosu vodíka (vo forme hydridového iónu) z izobutánu na oktylický katión za vzniku molekuly „izooktánu“ a nového terc-butylového katiónu, ktorý naopak rýchlo reaguje s izobutylénom za vzniku nového oktylického katiónu atď.

Okrem syntézy izooktánu sa táto alkylačná metóda používa v petrochemickom priemysle na syntézu vysokovriacich rozvetvených uhľovodíkov z rozvetvených alkénov a nízkovriacich alkánov z frakcie tepelného štiepenia.
Alkény sú nenasýtené alifatické uhľovodíky s jednou alebo viacerými dvojitými väzbami uhlík-uhlík. Dvojitá väzba transformuje dva atómy uhlíka na rovinnú štruktúru s uhlami väzby medzi susednými väzbami pri 120 ° C:
Homologická séria alkénov má všeobecný vzorec; jej prvými dvoma členmi sú etén (etylén) a propén (propylén):

Členovia série alkénov so štyrmi alebo viacerými atómami uhlíka vykazujú izomériu väzbovej polohy. Napríklad alkén vzorca má tri izoméry, z ktorých dva sú izoméry polohy väzby:
Upozorňujeme, že alkénový reťazec je číslovaný od toho konca, ktorý je bližšie k dvojitej väzbe. Poloha dvojitej väzby je označená nižším z dvoch čísel, ktoré zodpovedajú dvom atómom uhlíka viazaným dvojitou väzbou. Tretí izomér má rozvetvenú štruktúru:

Počet izomérov ľubovoľného alkénu sa zvyšuje s počtom atómov uhlíka. Napríklad hexén má tri izoméry polohy väzby:
diény je buta-1,3-dién alebo len butadién:
Zlúčeniny obsahujúce tri dvojité väzby sa nazývajú triény. Zlúčeniny s viacerými dvojitými väzbami sa súhrnne nazývajú polyény.
Fyzikálne vlastnosti
Alkény majú mierne nižšie teploty topenia a varu ako ich zodpovedajúce alkány. Napríklad pentán má teplotu varu. Etylén, propén a tri izoméry buténu sú plynné pri izbovej teplote a normálnom tlaku. Alkény s počtom atómov uhlíka od 5 do 15 sú za normálnych podmienok v tekutom stave. Ich prchavosť, podobne ako v prípade alkánov, stúpa s prítomnosťou rozvetvenia v uhlíkovom reťazci. Alkény s viac ako 15 atómami uhlíka sú za normálnych podmienok pevné látky.
Získanie v laboratórnych podmienkach
Dvomi hlavnými metódami na prípravu alkénov v laboratóriu sú dehydratácia alkoholov a dehydrohalogenácia halogénalkánov. Napríklad etylén je možné získať dehydratáciou etanolu pôsobením prebytku koncentrovanej kyseliny sírovej pri teplote 170 ° C (pozri oddiel 19.2):
Etylén je možné získať aj z etanolu prechodom pár etanolu cez povrch zahriateho oxidu hlinitého. Za týmto účelom môžete použiť inštaláciu schematicky znázornenú na obr. 18.3.
Druhá rozšírená metóda na získanie alkénov je založená na dehydrohalogenácii halogénalkánov za základných katalýznych podmienok.
Mechanizmus tohto typu eliminačnej reakcie je opísaný v kap. 17.3.
Alkenove reakcie
Alkény majú oveľa vyššie reaktivitaako alkány. Je to spôsobené schopnosťou elektrónov s dvojnou väzbou priťahovať elektrofily (pozri časť 17.3). Preto sú charakteristické reakcie alkénov hlavne reakcie elektrofilnej adície na dvojnej väzbe:

Mnohé z týchto reakcií majú iónové mechanizmy (pozri časť 17.3).
Hydrogenácia
Ak sa akýkoľvek alkén, napríklad etylén, zmieša s vodíkom a táto zmes sa nechá prechádzať cez povrch platinového katalyzátora pri teplote miestnosti alebo niklového katalyzátora pri teplote asi 150 ° C, potom dôjde k pridaniu.
vodík na dvojnej väzbe alkénu. Toto vytvára zodpovedajúci alkán:

Tento typ reakcie je príkladom heterogénnej katalýzy. Jeho mechanizmus je opísaný v kap. 9.2 a schematicky znázornené na obr. 9.20.
Pripojenie halogénov
Chlór alebo bróm sú ľahko pripojené na alkénovú dvojitú väzbu; táto reakcia prebieha v nepolárnych rozpúšťadlách, ako je tetrachlórmetán alebo hexán. Reakcia prebieha iónovým mechanizmom, ktorý zahrnuje tvorbu karbokácie. Dvojitá väzba polarizuje molekulu halogénu a mení ju na dipól:

Roztok brómu v hexáne alebo tetrachlórmetáne preto po pretrepaní s alkénom zmení farbu. To isté sa stane, ak sa alkén pretrepe s brómovou vodou. Brómová voda je roztok brómu vo vode. Tento roztok obsahuje kyselinu bromovodíkovú. Molekula kyseliny bromovodíkovej sa viaže na dvojitú väzbu alkénu za vzniku brómalkoholu. napríklad

Pripojenie halogenovodíkov
Mechanizmus reakcie tohto typu je popísaný v kap. 18.3. Ako príklad zvážte pridanie chlorovodíka k propénu:
Produkt tejto reakcie je 2-chlórpropán, nie 1-chlórpropán:
![]()
Pri takýchto adičných reakciách je najviac elektronegatívny atóm alebo najelektronegatívnejšia skupina vždy pripojený k atómu uhlíka
najmenší počet atómov vodíka. Tento vzorec sa nazýva pravidlo Markovnikov.
Výhodná väzba elektronegatívneho atómu alebo skupiny na atóm uhlíka naviazaný na najnižší počet atómov vodíka je spôsobená zvýšenou stabilitou karbokácie so zvyšujúcim sa počtom alkylových substituentov na uhlíku. Toto zvýšenie stability sa zase vysvetľuje indukčným účinkom vznikajúcim v alkylových skupinách, pretože sú to donory elektrónov:

V prítomnosti ľubovoľného organického peroxidu reaguje propén s bromovodíkom a vytvára sa, t.j. nie podľa Markovnikovovho pravidla. Takýto výrobok sa nazýva anti-Markovnikov. Vzniká v dôsledku radikálnej reakcie, nie iónového mechanizmu.
Hydratácia
Alkény reagujú so studenou koncentrovanou kyselinou sírovou za vzniku alkylhydrogénsulfátov. napríklad

Táto reakcia je adíciou, pretože zahrnuje adíciu kyseliny na dvojnej väzbe. Je to reverzná reakcia na dehydratáciu etanolu za vzniku etylénu. Mechanizmus tejto reakcie je podobný mechanizmu pridávania halogenovodíkov na dvojnú väzbu. Zahŕňa tvorbu medziľahlej karbokácie. Ak sa produkt tejto reakcie zriedi vodou a opatrne sa zahreje, hydrolyzuje na etanol:
Reakcia pridania kyseliny sírovej k alkénom sa riadi Markovnikovovým pravidlom:

Reakcia s okysleným roztokom manganistanu draselného
Fialové sfarbenie okysleného roztoku manganistanu draselného zmizne, ak sa tento roztok pretrepe v zmesi s alkénom. Alkén je hydroxylovaný (zavedením hydroxylovej skupiny vytvorenej v dôsledku oxidácie), ktorá je prevedená na diol. Napríklad, keď sa prebytočné množstvo etylénu pretrepe s okysleným roztokom, vytvorí sa etán-1,2-diol (etylénglykol).

Ak sa alkén pretrepe s prebytočným množstvom roztoku β-iónov, oxidačná degradácia alkén, ktorý vedie k tvorbe aldehydov a ketónov:
Výsledné aldehydy prechádzajú ďalšou oxidáciou za vzniku karboxylových kyselín.
Hydroxylácia alkénov za vzniku diolov sa môže tiež uskutočniť s použitím zásaditý roztok manganistan draselný.
Reakcia s kyselinou perbenzoovou
Alkény reagujú s peroxykyselinami (perkyselinami), ako je kyselina perbenzoová, za vzniku cyklických éterov (epoxidové zlúčeniny). napríklad

Keď sa epoxyetán opatrne zahrieva zriedeným roztokom kyseliny, vzniká etán-1,2-diol:

Reakcie s kyslíkom
Rovnako ako všetky ostatné uhľovodíky aj alkény horia a pri dostatočnom prístupe vzduchu tvoria oxid uhličitý a vodu:
Pri obmedzenom prístupe vzduchu vedie spaľovanie alkénov k tvorbe oxidu uhoľnatého a vody:
Pretože alkény majú vyšší relatívny obsah uhlíka ako zodpovedajúce alkány, horia za vzniku fajčiarskeho plameňa. Je to spôsobené tvorbou uhlíkových častíc:
Ak zmiešate akýkoľvek alkén s kyslíkom a prejdete touto zmesou cez povrch strieborného katalyzátora, vytvorí sa epoxyetán pri teplote asi 200 ° C:
Ozonolýza
Pri prechode plynného ozónu cez roztok alkénu v trichlórmetáne alebo tetrachlórmetáne pri teplotách nižších ako 20 ° C vzniká ozonid zodpovedajúceho alkénu (oxirán).

Ozonidy sú nestabilné zlúčeniny a môžu byť výbušné. Prechádzajú hydrolýzou za vzniku aldehydov alebo ketónov. napríklad

V tomto prípade časť metanalu (formaldehydu) reaguje s peroxidom vodíka za vzniku kyseliny metánovej (mravčej):
Polymerizácia
Najjednoduchšie alkény môžu polymerizovať pri tvorbe zlúčenín s vysokou molekulovou hmotnosťou, ktoré majú rovnaký empirický vzorec ako pôvodný alkén:
Táto reakcia prebieha pri vysokom tlaku, 120 ° C a v prítomnosti kyslíka, ktorý funguje ako katalyzátor. Polymerizáciu etylénu je však možné uskutočňovať pri nižších tlakoch s použitím Zieglerovho katalyzátora. Jedným z najbežnejších Zieglerových katalyzátorov je zmes trietylalumínia a chloridu titaničitého.
Polymerizácia alkénov je podrobnejšie diskutovaná v Sec. 18.3.








