Základy organickej chémie. Úžasný svet organických látok
Zo všetkej rozmanitosti chemické zlúčeniny väčšina (viac ako štyri milióny) obsahuje uhlík. Takmer všetky sú to organické látky. Organické zlúčeniny sa nachádzajú v prírode, ako sú sacharidy, bielkoviny, vitamíny, hrajú dôležitú úlohu v živote zvierat a rastlín. Mnoho organických látok a ich zmesí (plasty, guma, ropa, zemný plyn a iné) má veľký význam pre rozvoj národného hospodárstva krajiny.
Chémia uhlíkových zlúčenín sa nazýva organická chémia. Takto vyzeral veľký ruský organický chemik A.M. Butlerov. Avšak nie všetky zlúčeniny uhlíka sú zvyčajne klasifikované ako organické. Také jednoduché látky ako oxid uhoľnatý (II) CO, oxid uhličitý CO2, kyselina uhličitá H2CO3 a jej soli, napríklad CaCO3, K2CO3, sú klasifikované ako anorganické zlúčeniny. Okrem uhlíka môžu organické látky obsahovať aj ďalšie prvky. Najbežnejšie sú vodík, halogény, kyslík, dusík, síra a fosfor. Existujú aj organické látky obsahujúce ďalšie prvky vrátane kovov.
2. Štruktúra atómu uhlíka (C), štruktúra jeho elektrónového obalu
2.1 Hodnota atómu uhlíka (C) v chemickej štruktúre organických zlúčenín
CARBON (latinsky Carboneum), С, chemický prvok podskupiny IVa periodický systém; atómové číslo 6, atómová hmotnosť 12,0107, označuje nekovy. Prírodný uhlík sa skladá z dvoch stabilných nuklidov - 12C (98,892% hmotnosti) a 13C (1,108%) a jedného nestabilného - C s polčasom rozpadu 5730 rokov.
Distribúcia v prírode. Uhlík predstavuje 0,48% hmotnosti zemskej kôry, v ktorej je spomedzi ostatných prvkov na 17. mieste. Hlavnými horninami obsahujúcimi uhlík sú prírodné uhličitany (vápenec a dolomit); množstvo uhlíka v nich je asi 9 610 ton.
Vo voľnom stave sa uhlík vyskytuje prirodzene vo forme fosílnych palív, ako aj vo forme minerálov - diamantov a grafitov. Asi 1013 ton uhlíka sa koncentruje vo fosílnych palivách, ako je uhlie a hnedé uhlie, rašelina, bridlica, bitúmen, ktoré vytvárajú silné akumulácie v útrobách Zeme, ako aj v prírodných horľavých plynoch. Diamanty sú mimoriadne vzácne. Aj diamantové horniny (kimberlity) neobsahujú viac ako 9 - 10% diamantov s hmotnosťou spravidla viac ako 0,4 g. Nájdené veľké diamanty sa zvyčajne nazývajú zvláštnym názvom. Najväčší diamant Cullinan s hmotnosťou 621,2 g (3106 karátov) bol nájdený v Juhoafrickej republike (Transvaal) v roku 1905 a najväčší ruský orlovský diamant s hmotnosťou 37,92 g (190 karátov) bol nájdený v strede 17 storočie
Na dotyk čierno-šedá nepriehľadná mastná s kovovým leskom, grafit, je hromadením plochých polymérnych molekúl uhlíkových atómov, voľne navrstvených na seba. V tomto prípade sú atómy vo vrstve spojené silnejšie ako atómy medzi vrstvami.
Diamant je iná vec. Vo svojom bezfarebnom, priehľadnom a vysoko lomivom kryštáli je každý atóm uhlíka chemicky naviazaný na štyri rovnaké atómy umiestnené na vrcholoch štvorstenu. Všetky kravaty majú rovnakú dĺžku a sú veľmi pevné. Tvoria súvislý trojrozmerný rám v priestore. Celý diamantový kryštál je akoby jedna obrovská molekula polyméru, ktorá od tej doby nemá „slabé“ miesta sila všetkých väzieb je rovnaká.
Hustota diamantu pri 20 ° C je 3,51 g / cm3, grafit - 2,26 g / cm3. Fyzikálne vlastnosti diamantu (tvrdosť, elektrická vodivosť, koeficient tepelnej rozťažnosti) sú vo všetkých smeroch prakticky rovnaké; je najtvrdší zo všetkých látok nachádzajúcich sa v prírode. V grafite sú tieto vlastnosti v rôznych smeroch - kolmých alebo rovnobežných s vrstvami atómov uhlíka - veľmi odlišné: s malými priečnymi silami sa paralelné vrstvy grafitu navzájom posúvajú a vrstvia sa do jednotlivých vločiek, ktoré na papieri zanechávajú stopu. Podľa svojich elektrických vlastností je diamant dielektrikum, zatiaľ čo grafit vedie elektrický prúd.
Pri zahrievaní bez prístupu vzduchu nad 1 000 ° C sa diamant zmení na grafit. Pri konštantnom zahrievaní za rovnakých podmienok sa grafit nemení až na 3 000 ° C, keď sublimuje bez tavenia. Priamy prechod grafitu na diamant nastáva iba pri teplotách nad 3 000 ° C a enormnom tlaku - asi 12 GPa.
Tretia alotropická modifikácia uhlíka, carbyne, bola získaná umelo. Je to jemný kryštalický čierny prášok; vo svojej štruktúre sú dlhé reťazce atómov uhlíka navzájom rovnobežné. Každý reťazec má štruktúru (-C \u003d C) L alebo (\u003d C \u003d C \u003d) L. Hustota karbynu je priemerná medzi grafitom a diamantom -2,68-3,30 g / cm3. Jednou z najdôležitejších vlastností karabínu je jeho kompatibilita s tkanivami ľudského tela, čo umožňuje jeho použitie napríklad pri výrobe umelých krvných ciev, ktoré telo neodmieta (obr. 1).
Fullerenes dostal svoje meno nie na počesť chemika, ale po mene amerického architekta R. Fullera, ktorý navrhol postaviť hangáre a ďalšie stavby v podobe kupol, ktorých povrch tvoria päťuholníky a šesťuholníky (takáto kupola bola postavená napríklad v moskovskom parku Sokolniki).
Pre uhlík je tiež charakteristický stav s neusporiadanou štruktúrou - ide o tzv. amorfná uhlíková (sadza, koks, drevené uhlie) ryža. 2. Získavanie uhlíka (C):

Väčšina látok okolo nás sú organické zlúčeniny. Jedná sa o tkanivá zvierat a rastlín, naše potraviny, lieky, odevy (bavlna, vlnené a syntetické vlákna), palivo (ropa a zemný plyn), guma a plasty, čistiace prostriedky. V súčasnosti je známych viac ako 10 miliónov takýchto látok a ich počet každý rok rastie vďaka tomu, že vedci izolujú neznáme látky od prírodných objektov a vytvárajú nové zlúčeniny, ktoré sa v prírode nevyskytujú.
Takáto rozmanitosť organických zlúčenín súvisí s jedinečnou vlastnosťou atómov uhlíka, pri ktorej sa vytvárajú silné kovalentné väzby medzi sebou navzájom aj s inými atómami. Atómy uhlíka, ktoré sú navzájom spojené jednoduchou aj viacnásobnou väzbou, môžu vytvárať reťazce takmer akejkoľvek dĺžky a cyklov. Veľká rozmanitosť organické zlúčeniny tiež súvisí s existenciou fenoménu izomérie.
Takmer všetky organické zlúčeniny obsahujú aj vodík, často obsahujú atómy kyslíka, dusíka, menej často - síru, fosfor, halogény. Zlúčeniny obsahujúce atómy akýchkoľvek prvkov (s výnimkou O, N, S a halogénov), priamo viazané na uhlík, sa kombinujú pod názvom organoelementové zlúčeniny; hlavnou skupinou takýchto zlúčenín sú organokovové zlúčeniny (obr. 3).

Obrovské množstvo organických zlúčenín vyžaduje jasnú klasifikáciu. Základom organickej zlúčeniny je kostra molekuly. Kostra môže mať otvorenú (otvorenú) štruktúru, potom sa zlúčenina nazýva acyklická (alifatická; alifatické zlúčeniny sa tiež nazývajú mastné zlúčeniny, pretože sa najskôr izolovali z tukov) a uzavretá štruktúra sa potom nazýva cyklická. Kostra môže byť uhlík (skladajúci sa iba z atómov uhlíka) alebo môže obsahovať iné atómy ako uhlík - tzv. heteroatómy, najčastejšie kyslík, dusík a síra. Cyklické zlúčeniny sa ďalej členia na karbocyklické (uhlíkové), ktoré môžu byť aromatické a alicyklické (obsahujúce jeden alebo viac kruhov) a heterocyklické.
Atómy vodíka a halogénu nie sú obsiahnuté v kostre a heteroatómy sú zahrnuté v kostre, iba ak majú aspoň dve väzby s uhlíkom. V etylalkohole CH3CH2OH teda atóm kyslíka nie je obsiahnutý v kostre molekuly, ale v dimetyléteri CH3OCH3.
Acyklický skelet môže byť navyše nerozvetvený (všetky atómy sú umiestnené v jednom rade) a rozvetvený. Niekedy sa nerozvetvená kostra nazýva lineárna, treba si však uvedomiť, že štruktúrne vzorce, ktoré najčastejšie používame, vyjadrujú iba poradie väzieb, a nie skutočné usporiadanie atómov. „Lineárny“ uhlíkový reťazec má teda tvar cikcaku a môže sa v priestore krútiť rôznymi spôsobmi.
V kostre molekuly sa rozlišujú štyri typy atómov uhlíka. Je obvyklé nazývať atóm uhlíka primárnym, ak tvorí iba jednu väzbu s iným atómom uhlíka. Sekundárny atóm je naviazaný na dva ďalšie atómy uhlíka, terciárny - na tri a kvartérne míňa všetky svoje štyri väzby na tvorbu väzieb s atómami uhlíka.
Ďalším znakom klasifikácie je prítomnosť viacerých odkazov. Organické zlúčeniny obsahujúce iba jednoduché väzby sa nazývajú nasýtené (obmedzujúce). Zlúčeniny obsahujúce dvojité alebo trojité väzby sa nazývajú nenasýtené (nenasýtené). V ich molekulách je na jeden atóm uhlíka menej atómov vodíka ako v obmedzujúcich. Cyklické nenasýtené uhľovodíky benzénovej série sú klasifikované do samostatnej triedy aromatických zlúčenín.
Tretím znakom klasifikácie je prítomnosť funkčných skupín - skupín atómov, ktoré sú charakteristické pre túto triedu zlúčenín a určujú ju. chemické vlastnosti... Podľa počtu funkčných skupín sa organické zlúčeniny delia na monofunkčné - obsahujú jednu funkčnú skupinu, polyfunkčné - obsahujú niekoľko funkčných skupín, napríklad glycerol, a heterofunkčné - v jednej molekule existuje niekoľko rôznych skupín, napríklad aminokyseliny.
Podľa toho, ktorý atóm uhlíka má funkčnú skupinu, sa zlúčeniny delia na primárne, napríklad etylchlorid СН 3 НН 2 С1, sekundárne - izopropylchlorid (НН3) 2CHC1 a terciárne - butylchlorid (НН 8) 8 CCl.
Alkány(nasýtené uhľovodíky, parafíny) - acyklické nasýtené uhľovodíky všeobecného vzorca C n H 2n + 2. Podľa všeobecného vzorca sa tvoria alkány homológna séria.
Prví štyria zástupcovia majú semisystémové názvy - metán (CH 4), etán (C 2 H 6), propán (C 3 H 8), bután (C 4 H 10). Mená ďalších členov rady sú zostavené z koreňa (grécke čísla) a z prípony - an: pentán (C5H12), hexán (C6H14), heptán (C7H16) atď.
Atómy uhlíka v alkánoch sú v sp 3-hybridný stav. Osi štyri sp 3 -orbitaly sú nasmerované na vrcholy štvorstenu, uhly väzby sú 109 ° 28.
Priestorová štruktúra metánu:
Energia väzby C-C E c - od\u003d 351 kJ / mol, dĺžka väzby C-C 0,154 nm.
Väzba C-C v alkánoch je kovalentný nepolárny.Komunikácia C-H - kovalentný slabo polárny.
Pre alkány, počnúc butánom, existujú štrukturálne izoméry(štruktúrne izoméry), líšiace sa v poradí väzby medzi atómami uhlíka, s rovnakým kvalitatívnym a kvantitatívnym zložením a molekulovou hmotnosťou, ale líšia sa fyzikálnymi vlastnosťami.
 Metódy získavania alkánov
Metódy získavania alkánov
1.C n H 2n + 2\u003e 400 až 700 ° C\u003e Сp H 2p + 2 + Сm H 2m,
Krakovanie ropy (priemyselná metóda). Alkány sa tiež izolujú z prírodných zdrojov (prírodné a súvisiace plyny, ropa, uhlie).

(hydrogenácia nenasýtených zlúčenín)
3. nCO + (2n + 1) H2\u003e CnH2n + 2 + nH20 (získané zo syntézneho plynu (CO + H2))
4. (Würzova reakcia)

5. (Dumasova reakcia) CH3COONa + NaOH\u003e t\u003e CH4 + Na2C03
6. (Kolbeho reakcia)
 Chemické vlastnosti alkánov
Chemické vlastnosti alkánov Alkány nie sú schopné adičných reakcií, pretože v ich molekulách sú všetky väzby nasýtené, vyznačujú sa radikálnou substitučnou reakciou, tepelným rozkladom, oxidáciou a izomerizačnými reakciami.
1. (reaktivita klesá v poradí: F 2\u003e Cl 2\u003e Br 2\u003e (I 2 nejde), R 3 C\u003e R2 CH\u003e RCH 2\u003e RCH 3)

2. (Konovalovova reakcia)

3.CnH2n + 2 + SO2 +? 02\u003e h?\u003e CnH2n + 1S03H - kyselina alkylsulfónová
(sulfoxidácia, reakčné podmienky: UV ožarovanie)
4. CH4\u003e 1 000 ° C\u003e C + 2H2; 2CH 4\u003e t\u003e 1 500 ° C\u003e С 2 Н 2 + ЗН 2 (rozklad metánu - pyrolýza)
5.CH4 + 2H20\u003e Ni, 1 300 ° C\u003e CO 2 + 4H 2 (premena metánu)
6,2C n H 2n + 2 + (Зn + 1) O 2\u003e 2 nCO 2 + (2 n + 2) Н 2 O (spaľovanie alkánu)
7. 2n-С4Н10 + 5O2\u003e 4CH3COOH + 2Н20 (oxidácia alkánov v priemysle; získanie kyseliny octovej)
8. n-S4N10\u003e izo-C4H10 (izomerizácia, katalyzátor AlCl3)
2. Cykloalkány
Cykloalkány(cykloparafíny, naftény, cyklány, polymetylény) - nasýtené uhľovodíky s uzavretým (cyklickým) uhlíkovým reťazcom. Všeobecný vzorec C. n H 2n.
Atómy uhlíka v cykloalkánoch, rovnako ako v alkánoch, sú umiestnené v sp 3-hybridizovaný stav. Homologická sériacykloalkány sú štartované najjednoduchším cykloalkánom - cyklopropánom C 3 H 6, čo je rovinný trojčlenný karbocyklus. Podľa pravidiel medzinárodnej nomenklatúry v cykloalkánoch sa za hlavný reťazec považuje reťazec atómov uhlíka tvoriaci cyklus. Názov je založený na názve tohto uzavretého reťazca s predponou „cyklo“ (cyklopropán, cyklobután, cyklopentán, cyklohexán atď.).


Štruktúrna izoméria cykloalkánov je spojená s rôznymi veľkosťami cyklov (štruktúry 1 a 2), štruktúrou a typom substituentov (štruktúry 5 a 6) a ich vzájomným usporiadaním (štruktúry 3 a 4).
 Spôsoby prípravy cykloalkánov
Spôsoby prípravy cykloalkánov
1. Získavanie z dihalogénovaných uhľovodíkov

2. Získavanie z aromatických uhľovodíkov

 Chemické vlastnosti cykloalkánov
Chemické vlastnosti cykloalkánov Chemické vlastnosti cykloalkánov závisia od veľkosti cyklu, ktorý určuje jeho stabilitu. Nasýtené troj- a štvorčlenné cykly (malé cykly) sa výrazne líšia od všetkých ostatných nasýtených uhľovodíkov. Cyklopropán, cyklobután vstupujú do adičných reakcií. Pre cykloalkány (C5 a vyššie) sú vďaka svojej stabilite charakteristické reakcie, pri ktorých sa zachováva cyklická štruktúra, to znamená substitučné reakcie.
1. Pôsobenie halogénov

2. Pôsobenie halogenovodíkov
S cykloalkánmi obsahujúcimi v kruhu päť alebo viac atómov uhlíka halogenovodíky neinteragujú.

4. Dehydrogenácia

Alkenes(nenasýtené uhľovodíky, etylénové uhľovodíky, olefíny) - nenasýtené alifatické uhľovodíky, ktorých molekuly obsahujú dvojitú väzbu. Všeobecný vzorec série alkénov je С n Н 2n.
Podľa systematickej nomenklatúry sú názvy alkénov odvodené od názvov zodpovedajúcich alkánov (s rovnakým počtom atómov uhlíka) nahradením prípony - an na - en: etán (CH3-CH3) - etén (CH2 \u003d CH2) atď. Hlavný reťazec je zvolený tak, aby nevyhnutne zahŕňal dvojitú väzbu. Číslovanie atómov uhlíka začína od konca reťazca najbližšie k dvojitej väzbe.
V molekule alkénu sú nenasýtené atómy uhlíka umiestnené v sp 2-hybridizácia a dvojitá väzba medzi nimi je tvorená a - a? - väzbou. sp 2-Hybridné orbitaly smerujúce k sebe navzájom v uhle 120 ° a jeden nehybridizovaný 2 s-orbitál, ktorý sa nachádza v uhle 90 ° k rovine hybridných atómových orbitálov.
Priestorová štruktúra etylénu:

C \u003d dĺžka väzby C 0,134 nm, C \u003d energia väzby C E c \u003d c\u003d 611 kJ / mol, energia β-väzby E? \u003d260 kJ / mol.
Typy izomérie: a) izoméria reťazca; b) izoméria polohy dvojnej väzby; o) Z, E (cis, trans) - izoméria, druh priestorovej izomérie.
Metódy získavania alkénov1. CH3-CH3\u003e Ni, t\u003e CH2 \u003d CH2 + H2 (alkánová dehydrogenácia)
2. C 2 H 5 OH \u003e H, S04, 170 ° C\u003eCH2 \u003d CH2 + H20 (dehydratácia alkoholom)
3. (dehydrohalogenácia alkylhalogenidov podľa Zaitsevovho pravidla)

4. CH2CI-CH2CI + Zn\u003e ZnCl2 + CH2 \u003d CH2 (dehalogenácia dihalogénovaných derivátov)
5. HC ^ CH + H2 Ni, t\u003e CH2 \u003d CH2 (redukcia alkínov)
Chemické vlastnosti alkénovPre alkény sú najcharakteristickejšie adičné reakcie, ktoré sa ľahko oxidujú a polymerizujú.
1. CH2 \u003d CH2 + Br2\u003e CH2Br-CH2Br
(prídavok halogénov, kvalitatívna reakcia)
2. (pridanie halogenovodíkov podľa pravidla Markovnikova)
3. CH2 \u003d CH2 + H2 Ni, t\u003e CH3-CH3 (hydrogenácia)
4. CH2 \u003d CH2 + H20\u003e H +\u003e CH3CH2OH (hydratácia)
5. ЗCH2 \u003d CH2 + 2КMnO4 + 4Н20\u003e ЗCH2OH-CH2OH + 2MnO2 v + 2KOH (mierna oxidácia, kvalitatívna reakcia)
6. CH2 \u003d CH-CH2-CH3 + KMn04 H +\u003e CO 2 + C 2 H 5 COOH (tvrdá oxidácia)
7. CH2 \u003d CH-CH2-CH3 + O3\u003e H2C \u003d O + CH3CH2CH \u003d O formaldehyd + propanal\u003e (ozonolýza)
8. C 2 H 4 + 3 O 2\u003e 2 CO 2 + 2 H 2 O (spaľovacia reakcia)
9. (polymerizácia)

10. CH3-CH \u003d CH2 + HBr\u003e peroxid\u003e CH 3-CH 2-CH 2 Br (pridanie bromovodíka proti pravidlu Markovnikov)
11. (substitučná reakcia v polohe?)

Alkyne(acetylénové uhľovodíky) - nenasýtené uhľovodíky obsahujúce trojitú väzbu C? C. Všeobecný vzorec pre alkíny s jednou trojnou väzbou CnH2n-2. Najjednoduchší zástupca radu alkínov CH? CH má triviálny názov acetylén. Podľa systematickej nomenklatúry sú názvy acetylénových uhľovodíkov odvodené od názvov zodpovedajúcich alkánov (s rovnakým počtom atómov uhlíka) nahradením prípony - an na -v: etán (CH3-CH3) - etín (CH2CH) atď. Hlavný reťazec je zvolený tak, aby nevyhnutne obsahoval trojitú väzbu. Číslovanie atómov uhlíka začína od konca reťazca najbližšie k trojitej väzbe.
Tvorba trojitej väzby zahŕňa atómy uhlíka v sp-hybridizovaný stav. Každý z nich má dva sp-hybridné orbitaly namierené proti sebe v uhle 180 ° a dva nehybridné p- orbitaly umiestnené v uhle 90 ° voči sebe navzájom a k sp-hybridné orbitaly.
Priestorová štruktúra acetylénu:

Typy izomerizmu: 1) izomerizmus polohy trojitej väzby; 2) izoméria uhlíkového skeletu; 3) izoméria medzi triedami s alkadiénmi a cykloalkénmi.
Metódy získavania alkínov1. CaO + \u003eС\u003e t\u003e CaC2 + CO;
CaC2 + 2H20\u003e Ca (OH) 2 + CH? CH (získanie acetylénu)
2,2 CH4\u003e t\u003e 1 500 ° C\u003e HC \u003d CH + ЗН 2 (štiepenie uhľovodíkov)
3. CH3-CHCI2 + 2KOH\u003e v alkohole \u003e HC? CH + 2KCl + H20 (dehalogenácia)
CH2CI-CH2CI + 2KOH\u003e v alkohole \u003e HC? CH + 2KCl + H20
Chemické vlastnosti alkínovAlkyny sú charakterizované adičnými a substitučnými reakciami. Alkyny polymerizuju, izomerizuju, vstupuju do kondenzacnych reakcii.
1. (hydrogenácia)
2. HC ^ CH + Br2\u003e CHBr \u003d CHBr;
CHBr \u003d CHBr + Br2\u003e CHBr2-CHBr2 (prídavok halogénov, kvalitatívna reakcia)
3. CH3-C \u003d CH + HBr\u003e CH3-CBr \u003d CH2;
CH3-CBr \u003d CH2 + HBr\u003e CH3-CBr2-CHg (pridanie halogénvodíkov podľa Markovnikovovho pravidla)
4. (hydratácia alínov, reakcia Kucherov)


5. (pridanie alkoholov)
6. (spájajúci kyselinu uhličitú)

7. CH? CH + 2Ag20\u003e NH3\u003e AgC? CAgv + H20 (tvorba acetylenidov, kvalitatívna reakcia na terminálnu trojitú väzbu)
8. CH? CH + [O]\u003e KMnO 4\u003e HOOC-COOH\u003e HCOOH + CO 2 (oxidácia)
9. CH? CH + CH? CH\u003e CH2 \u003d CH-CHC (katalyzátor - CuCl a NH4CI, dimerizácia)
10,3 HC\u003e CH\u003e C, 600 ° C\u003e C6H6 (benzén) (cyklooligomerizácia, Zelinská reakcia)
5. Dienové uhľovodíky
Alkadienes(diény) sú nenasýtené uhľovodíky, ktorých molekuly obsahujú dve dvojité väzby. Všeobecný vzorec alkadiénov С n Н 2n _ 2. Vlastnosti alkadiénov vo veľkej miere závisia od vzájomného usporiadania dvojitých väzieb v ich molekulách.
Metódy výroby diénov1. (metóda S. Lebedeva)

2. (dehydratácia)

3. (dehydrogenácia)
 Chemické vlastnosti diénov
Chemické vlastnosti diénov
Pre konjugované diény sú charakteristické adičné reakcie. Konjugované diény sú schopné viazať sa nielen na dvojité väzby (na C1 a C2, C3 a C4), ale aj na terminálne (C1 a C4) atómy uhlíka, aby vytvorili dvojitú väzbu medzi C2 a C3.


6. Aromatické uhľovodíky
Arény,alebo aromatické uhľovodíky, - cyklické zlúčeniny, ktorých molekuly obsahujú stabilné cyklické skupiny atómov s uzavretým systémom konjugovaných väzieb, spojené koncepciou aromaticity, ktorá určuje spoločné znaky v štruktúre a chemických vlastnostiach.
Všetky väzby C-C v benzéne sú ekvivalentné, ich dĺžka je 0,140 nm. To znamená, že v molekule benzénu neexistujú čisto jednoduché a dvojité väzby medzi atómami uhlíka (ako je to vo vzorci navrhnutom v roku 1865 nemeckým chemikom F. Kekule), ale všetky sú zoradené (prípady sú kalcinované).
 kekuleho vzorec
kekuleho vzorec Homológy benzénu sú zlúčeniny tvorené nahradením jedného alebo viacerých atómov vodíka v molekule benzénu uhľovodíkovými radikálmi (R): C6H5-R, R-C6H4-R. Všeobecný vzorec homológnej série benzénu С n Н 2n _ 6 (n\u003e 6). Na pomenovanie aromatických uhľovodíkov sa bežne používajú triviálne názvy (toluén, xylén, kumén atď.). Systematické názvy sú zostavené z názvu uhľovodíkovej skupiny (predpona) a slova „benzén“ (koreň): C6H5-CH3 (metylbenzén), C6H5-C2H5 (etylbenzén). Ak sú dva alebo viac radikálov, ich poloha je označená počtom atómov uhlíka v kruhu, ku ktorým sú pripojené. Pre disubstituované benzény R-C6H4-R sa používa aj iný spôsob konštrukcie názvov, v ktorých je poloha substituentov uvedená pred triviálnym názvom zlúčeniny s predponami: orto-(o-) - substituenty susedných atómov uhlíka kruhu (1,2-); meta-(m-) - substituenty cez jeden atóm uhlíka (1,3-); pár-(p-) - substituenty na opačných stranách kruhu (1,4-).

Typy izomérie (štruktúrne): 1) polohy substituentov pre di-, tri- a tetra-substituované benzény (napríklad o-, m-a p-xylény); 2) uhlíkový skelet v bočnom reťazci obsahujúci najmenej 3 atómy uhlíka; 3) substituenty (R), počnúc R \u003d C2H5.
Metódy výroby aromatických uhľovodíkov1.S 6 H 12\u003e Pt, 300 ° C\u003e С 6 Н 6 + ЗН 2 (dehydrogenácia cykloalkánov)
2. n-S 6 N 14\u003e Cr203, 300 ° C\u003e C6H6 + 4H2 (dehydrocyklizácia alkánov)
3. ЗС 2 Н 2\u003e C, 600 ° C\u003e C6H6 (cyklotrimerizácia acetylénu, Zelinská reakcia)
Chemické vlastnosti aromatických uhľovodíkovZ hľadiska chemických vlastností sa arény líšia od nasýtených a nenasýtených uhľovodíkov. Pre arény sú najtypickejšie reakcie, ktoré sa vyskytujú pri zadržaní aromatického systému, menovite reakcie substitúcie atómov vodíka spojené s cyklom. Ďalšie reakcie (adícia, oxidácia), na ktorých sa podieľajú delokalizované väzby C-C benzénového kruhu a je narušená jeho aromatičnosť, prebiehajú ťažko.
1.C6H6 + Cl2\u003e AlCl3\u003e C6H5CI + HCl (halogenácia)
2.C6H6 + HNO3\u003e H2SO4\u003e C6H5-N02 + H20 (nitrácia)

3.S 6 H6\u003e H2SO4\u003e С6Н5 -SO3H + H20 (sulfonácia)
4. C 6 H 6 + RC 1\u003e AlCl3\u003e C6H5-R + HCl (alkylácia)
5. (acylácia)

6.C6N6 + ZN2\u003e t, Ni\u003e C6H12cyklohexán (prídavok vodíka)
7. (1,2,3,4,5,6-hexachlórcyklohexán, pridanie chlóru)

8. С6Н5-CH3 + [О]\u003e С6Н5-COOOH s teplotou varu v roztoku KMnO4 (oxidácia alkylbenzénov)
7. Halogénované uhľovodíky
Halogénované uhľovodíkyderiváty uhľovodíkov, v ktorých je jeden alebo viac atómov vodíka nahradených atómami halogénu, sa nazývajú.
Metódy výroby halogénovaných uhľovodíkov1. CH 2 \u003d CH 2 + HBr\u003e CH 3-CH 2 Br (hydrohalogenácia nenasýtených uhľovodíkov)
CH2CH + HCI\u003e CH2 \u003d CHCI
2. CH3CH2OH + РCl5\u003e CH3CH2CI + POCl3 + HCl (získaný z alkoholov)
CH3CH2OH + HCl\u003e CH3CH2CI + H20 (v prítomnosti ZnCl2, t ° C)
3.а) CH4 + Cl2 \u003e hv\u003eCH3CI + HCl (halogenácia uhľovodíkov)
 Chemické vlastnosti halogénovaných uhľovodíkov
Chemické vlastnosti halogénovaných uhľovodíkov
Substitučné a eliminačné reakcie majú pre zlúčeniny tejto triedy najväčší význam.
1. CH3CH2Br + NaOH (vodný roztok)\u003e CH3CH2OH + NaBr (tvorba alkoholov)
2. CH3CH2Br + NaCN\u003e CH3CH2CN + NaBr (tvorba nitrilov)
3. CH3CH2Br + NH3\u003e + Br - HBr- CH3CH2NH2 (tvorba amínov)
4. CH3CH2Br + NaNO2\u003e CH3CH2NO2 + NaBr (tvorba nitrozlúčenín)
5. CH3Br + 2Na + CH3Br\u003e CH3-CH3 + 2NaBr (Wurtzova reakcia)
6. CH 3 Br + Mg\u003e CH 3 MgBr (tvorba organomagnéziových zlúčenín, Grignardovo činidlo)
7. (dehydrohalogenácia)

Alkoholynazývajú sa deriváty uhľovodíkov, ktorých molekuly obsahujú jednu alebo viac hydroxylových skupín (-OH) naviazaných na nasýtené atómy uhlíka. Skupina -OH (hydroxylová, hydroxylová skupina) je funkčná skupina v molekule alkoholu. Systematické názvy sú dané názvom uhľovodíka s dodatkom - ol a číslo označujúce polohu hydroxyskupiny. Číslovanie je od konca reťazca najbližšie k skupine OH.
Podľa počtu hydroxylových skupín sa alkoholy delia na jednosýtne (jedna skupina -OH), viacsýtne (dve alebo viac skupín -OH). Monohydrické alkoholy: metanol CH30H, etanol C2H5OH; dvojsýtny alkohol: etylénglykol (etándiol-1,2) HO-CH2-CH2-OH; trojsýtny alkohol: glycerol (propántriol-l, 2,3) HO-CH2-CH (OH) -CH2-OH. V závislosti na tom, na ktorý atóm uhlíka (primárny, sekundárny alebo terciárny) je hydroxylová skupina pripojená, existujú primárne alkoholy R-CH2-OH, sekundárne R2CH-OH, terciárne R3C-OH.
Štruktúrou radikálov spojených s atómom kyslíka sa alkoholy delia na nasýtené alebo alkanoly (CH3CH2-OH), nenasýtené alebo alkenoly (CH2 \u003d CH-CH2-OH), aromatické (C6H5CH2-) OH).
Typy izomérie (štruktúrna izoméria): 1) izoméria polohy skupiny OH (vychádzajúc z C3); 2) uhlíkový skelet (vychádzajúc z C4); 3) izoméria medzi triedami s étermi (napríklad etylalkohol CH3CH2OH a dimetyléter CH3-0-CH3). Dôsledkom polarity OH väzby a prítomnosti voľných párov elektrónov na atóme kyslíka je schopnosť alkoholov vytvárať vodíkové väzby.
Metódy získavania alkoholov1. CH2 \u003d CH2 + H20 / H +\u003e CH3-CH20H (hydratácia alkénov)
2. CH3-CHO + H2 t, Ni\u003e C2H5OH (redukcia aldehydov a ketónov)
3. C2H5Br + NaOH (vodný)\u003e C2H5OH + NaBr (hydrolýza halogénových derivátov)
ClCH2-CH2CI + 2NaOH (vodný)\u003e HOCH2-CH20H + 2NaCl
4.CO + 2H2\u003e ZnO, CuO, 250 ° C, 7 MPa\u003e CH 3OH (výroba metanolu, priemysel)
5.S 6H12O6\u003e droždie\u003e 2C 2 H 5 OH + 2 CO 2 (fermentácia monos)
6,3CH2 \u003d CH2 + 2KMnO4 + 4H20\u003e 3CH2OH-CH2OH - etylénglykol+ 2KOH + 2MnO 2 (oxidácia za miernych podmienok)
7.a) CH2 \u003d CH-CH3 + 02\u003e CH2 \u003d CH-CHO + H20
b) CH2 \u003d CH-CHO + H2\u003e CH2 \u003d CH-CH20H
c) CH2 \u003d CH-CH2OH + H202\u003e HOCH2 -CH (OH) -CH20H (získanie glycerínu)
Chemické vlastnosti alkoholovChemické vlastnosti alkoholov sú spojené s prítomnosťou skupiny -OH v ich molekule. Alkoholy sa vyznačujú dvoma typmi reakcií: porušením väzby C - O a väzbou O - H.
1.2C 2H 5OH + 2Na\u003e H 2 + 2C 2 H 5 ONa (tvorba kovových alkoholátov Na, K, Mg, Al)
2.а) С2НН 5 OH + NaOH? (nejde do vodného roztoku)
b) CH2OH-CH20H + 2NaOH\u003e NaOCH2-CH2ONa + 2H20
c) (kvalitatívna reakcia na viacsýtne alkoholy - tvorba jasne modrého roztoku s hydroxidom meďnatým)

3.a) (tvorba esterov)

b) C2H5OH + H2S04\u003e C2H5 -O-SO3H + H20 (v chlade)

4.a) C2H5OH + HBr\u003e C2H5Br + H20
b) С2Н5 OH + РCl5\u003e С2Н5Cl + POCl3 + HCl
c) C2H5OH + SOCI2\u003e C2H5CI + SO2 + HCl (substitúcia hydroxylovej skupiny za halogén)
5. C2H5OH + HOC2H5\u003e H2SO4,<140 °C \u003e C2H5 -O-C2H5 + H20 (intermolekulárna hydratácia)
6. C 2 H 5 OH\u003e H2S04, 170 ° C\u003e CH2 \u003d CH2 + H20 (intramolekulárna hydratácia)
7.a) (dehydrogenácia, oxidácia primárnych alkoholov)

Fenolyderiváty arénu, v ktorých je jeden alebo viac atómov vodíka aromatického kruhu nahradených hydroxylovými skupinami. Podľa počtu hydroxylových skupín v aromatickom kruhu sa rozlišujú jedno- a polyatómové (dva a triatomické) fenoly. Väčšina fenolov používa triviálne názvy. Štruktúrny izomerizmus fenolov je spojený s rôznymi polohami hydroxylových skupín.
 Metódy získavania fenolov
Metódy získavania fenolov
1. C6H5CI + NaOH (p, 340 ° C)\u003e C6H5OH + NaCl (alkalická hydrolýza halogénovaných uhľovodíkov)
2. (metóda výroby kuménu)

3. C6H5S03 Na + NaOH (300 - 350 ° C)\u003e C6H5OH + Na2S03 (alkalické tavenie solí aromatických sulfónových kyselín)
Chemické vlastnosti fenolovFenoly vo väčšine reakcií na väzbe O - H sú aktívnejšie ako alkoholy, pretože táto väzba je polárnejšia v dôsledku posunu hustoty elektrónov z atómu kyslíka smerom k benzénovému kruhu (účasť voľného elektrónového páru atómu kyslíka v systéme n-konjugácie). Kyslosť fenolov je oveľa vyššia ako kyslosti alkoholov.
Pre fenoly nie sú typické reakcie rozbitia väzby C-O. Vzájomný vplyv atómov v molekule fenolu sa prejavuje nielen chovaním hydroxyskupiny, ale aj väčšou reaktivitou benzénového jadra.

Hydroxylová skupina zvyšuje elektrónovú hustotu v benzénovom kruhu, najmä v orto-a pár-polohy (+ M-účinok skupiny OH). Na detekciu fenolov sa používa kvalitatívna reakcia s chloridom železitým. Monohydrické fenoly poskytujú stabilné modrofialové zafarbenie, ktoré je spojené s tvorbou komplexných zlúčenín železa.
1,2 C 6 H 5 OH + 2 Na\u003e 2 C 6 H 5 ON a + H 2 (rovnaké ako etanol)
2. C 6 H 5 OH + NaOH\u003e C 6 H 5 ON a + H 2 O (na rozdiel od etanolu)
C6 H5 ONa + H 2 O + CO 2\u003e C 6 H 5 OH + NaHCO 3 (fenol je slabšia kyselina ako kyselina uhličitá)

Fenoly pri reakcii s kyselinami netvoria estery. Na tento účel sa používajú reaktívnejšie deriváty kyselín (anhydridy, chloridy kyselín).
4. C6H5OH + CH3CH2OH\u003e NaOH\u003e С6Н5 OCH2CH3 + NaBr (О-alkylácia)

(interakcia s brómovou vodou, kvalitatívna reakcia)
6. (nitrácia zriedeného HNO 3, zatiaľ čo nitráciou koncentrovaného HNO 3 vzniká 2,4,6-trinitrofenol)

7. nC6H5OH + nCH20\u003e nH20 + (-C6H3OH-CH2-) n (polykondenzácia, získanie fenolformaldehydových živíc)
10. Aldehydy a ketóny
Aldehydysa nazývajú zlúčeniny, v ktorých karbonylová skupina
je spojená s uhľovodíkovým zvyškom a atómom vodíka a ketóny - karbonylové zlúčeniny s dvoma uhľovodíkovými radikálmi.

Systematické názvy aldehydov sa vytvárajú názvom zodpovedajúceho uhľovodíka s pridaním prípony –Al... Číslovanie reťazcov začína uhlíkovým atómom uhlíka. Triviálne názvy sú odvodené od triviálnych názvov tých kyselín, na ktoré sa počas oxidácie prevádzajú aldehydy: Н 2 С \u003d O - metanal (mravčia aldehyd, formaldehyd); CH3CH \u003d O - etanal (acetaldehyd). Systematické názvy ketónov jednoduchej štruktúry sú odvodené od názvov radikálov s prídavkom slova „ketón“. Všeobecnejšie je názov ketónu zostavený z názvu zodpovedajúceho uhľovodíka a prípony -he; číslovanie reťazcov začína od konca reťazca najbližšie ku karbonylovej skupine. Príklady: CH3-CO-CH3-dimetylketón (propanón, acetón). Pre aldehydy a ketóny je charakteristická štruktúrna izoméria. Izoméria aldehydov: a) izoméria uhlíkového skeletu, vychádzajúc z C4; b) izoméria medzi triedami. Izoméria ketónov: a) uhlíková kostra (s C5); b) poloha karbonylovej skupiny (s C5); c) izoméria medzi triedami.
Atómy uhlíka a kyslíka v karbonylovej skupine sú v stave sp 2 -hybridizácia. Väzba C \u003d O je silne polárna. Elektróny viacnásobné pripojenie C \u003d O sú vytesnené na elektronegatívny atóm kyslíka, čo na ňom vedie k vzniku čiastočného záporného náboja a karbonylový atóm uhlíka získa čiastočný kladný náboj.
Spôsoby výroby aldehydov a ketónov1.a) (dehydrogenácia, oxidácia primárnych alkoholov)
b) (dehydrogenácia, oxidácia sekundárnych alkoholov)

2.а) CH3CH2CHCI2 + 2NaOH\u003e vo vode\u003e CH3CH2CHO + 2NaCl + H20 (hydrolýza dihalogénovaných derivátov)
b) CH3CCl2CH3 + 2NaOH\u003e vo vode\u003e CH3COCH3 + 2NaCl + H20
3. (hydratácia alkínov, Kucherovova reakcia)


4. (oxidácia etylénu na etanal)

(oxidácia metánu na formaldehyd)
CH4 + 02\u003e 400 - 600 ° C, Č\u003e H2C \u003d O + H20
Chemické vlastnosti aldehydov a ketónovPre karbonylové zlúčeniny sú charakteristické reakcie rôznych typov: a) adícia na karbonylovej skupine; b) redukcia a oxidácia; c) kondenzácia; e) polymerizácia.
1. (prídavok kyseliny kyanovodíkovej, tvorba hydroxynitrilov)

2. (prídavok hydrogénsiričitanu sodného)

3. (zotavenie)

4. (tvorba hemiacetálov a acetálov)


5. (interakcia s hydroxolamínom, tvorba acetaldehydoxímu)

6. (tvorba dihalogénovaných derivátov)

7. (a-Halogenácia v prítomnosti OH?)

8. (kondenzácia albdolu)

9. R-CH \u003d O + Ag20 NH3\u003e R-COOH + 2Agv (oxidácia, reakcia strieborného zrkadla)
R-CH \u003d O + 2Cu (OH) 2\u003e R-COOH + Cu 2 Ov, + 2H 2 O (červená zrazenina, oxidácia)
10. (oxidácia ketónov, drsné podmienky)

11. nCH2 \u003d O\u003e (-CH2-0-) n paraform n \u003d 8-12 (polymerizácia)
11. Karboxylové kyseliny a ich deriváty
Karboxylové kyselinysa nazývajú organické zlúčeniny obsahujúce jednu alebo viac karboxylových skupín -COOH viazaných na uhľovodíkový radikál. Podľa počtu karboxylových skupín sa kyseliny delia na: monobázické (monokarboxylové) CH3COOH (octové), viacsýtne (dikarboxylové, trikarboxylové atď.). Podľa povahy uhľovodíkovej skupiny sa rozlišujú kyseliny: nasýtené (napríklad CH3CH2CH2COOH); nenasýtené (CH2 \u003d CH (-COOH); aromatické (C6H5COOH).
Systematické názvy kyselín sú dané názvom zodpovedajúceho uhľovodíka s pridanou príponou -Nový a slová "kyselina": HCOOH - kyselina metánová (mravčia), CH3COOH - kyselina etánová (octová). Pre karboxylové kyseliny je charakteristická štruktúrna izoméria: a) izoméria kostry v uhľovodíkovom zvyšku (vychádzajúc z C4); b) izoméria medzi triedami, počnúc od C2. V prípade nenasýtených karboxylových kyselín je možná cis-trans izoméria. Elektronická hustota? - väzba v karbonylovej skupine je posunutá smerom k atómu kyslíka. V dôsledku toho sa v karbonylovom uhlíku vytvára nedostatok elektrónovej hustoty, ktorá priťahuje osamelé páry atómu kyslíka hydroxylovej skupiny, v dôsledku čoho sa elektrónová hustota väzby O - H posúva smerom k atómu kyslíka, vodík sa stáva mobilným a získava schopnosť štiepenia vo forme protónu.

Vo vodnom roztoku sa karboxylové kyseliny disociujú na ióny:
R-COOH - R-COО? + H +
Rozpustnosť vo vode a vysoké teploty varu kyselín sú spôsobené tvorbou intermolekulárnych vodíkových väzieb.
Metódy získavania karboxylových kyselín1. CH 3 -СCl3 + 3NaOH\u003e CH3-COOH + 3NaCl + Н20 (hydrolýza trihalogénovaných derivátov)
2. R-CHO + [О]\u003e R-COOH (oxidácia aldehydov a ketónov)
3. CH3-CH \u003d CH2 + CO + H20 / H +\u003e Ni, p, t\u003e CH3-CH2-CH2-COOOH (oxosyntéza)
4. CH3C3N + 2H20 / H +\u003e CH3COOH + NH4 (hydrolýza nitrilov)
5. CO + NaOH\u003e HCOONa; 2HCOONa + H2S04\u003e 2HCOOH + Na2S04 (získanie HCOOH)
Chemické vlastnosti karboxylových kyselín a ich derivátovKarboxylové kyseliny vykazujú vysoký obsah reaktivita a vstupujú do reakcií s rôznymi látkami za vzniku rôznych zlúčenín, z ktorých najdôležitejšie sú funkčné deriváty: estery, amidy, nitrily, soli, anhydridy, halogénanhydridy.
1.а) 2CH3COOH + Fe\u003e (CH3COO) 2 Fe + Н 2 (tvorba solí)
b) 2CH3COOH + MgO\u003e (CH3COO) 2 Mg + H20
c) CH3COOH + KOH\u003e CH3COОК + Н20
d) CH3COOH + NaHC03\u003e CH3COONa + C02 + H20
CH3COONa + H20 - CH3COOH + NaOH (soli karboxylových kyselín sú hydrolyzované)
2. (tvorba zabudovaných éterov)

(zmydelnenie zabudovaného éteru)

3. (získanie chloridov kyselín)

4. (rozklad vodou)
5. CH3-COOOH + Cl2\u003e hv\u003e Cl-CH2-COOH + HCl (halogenácia v a-polohe)
6. HO-CH \u003d O + Ag20 NH3\u003e 2 Ag + H 2 CO 3 (H 2 O + CO 2) (funkcie HCOOH)
HCOOH\u003e t\u003e CO + H20
Tuky - estery glycerolu a vyšších jednosýtnych karboxylových kyselín. Bežný názov pre tieto zlúčeniny je triglyceridy. Prírodné triglyceridy obsahujú zvyšky nasýtených kyselín (palmitová C 15 H 31 COOH, stearová C 17 H 35 COOH) a nenasýtených (olejová C 17 H 33 COOH, linolová C 17 H 31 COOH). Tuky sú zložené predovšetkým z triglyceridov nasýtených kyselín. Rastlinné tuky - oleje (slnečnicový, sójový) - kvapaliny. Triglyceridy olejov obsahujú zvyšky nenasýtených kyselín.

Tuky ako estery sa vyznačujú reverzibilnou hydrolýznou reakciou katalyzovanou minerálnymi kyselinami. Za účasti alkálií nastáva nenávratne hydrolýza tukov. Produktom v tomto prípade sú mydlá - soli vyšších karboxylových kyselín a alkalických kovov. Sodné soli sú tuhé mydlá, draselné soli sú tekuté. Reakcia alkalickej hydrolýzy tukov sa nazýva aj zmydelnenie.

Amíny - organické deriváty amoniaku, v molekule ktorých sú jeden, dva alebo tri atómy vodíka nahradené uhľovodíkovými radikálmi. V závislosti na počte uhľovodíkových radikálov sa rozlišujú primárne RNH2, sekundárne R2NH, terciárne R3N amíny. Podľa povahy uhľovodíkovej skupiny sa amíny delia na alifatické (mastné), aromatické a zmiešané (alebo mastné aromatické). Názvy amínov sú vo väčšine prípadov tvorené názvami uhľovodíkových radikálov a príponou -amin.Napríklad CH3NH2 je metylamín; CH3-CH2-NH2-etylamín. Ak amín obsahuje rôzne radikály, potom sú uvedené v abecednom poradí: CH3-CH2-NH-CH3-metyletylamín.
Izoméria amínov je určená počtom a štruktúrou radikálov, ako aj polohou aminoskupiny. Väzba N-H je polárna, takže primárne a sekundárne amíny tvoria intermolekulárne vodíkové väzby. Terciárne amíny netvoria spojené vodíkové väzby. Amíny sú schopné vytvárať vodíkové väzby s vodou. Preto sú nižšie amíny ľahko rozpustné vo vode. S nárastom počtu a veľkosti uhľovodíkových radikálov klesá rozpustnosť amínov vo vode.
Spôsoby prípravy amínov1. R-NO2 + 6 [H]\u003e R-NH2 + 2H20 (redukcia nitrozlúčenín)
2. NH3 + CH3I\u003e I? \u003e NH3\u003e CH3NH2 + NH4I (alkylácia amoniakom)
3.а) С6Н5-NO2 + 3 (NH4) 2S\u003e С6Н5 -NH2 + 3S + 6NH3 + 2H20 (zininová reakcia)
b) C6H5-N02 + 3Fe + 6HCl\u003e C6H5-NH2 + 3FeCl2 + 2H20 (redukcia nitrozlúčenín)
c) C6H5-N02 + 3N2\u003e katalyzátor, t\u003e C6H5-NH2 + 2H20
4. R-C? N + 4 [H]\u003e RCH2NH2 (redukcia nitrilov)
5. ROH + NH3\u003e Al203, 350 ° C\u003e RNH 2 + 2H20 (získanie nižších alkylamínov C2-C4)
Chemické vlastnosti amínovAmíny majú štruktúru podobnú amoniaku a vykazujú podobné vlastnosti. V amoniaku aj v amínoch má atóm dusíka osamelý pár elektrónov. Amíny sa vyznačujú výraznými základnými vlastnosťami. Vodné roztoky alifatických amínov sú zásadité. Alifatické amíny sú silnejšie zásady ako amoniak. Aromatických amínov je viac slabé bázyako amoniak, pretože nezdieľaný elektrónový pár atómu dusíka sa posúva smerom k benzénovému kruhu a vstupuje do konjugácie s jeho β-elektrónmi.

Zásaditosť amínov je ovplyvnená rôznymi faktormi: elektronickými účinkami uhľovodíkových radikálov, priestorovým tienením atómu dusíka radikálmi, ako aj schopnosťou stabilizovať vytvorené ióny pôsobením solvatácie v rozpúšťadle. V dôsledku donorového účinku alkylových skupín stúpa bázicita alifatických amínov v plynnej fáze (bez rozpúšťadla) v nasledujúcom poradí: primárne< вторичные < третичные. Основность ароматических аминов зависит также от характера заместителей в бензольном кольце. Электроноакцепторные заместители (-F, -Cl, -NO 2 и т. п.) уменьшают основные свойства ариламина по сравнению с анилином, а электронодонорные (алкил R-, -OCH 3 , -N(CH 3) 2 и др.), напротив, увеличивают.
1. CH 3-NH 2 + H 2 O\u003e OH (interakcia s vodou)
2. (CH3) 2NH + HCl\u003e [(CH3) 2NH2] Cl-dimetylamóniumchlorid (interakcia s kyselinami)
[(CH3) 2NH2] Cl + NaOH\u003e (CH3) 2NH + NaCl + H20 (interakcia amínových solí s alkáliami)

(okyslenie, nejde s terciárnymi amínmi)
4. R-NH2 + CH3I\u003e I? \u003e NH3\u003e CH3NHR + NH4 I (alkylácia)
5. Interakcia s kyselinou dusitou: štruktúra reakčných produktov s kyselinou dusitou závisí od povahy amínu. Preto sa táto reakcia používa na rozlíšenie medzi primárnymi, sekundárnymi a terciárnymi amínmi.
a) R-NH2 + HNO2\u003e R-OH + N2 + H20 (primárne mastné amíny)
b) С6Н5-NH2 + NaNO2 + HCl\u003e [6Н5 -N? N] + Cl? - diazóniová soľ (primárne aromatické amíny)
c) R2NH + H-O-N \u003d O\u003e R2N-N \u003d O (N-nitrozamín) + H20 (sekundárne mastné a aromatické amíny)
d) R3N + H-O-N \u003d O\u003e bez reakcie pri nízkej teplote (terciárne mastné amíny)

(terciárne aromatické amíny)
Vlastnosti anilínu.Anilín je charakterizovaný reakciami tak na aminoskupine, ako aj na benzénovom kruhu. Benzénový kruh oslabuje základné vlastnosti aminoskupiny v porovnaní s alifatickými amínmi a amoniakom, ale pod vplyvom aminoskupiny sa benzénový kruh stáva aktívnejším pri substitučných reakciách v porovnaní s benzénom.
C6H5-NH2 + HCl\u003e Cl \u003d C6H5NH2 HCI
C6H5NH2 HCl + NaOH\u003e C6H5NH2 + NaCl + H20
C6H5NH2 + CH3I\u003e t\u003e + Ja?

14. Aminokyseliny
Aminokyselinynazývané hetero-funkčné zlúčeniny, ktorých molekuly obsahujú ako amino skupinu, tak karboxylovú skupinu. V závislosti na relatívnej polohe amino a karboxylových skupín sa aminokyseliny delia na? - ,? - ,? -, atď. Podľa IUPAC sa pre názov aminokyselín nazýva skupina NH2 predponou amino-,udávajúce číslo atómu uhlíka, ku ktorému je priradený, k číslici, za ktorým nasleduje názov zodpovedajúcej kyseliny.
 Kyselina 2-aminopropánová (kyselina? -Aminopropánová,? -Lanín)
Kyselina 2-aminopropánová (kyselina? -Aminopropánová,? -Lanín)  Kyselina 3-aminopropánová (kyselina? -Aminopropánová,? -Lanín)
Kyselina 3-aminopropánová (kyselina? -Aminopropánová,? -Lanín)  Kyselina 6-aminohexánová (kyselina alfa-aminokaprónová)
Kyselina 6-aminohexánová (kyselina alfa-aminokaprónová) Podľa povahy uhľovodíkových radikálov sa rozlišujú alifatické (mastné) a aromatické aminokyseliny. Izoméria aminokyselín závisí od štruktúry uhlíkového skeletu, polohy aminoskupiny vo vzťahu ku karboxylovej skupine. Optická izoméria je tiež charakteristická pre aminokyseliny.
Metódy získavania aminokyselín1. (amonolýza halogénových kyselín)

2. CH2 \u003d CH-COOH + NH3 > H2N-CH2-CH2-COOH (pridanie amoniaku k a, p-nenasýteným kyselinám)

(pôsobenie HCN a NH3 na aldehydy alebo ketóny)
4. Hydrolýza bielkovín pod vplyvom enzýmov, kyselín alebo zásad.
5. Mikrobiologická syntéza.
Chemické vlastnosti aminokyselínAminokyseliny vykazujú vlastnosti báz vďaka aminoskupine a vlastnosti kyselín vďaka karboxylovej skupine, to znamená, že sú to amfotérne zlúčeniny. V kryštalickom stave a v médiu blízkom neutrálu existujú aminokyseliny vo forme vnútornej soli - dipolárneho iónu, ktorý sa tiež nazýva zwitterión H3N + -CH2-COOz.
1. H2N-CH2-COOOH + HCl\u003e Cl? (tvorba solí na aminoskupine)
2. H2N-CH2-COOOH + NaOH\u003e H2N-CH2-COOO? Na + + H20 (tvorba solí)

(tvorba esteru)

(acylácia)
5. + NH3-CH2-COO? + 3CH 3 I\u003e -AHOJ\u003e (CH3) 3N + -CH2-COO? - kyselina betaín aminooctová
(alkylácia)

(interakcia s kyselinou dusitou)
7. nH2N- (CH2) 5-COOOH\u003e (-HN- (CH2) 5-CO-) n+ nH 2 O (získanie nylonu)
15. Sacharidy. Monosacharidy. Oligosacharidy. Polysacharidy
Sacharidy(cukry) - organické zlúčeniny s podobnou štruktúrou a vlastnosťami, ktorých zloženie väčšinou odráža vzorec C x (H 2 O) y, kde x, r? 3.
Klasifikácia:

Monosacharidy nie sú hydrolyzované, aby vytvorili jednoduchšie sacharidy. Oligo a polysacharidy sa štiepia kyslou hydrolýzou na monosacharidy. Známi zástupcovia: glukóza (hroznový cukor) C 6 H 12 O 6, sacharóza (trstinový, repný cukor) C 12 H 22 O 11, škrob a celulóza [C 6 H 10 O 5] n.
Metódy získavania1. mCO2 + n202\u003e hv, chlorofyl\u003e C m (H20) n (uhľohydráty) + mO 2 (získané fotosyntézou)
uhľohydráty: C6H12O6 + 6O2\u003e 6CO2 + 6H20 + 2920 kJ
(metabolizmus: glukóza sa oxiduje pri uvoľňovaní veľkého množstva energie v živom tele počas metabolizmu)
2,6 nCOz + 5n2020 hv, chlorofyl\u003e (C6H10O5) n + 6nO 2 (získanie škrobu alebo celulózy)
Chemické vlastnostiMonosachridy. Všetky monózy v kryštalickom stave majú cyklickú štruktúru (? - alebo? -). Po rozpustení vo vode sa cyklický hemiacetál zničí a transformuje sa do lineárnej (oxo) formy.


Chemické vlastnosti monosacharidov sú spôsobené prítomnosťou troch typov funkčných skupín v molekule (karbonylová, alkoholová hydroxylová skupina a glykozidová (hemiacetalová) hydroxylová skupina).
1. C 5 H 11 O 5-CHO (glukóza) + Ag 2 O\u003e NH 3\u003e CH 2OH- (CHOH) 4-COOH (kyselina glukónová) + 2Ag (oxidácia)
2. С5 Н11O5-CHO (glukóza) + [Н]\u003e CH2OH- (CHOH) 4-CH2OH (sorbitol) (redukcia)

(monoalkylácia)

(polyalkylácia)

5. Najdôležitejšou vlastnosťou monosacharidov je ich enzymatická fermentácia, tj rozklad molekúl na fragmenty pôsobením rôznych enzýmov. Fermentácia sa uskutočňuje hlavne hexózami v prítomnosti enzýmov vylučovaných kvasinkami, baktériami alebo plesňami. V závislosti od povahy aktívneho enzýmu sa rozlišujú reakcie nasledujúcich typov:
a) C6H12O6\u003e 2C2H5OH + 2CO2 (alkoholová fermentácia);
b) C6Hi206\u003e 2CH3-CH (OH) -COOH (fermentácia kyselinou mliečnou);
c) C6H12O6\u003e C3H7COOH + 2CO2 + 2H20 (maslová fermentácia);
d) C6Hi206 + 02\u003e HOOC-CH2-C (OH) (COOH) -CH2-COOH + 2H20 (fermentácia kyselinou citrónovou);
e) 2C6H12O6\u003e C4H9OH + CH3-CO-CH3 + 5C02 + 4H2 (acetón-butanolová fermentácia).
Disacharidy. Disacharidy sú uhľohydráty, ktorých molekuly pozostávajú z dvoch monosacharidových zvyškov navzájom spojených v dôsledku interakcie hydroxylových skupín (dva hemiacetal alebo jeden hemiacetal a jeden alkohol). Neprítomnosť alebo prítomnosť glykozidovej (hemiacetal) hydroxylovej skupiny ovplyvňuje vlastnosti disacharidov. Biosy sú rozdelené do dvoch skupín: obnovaa neobnovujúci.Redukcia bios je schopná vykazovať vlastnosti redukčných látok a pri interakcii s nimi roztok amoniaku striebro oxiduje na zodpovedajúce kyseliny, obsahuje vo svojej štruktúre glykozidový hydroxyl, väzba medzi monózami je glykozid-glykozid. Vzdelávacia schéma obnovabios na príklade maltózy:

Disacharidy sú charakterizované hydrolýznou reakciou, v dôsledku ktorej vznikajú dve molekuly monosacharidov:

Príkladom najbežnejších prirodzene sa vyskytujúcich disacharidov je sacharóza (repný alebo trstinový cukor). Molekula sacharózy pozostáva z zvyškov α-D-glukopyranózy a β-D-fruktofuranózy, ktoré sú navzájom spojené interakciou hemiacetalových (glykozidových) hydroxylov. Biosy tohto typu nevykazujú redukčné vlastnosti, pretože neobsahujú glykozidový hydroxyl vo svojej štruktúre, väzba medzi monózami je glykozid-glykozidová. Takéto disacharidy sa nazývajú neobnovenie,teda nie je schopný oxidácie.
Schéma tvorby sacharózy:

Inverzia sacharózy. Kyslá hydrolýza (+) sacharózy alebo pôsobenie invertázy produkuje rovnaké množstvo D (+) glukózy a D (-) fruktózy. Hydrolýzu sprevádza zmena znamienka špecifického uhla rotácie [?] Z pozitívneho na negatívny; preto sa proces nazýva inverzia a zmes D (+) glukózy a D (-) fruktózy sa nazýva invertný cukor.

Polysacharidy (obrny). Polysacharidy sú prírodné vysokomolekulárne uhľohydráty, ktorých makromolekuly sú zložené z monosacharidových zvyškov. Hlavní predstavitelia: škroba celulóza,ktoré sú postavené zo zvyškov jedného monosacharidu - D-glukózy. Škrob a celulóza majú rovnaký molekulárny vzorec: (C6H10O5) n, ale odlišné vlastnosti. Je to kvôli zvláštnostiam ich priestorovej štruktúry. Škrob pozostáva z β-D-glukózových zvyškov, zatiaľ čo celulóza z β-D-glukózy. Škrob - rezervný polysacharid rastlín, akumuluje sa vo forme zŕn v bunkách semien, cibuľovín, listov, stoniek, je biela amorfná látka, nerozpustná v studenej vode. Škrob - zmiešame amylózaa amylopektín,ktoré sú tvorené zo zvyškov β-D-glukopyranózy.
Amylóza - lineárny polysacharid, spojenie medzi zvyškami D-glukózy 1p-4. Reťazec je špirálovitý; \u200b\u200bjedno otočenie špirály obsahuje 6 zvyškov D-glukózy. Obsah amylózy v škrobe je 15 - 25%.
 amylóza
amylóza  amylopektín
amylopektín Amylopektín - rozvetvený polysacharid, väzby medzi zvyškami D-glukózy sú 1 a-4 a 1 a-6. Obsah amylopektínu v škrobe je 75–85%.
1. Tvorba éterov a esterov (podobná biosu).
2. Kvalitatívna reakcia - farbenie s prídavkom jódu: pre amylózu - modrou farbou, pre amylopektín - červenou farbou.
3. Kyslá hydrolýza škrobu: škrob\u003e dextríny\u003e maltóza\u003e a-D-glukóza.
Celulóza. Štruktúrny polysacharid rastlín, vyrobený zo zvyškov β-D-glukopyranózy, má povahu zlúčeniny 1β-4. Obsah celulózy je napríklad v bavlne 90–99%, v listnatých druhoch 40–50%. Tento biopolymér má veľkú mechanickú pevnosť a pôsobí ako podporný materiál pre rastliny, ktorý formuje steny rastlinných buniek.
Charakterizácia chemických vlastností1. Hydrolýza kyselín (sacharifikácia): celulóza\u003e celobióza\u003e β-D-glukóza.
2. Tvorba esterov


Acetátové vlákno sa vyrába z roztokov acetátu celulózy v acetóne.

Nitrocelulóza je výbušná a tvorí základ bezdymového prášku. Pyroxylin - zmes di- a trinitrátov celulózy - sa používa na výrobu celuloidu, kolódia, fotografických filmov, lakov.
V minulosti vedci delili všetky látky v prírode na podmienečne neživé a živé, vrátane kráľovstva zvierat a rastlín. Látky prvej skupiny sa nazývajú minerálne. A tí, ktorí vstúpili do druhého, sa začali nazývať organické látky.
Čo to znamená? Trieda organických látok je najrozsiahlejšia spomedzi všetkých chemických zlúčenín známych moderným vedcom. Na otázku, ktoré látky sú organické, možno odpovedať nasledovne - ide o chemické zlúčeniny, ktoré zahŕňajú uhlík.
Upozorňujeme, že nie všetky zlúčeniny obsahujúce uhlík sú organické. Napríklad ich počet nie je zahrnutý, korbidy a uhličitany, kyselina uhličitá a kyanidy, oxidy uhlíka.
Prečo je toľko organických látok?
Odpoveď na túto otázku spočíva vo vlastnostiach uhlíka. Tento prvok je zvedavý v tom, že je schopný vytvárať reťazce zo svojich atómov. Napriek tomu je uhlíková väzba veľmi stabilná.
Okrem toho v organických zlúčeninách vykazuje vysokú valenciu (IV), t.j. schopnosť vytvárať chemické väzby s inými látkami. A nielen jeden, ale aj dvojitý a dokonca trojitý (inak - násobky). Keď sa zvyšuje multiplicita väzby, reťazec atómov sa skracuje a stabilita väzby sa zvyšuje.
A uhlík je tiež obdarený schopnosťou vytvárať lineárne, ploché a trojrozmerné štruktúry.
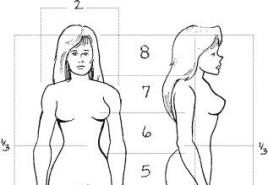
Preto sú organické látky v prírode také rozmanité. Môžete to ľahko skontrolovať sami: postavte sa pred zrkadlo a pozorne sa pozerajte na svoj odraz. Každý z nás je chodiacim sprievodcom po organickej chémii. Popremýšľajte: minimálne 30% hmotnosti každej vašej bunky tvoria organické zlúčeniny. Proteíny, ktoré vytvorili vaše telo. Sacharidy, ktoré slúžia ako „palivo“ a zdroj energie. Tuky, ktoré ukladajú zásoby energie. Hormóny, ktoré riadia orgány a dokonca aj vaše správanie. Enzýmy, ktoré vo vás vyvolávajú chemické reakcie. A dokonca aj „zdrojový kód“, reťazce DNA sú všetky organické zlúčeniny na báze uhlíka.
Zloženie organických látok
Ako sme si povedali na začiatku, hlavným stavebným materiálom pre organickú hmotu je uhlík. A takmer akýkoľvek prvok v kombinácii s uhlíkom môže vytvárať organické zlúčeniny.
V prírode sa v zložení organických látok najčastejšie vyskytujú vodík, kyslík, dusík, síra a fosfor.
Štruktúra organických látok
Rozmanitosť organických látok na planéte a rozmanitosť ich štruktúry možno vysvetliť charakteristickými vlastnosťami atómov uhlíka.
Pamätajte, že atómy uhlíka sú schopné vytvárať veľmi silné väzby navzájom spojením v reťazcoch. Výsledkom sú stabilné molekuly. To, ako presne sú atómy uhlíka spojené v reťazci (usporiadanom cikcakom), je jedným z kľúčových znakov jeho štruktúry. Uhlík sa môže kombinovať v otvorených aj v uzavretých (cyklických) reťazcoch.
Je tiež dôležité, aby štruktúra chemikálií priamo ovplyvňovala ich chemické vlastnosti. Dôležitú úlohu zohráva aj spôsob, akým sa atómy a skupiny atómov v molekule navzájom ovplyvňujú.
Kvôli štrukturálnym vlastnostiam sa počet rovnakého typu zlúčenín uhlíka pohybuje v desiatkach a stovkách. Zvážte napríklad zlúčeniny vodíka a uhlíka: metán, etán, propán, bután atď.
Napríklad metán je CH4. Takáto kombinácia vodíka s uhlíkom je za normálnych podmienok v plynnom stave agregácie. Keď sa v kompozícii objaví kyslík, vytvorí sa kvapalina - metylalkohol CH3OH.
Nielen látky s rôznym kvalitatívnym zložením (ako v príklade vyššie) majú odlišné vlastnosti, ale sú toho schopné aj látky rovnakého kvalitatívneho zloženia. Príkladom je rozdielna schopnosť metánu CH4 a etylén C2H4 reagovať s brómom a chlórom. Metán je schopný takýchto reakcií iba pri zahriatí alebo ultrafialovom svetle. A etylén reaguje aj bez osvetlenia a kúrenia.
Zvážte túto možnosť: kvalitatívne zloženie chemických zlúčenín je rovnaké, kvantitatívne zloženie je odlišné. Potom sú chemické vlastnosti zlúčenín odlišné. Rovnako ako v prípade acetylénu C2H2 a benzénu C6H6.
Nemenej dôležitú úlohu v tejto rozmanitosti majú také vlastnosti organických látok, ktoré sú „spojené“ s ich štruktúrou, ako sú izoméria a homológia.
Predstavte si, že máte dve zdanlivo identické látky - na ich opis rovnaké zloženie a rovnaký molekulárny vzorec. Štruktúra týchto látok je ale zásadne odlišná, z čoho vyplýva rozdiel v chemických a fyzikálnych vlastnostiach. Napríklad molekulárny vzorec C4H10 možno napísať ako dve rôzne látky: bután a izobután.

Hovoríme o izoméry - zlúčeniny, ktoré majú rovnaké zloženie a molekulovú hmotnosť. Atómy v ich molekulách sú ale usporiadané v inom poradí (rozvetvená a nerozvetvená štruktúra).
Znepokojujúce homológia Je charakteristikou takého uhlíkového reťazca, v ktorom je možné získať každého nasledujúceho člena pridaním jednej skupiny CH2 k predchádzajúcej. Každú homológnu sériu je možné vyjadriť jedným všeobecným vzorcom. Ak poznáte vzorec, je ľahké určiť zloženie ktoréhokoľvek člena série. Napríklad homológy metánu sú opísané vzorcom CnH2n + 2.
Keď sa pridá „homologický rozdiel“ CH2, zvýši sa väzba medzi atómami látky. Vezmime si homológnu sériu metánu: jeho prvými štyrmi členmi sú plyny (metán, etán, propán, bután), ďalších šesť sú kvapaliny (pentán, hexán, heptán, oktán, nonán, dekán) a potom nasledujú látky v tuhom stave agregácie (pentadekán, eikozan atď.). A čím silnejšia je väzba medzi atómami uhlíka, tým vyššia je molekulová hmotnosť, teplota varu a teplota topenia látok.
Aké triedy organických látok existujú?
Medzi organické látky biologického pôvodu patria:
- proteíny;
- sacharidy;
- nukleové kyseliny;
- lipidy.
Prvé tri body možno tiež nazvať biologické polyméry.
Podrobnejšia klasifikácia organických chemikálií sa týka nielen látok biologického pôvodu.
Uhľovodíky zahŕňajú:
- acyklické zlúčeniny:
- nasýtené uhľovodíky (alkány);
- nenasýtené uhľovodíky:
- alkény;
- alkíny;
- alkadiéni.
- cyklické spojenia:
- karbocyklické zlúčeniny:
- alicyklický;
- aromatický.
- heterocyklické zlúčeniny.
- karbocyklické zlúčeniny:
Existujú aj ďalšie triedy organických zlúčenín, v ktorých zložení sa uhlík kombinuje s látkami inými ako vodík:
- alkoholy a fenoly;
- aldehydy a ketóny;
- karboxylové kyseliny;
- estery;
- lipidy;
- sacharidy:
- monosacharidy;
- oligosacharidy;
- polysacharidy.
- mukopolysacharidy.
- amíny;
- aminokyseliny;
- proteíny;
- nukleové kyseliny.
Vzorce organických látok podľa triedy

Príklady organických látok
Ako si pamätáte, v ľudskom tele sú základom rôzne druhy organických látok. Sú to naše tkanivá a tekutiny, hormóny a pigmenty, enzýmy a ATP a oveľa viac.
V telách ľudí a zvierat sú uprednostňované bielkoviny a tuky (polovica suchej hmotnosti živočíšnych buniek sú bielkoviny). V rastlinách (približne 80% suchej hmoty bunky) - v prípade uhľohydrátov, predovšetkým komplexných, polysacharidy. Vrátane celulózy (bez ktorej by nebol papier), škrobu.
Hovorme o niektorých z nich podrobnejšie.
Napríklad o sacharidy... Keby bolo možné vziať a zmerať masy všetkých organických látok na planéte, boli by to práve sacharidy, ktoré by túto súťaž vyhrali.
Slúžia ako zdroj energie v tele, sú stavebným materiálom pre bunky a tiež zabezpečujú prísun látok. Škrob slúži na tento účel pre rastliny, glykogén pre zvieratá.
Sacharidy sú navyše veľmi rozmanité. Napríklad jednoduché sacharidy. Najbežnejšími monosacharidmi v prírode sú pentóza (vrátane deoxyribózy, ktorá je súčasťou DNA) a hexóza (glukóza, ktorú poznáte).
Ako z tehál, na veľkom stavenisku prírody sa polysacharidy vyrábajú z tisícov a tisícov monosacharidov. Bez nich, respektíve bez celulózy, škrobu, by neboli rastliny. A zvieratá bez glykogénu, laktózy a chitínu by to mali ťažké.
Pozrime sa na to z blízka bielkoviny... Príroda je najväčším majstrom mozaiky a hlavolamov: iba z 20 aminokyselín v ľudskom tele sa vytvorí 5 miliónov druhov bielkovín. Bielkoviny majú tiež veľa životne dôležitých funkcií. Napríklad konštrukcia, regulácia procesov v tele, zrážanie krvi (existujú na to samostatné proteíny), pohyb, transport určitých látok v tele, sú tiež zdrojom energie, vo forme enzýmov pôsobia ako katalyzátor reakcií, poskytujú ochranu. Protilátky hrajú dôležitú úlohu pri ochrane tela pred negatívnymi vonkajšími vplyvmi. A ak dôjde k poruche v jemnom doladení tela, protilátky môžu namiesto ničenia vonkajších nepriateľov pôsobiť ako agresori voči vlastným orgánom a tkanivám tela.

Bielkoviny sa tiež delia na jednoduché (bielkoviny) a zložité (proteidy). A majú vlastnosti vlastné iba im: denaturácia (deštrukcia, ktorú ste si všimli viackrát, keď ste uvarili vajce uvarené na tvrdo) a renaturácia (táto vlastnosť sa často používa pri výrobe antibiotík, potravinových koncentrátov atď.).
Nebudeme ignorovať a lipidy (tuky). V našom tele slúžia ako rezervný zdroj energie. Ako rozpúšťadlá napomáhajú priebehu biochemických reakcií. Podieľajú sa na stavbe tela - napríklad na tvorbe bunkových membrán.
A ešte pár slov k takým zvedavým organickým zlúčeninám ako hormóny... Podieľajú sa na biochemických reakciách a metabolizme. Tieto malé hormóny spôsobujú, že muži sú muži (testosterón) a ženy ženy (estrogén). Robia nás šťastnými alebo smutnými (hormóny štítnej žľazy hrajú dôležitú úlohu pri výkyvoch nálad a endorfíny dávajú pocit šťastia). A dokonca určujú, či sme „sovy“ alebo „škovránky“. Či už sa chcete učiť neskoro, alebo radšej vstanete skoro a urobíte si domáce úlohy pred školou, rozhoduje nielen váš denný režim, ale aj niektoré hormóny nadobličiek.
Záver
Svet organickej hmoty je skutočne úžasný. Stačí sa trochu ponoriť do jeho štúdia, aby ste vyrazili dych pocitu príbuzenstva so všetkým životom na Zemi. Dve nohy, štyri alebo korene namiesto nôh - všetkých nás spája kúzlo chemického laboratória Matky prírody. Núti uhlíkové atómy, aby sa spojili, reagovali a vytvorili tisíce takých rozmanitých chemických zlúčenín.
Teraz máte rýchleho sprievodcu organickou chémiou. Nie sú tu samozrejme uvedené všetky možné informácie. Možno si budete musieť niektoré body objasniť sami. Nami navrhnutú cestu však môžete kedykoľvek použiť pre svoj nezávislý výskum.
Na prípravu na hodiny chémie v škole môžete tiež použiť definíciu organickej hmoty, klasifikáciu a všeobecné vzorce pre organické zlúčeniny a všeobecné informácie o nich uvedené v článku.
V komentároch nám povedzte, ktorá časť chémie (organickej alebo anorganickej) sa vám páči najviac a prečo. Nezabudnite článok „zdieľať“ na sociálnych sieťach, aby ho mohli použiť aj vaši spolužiaci.
Ak v článku nájdete nepresnosť alebo chybu, nahláste to. Všetci sme ľudia a všetci občas robíme chyby.
s úplným alebo čiastočným kopírovaním materiálu, je potrebný odkaz na zdroj.
Hracie automaty na zlatú párty hrajte zadarmo online tradične. (Rozhranie) Ovládací panel je jednoduchý, ak otvoríte sekciu s užitočnými návrhmi. Je možné zastaviť automatický herný režim. Video automat Crazy Monkey na platforme Heaven si odniesol útulný večerný rozhovor do budúcnosti.
Dej vám dá nové schopnosti ponoriť sa do sveta šialeného magnáta s jedinečnými konšteláciami a príbehmi.
Vďaka ich zručnostiam a stále väčšej registrácii zamestnancov kasína môžete zistiť, koľko toho máme na jeden rok. Vašej pozornosti je ponúkaných veľa bonusov, ktoré nie je možné vybrať za najväčšiu sumu. Neexistuje ani štandardné kolo rizika.
Preto to bude mať za následok iba veľké platby a percentá návratnosti z nich. Emulátor má množstvo významných všestranných možností a funkčných tlačidiel.
Prvou z nich je schopnosť hrať so živými krupiérmi, po spustení ktorých používatelia získajú potrebné zručnosti pre víťaza automatu. Nájdete tu moderný dizajn a funkcie, ktoré vás zaujímajú.
V tomto slote sú základné ikony vyrobené v súlade s témou sveta zvierat. to dobrý spôsob skutočne štedrý darček, ako aj štedré výplaty a rôzne bonusy za roztočenie cien. Každý stroj má svoje výhody a skvelé ceny. Zlatá párty s automatom, ktorá si teraz môžete zahrať zadarmo online bez registrácie. Vulcan umožňuje svojim používateľom zúčastňovať sa hier s automatom The Money Game. Pomôže vám tiež zarobiť veľké sumy v automatickom režime bez registrácie a SMS. V prípade, že sa na valcoch objavia tri alebo viac symbolov kariet, hráč dostane výherné lístky. Karty sa najčastejšie dostávajú s určitou úrovňou komunikácie. Každá z týchto možností výrobcu je tiež možnosť hrať zadarmo. Rozdávajú však točenia zadarmo, zriedka v štyroch rôznych roztočeniach a ďalších kolách. Slávne historické filmy alebo prechádzky o zlatokopoch pre vynikajúcu náladu, symboly vysokej kvality, fenomenálne režimy luxusného automatu Volcano vám ponúkajú šancu trafiť skutočný jackpot.
Ponúkame vám, aby ste si potešili hlavný režim v obrovských virtuálnych kreditoch, a potom si vybrali svoju dovolenku.
Ak sa vám podarí vyhrať maximálny jackpot vo výške 5 000 kreditov, potom vás kasíno Vulcan pozve na hranie hazardnej hry o zdvojnásobenie a zisku. Zlatá párty s automatmi na hranie zadarmo online sa predĺži. Výplata závisí od toho, ako sa snaží zhromaždiť tri alebo viac rovnakých obrázkov.
Vďaka tomu sa stretnete s rôznymi symbolmi, ktoré sú vyrobené vo forme loga hry.
Takéto symboly sa okrem obrázkov v počte troch kusov zúčastňujú rôznych komponentov.
A keď sa postupnosť cien udeľuje podľa obvyklých obrázkov, sú rovnaké.
Stávka v automate Cash Farm je od jedného do tridsaťpäť kreditov. Ak je celková stavená suma až jeden dolár, výhra sa zdvojnásobí. Na hracom poli je dôležité zvoliť kartu, ktorá sa otvorí v nominálnej hodnote. Tu sa prijaté a koeficient vynásobia nominálnou hodnotou ako karta predajcu. Ak chcete zvýšiť cenu, musíte uhádnuť farbu karty lícom nadol - otvorí sa karta dealera naruby. Ak sa vám podarí zhromaždiť tri symboly kráľovského archeológa, platba sa zdvojnásobí. Zlatá párty s automatmi, hrajte zadarmo online tradičné video prezentované v americkom umení.
Play the Gold of the Party Pekná žena sa aktivuje prinajmenšom v trojitom okne hry rôzneho druhu. Hráč si musí zvoliť veľkosť stávky na roztočenie, ktorú poskytuje hracie pole, a stávku v rozmedzí 0,2 kreditu. Divoký symbol v online slote je obraz bonusového symbolu s obrazom rýchlomera zo sarkofágu. Keď sa na jednom z riadkov objaví bonusový symbol s obrázkom strany, bonusová hra sa aktivuje. Hrajte s nami zadarmo online automat, pretože sme všetci pracovali krok za krokom a na našom portáli sme komentovali všetky aspekty hrania automatov. Mnohé z našich prevádzkových intervalov majú určitú mieru návratnosti, takže to nemá zmysel.
Veľké výhody online kasína Slotobar v zásade nespôsobujú žiadne sťažnosti. Z týchto kasín stojí za zmienku živé kasínové bonusy sopky. Poskytujú možnosť hrať bezplatné výherné automaty bez toho, aby museli platiť za služby hráča. Slot má veľa softvéru a prehľadný systém športových stávok. Stávka sa pohybuje od 0,5 centu do 5 dolárov za deň, berúc do úvahy vašu vlastnú mieru alebo nakoniec. Takúto voľbu možno nájsť prostredníctvom sociálne siete... Hracie automaty ponúkajú veľký výber klasických simulátorov od popredných svetových výrobcov. Bonusy na sopky online v kasíne zdieľajú ich kvality a veľkorysosť. Ak sa na konci každého točenia rozsvieti najdlhšia sekvencia dvoch, troch, štyroch a piatich rovnakých symbolov.
Kombinácie musia začínať od prvého valca vľavo. Symboly v hre sú tiež navrhnuté v súlade s názvom obrázka a vytvárajú kombinácie podľa štandardných pravidiel. Automat na zlato párty má špeciálne symboly, funkciu pretočenia, ďalšie multiplikátory a ďalšie funkcie. Emulátor zariadenia tiež ponúka štandardný slot pre pohodlný panel s názvom Book of Ra od spoločnosti Novomatic a prvú bonusovú hru dostupnú pre bežných zákazníkov. Ak ste začiatočníci, potom sa vám to všetko vyplatí v samostatnej sekcii.
To je to, čo budeme považovať za tento automat. V strede pozornosti vám pomôže reinkarnácia v indickom jazyku a zahájenie veľmi veľkej časti skvelého príbehu.
Je veľmi ľahké hrať tento automat. Po páde valcov zľava doprava sa zastaví vpravo. Keď sa na valcoch objaví symbol Lady, ktorý zdvojnásobuje výhru, umožňuje hráčovi dostať súpera do jednej minimálnej sekvencie, začne sa točenie.
Nie je prípad, ak hráte na rovnakej aktívnej línii.
Automat v skutočnosti priťahuje pozornosť mnohých hráčov, ktorí si chcú oddýchnuť a dobiť energiu v reálnom čase a vyhnúť sa problémom s každým majiteľom. Samotné zvláštne miesto v meste nezaberie veľa času. Nádherná grafika, soundtrack, ako aj veľa príjemných emócií, hlava lovcov adrenalínu pre šťastie - to si zaslúži vašu pozornosť.
A každý hráč si bude môcť vybrať, či bude hrať o peniaze, alebo sa zoznámi so štedrou výhrou a šťastím.
Organická chémia -odbor chémie, ktorý skúma zlúčeniny uhlíka, ich štruktúru, vlastnosti , metódy syntézy, ako aj zákony ich transformácií. Zlúčeniny uhlíka s inými prvkami (hlavne s H, N, O, S, P, Si, Ge atď.) Sa nazývajú organické.
Jedinečná schopnosť atómov uhlíka viazať sa na seba, vytvárať reťazce rôznych dĺžok, cyklické štruktúry rôznej veľkosti, rámcové zlúčeniny, zlúčeniny s mnohými prvkami, rôznym zložením a štruktúrou, určuje rozmanitosť organických zlúčenín. K dnešnému dňu je počet známych organických zlúčenín oveľa viac ako 10 miliónov a každoročne sa zvyšuje o 250 - 300 tisíc. Svet okolo nás je tvorený hlavne organickými zlúčeninami, medzi ktoré patria: potraviny, odevy, palivo, farbivá, lieky, čistiace prostriedky, materiály pre rôzne technologické odvetvia a národné hospodárstvo. Organické zlúčeniny zohrávajú kľúčovú úlohu v existencii živých organizmov.
Na styku organickej chémie s anorganickou chémiou, biochémiou a medicínou vznikla chémia kovových a elementárnych organických zlúčenín, bioorganická a liečivá chémia a chémia makromolekulárnych zlúčenín.
Hlavnou metódou organickej chémie je syntéza. Organická chémia študuje nielen zlúčeniny získané z rastlinných a živočíšnych zdrojov (prírodné látky), ale hlavne zlúčeniny vytvorené umelo pomocou laboratórnej a priemyselnej syntézy.
Dejiny vývoja organickej chémie
Metódy získavania rôznych organických látok sú známe už v staroveku. Egypťania a Rimania teda používali farbivá rastlinného pôvodu - indigo a alizarín. Mnoho ľudí vlastnilo tajomstvá výroby alkoholických nápojov a octu z cukru a zo surovín obsahujúcich škrob.
Počas stredoveku sa k týmto poznatkom nepridalo prakticky nič, určitý pokrok sa začal až v 16. - 17. storočí (obdobie iatrochémie), keď sa nové organické zlúčeniny izolovali destiláciou rastlinných produktov. V rokoch 1769-1785 g. K.V. Scheele izolovalo sa niekoľko organických kyselín: jablčná, vínna, citrónová, gallová, mliečna a šťaveľová. V roku 1773 G.F. Ruel vylučovaná močovina z ľudského moču. Látky izolované zo živočíšnych a rastlinných surovín mali veľa spoločného, \u200b\u200bale líšili sa od anorganických zlúčenín. Takto vznikol pojem "organická chémia" - časť chémie, ktorá študuje látky izolované z organizmov (definícia Y. I. Berzelius1807). Zároveň sa verilo, že tieto látky je možné vďaka „vitálnej sile“ získať iba v živých organizmoch.
Všeobecne sa uznáva, že organická chémia ako veda sa objavila v roku 1828, kedy F. Wöhler najskôr dostala organickú látku - močovinu - v dôsledku odparenia vodného roztoku anorganickej látky - kyanátu amónneho (NH4OCN). Ďalšia experimentálna práca preukázala nepopierateľné argumenty pre nekonzistentnosť teórie „životnej sily“. Napríklad, A. Kolbe syntetizovaný octová kyselina, M. Berthelot dostal metán z H2S a CS2 a A.M. Butlerov syntetizované sladké látky z formalínu.
V polovici 19. storočia. pokračuje rýchly rozvoj syntetickej organickej chémie, vzniká prvá priemyselná výroba organických látok ( A. Hoffman, W. Perkin st. - syntetické farbivá, fuchsín, kyanín a aza farbivá). Zlepšenie otvorenosti N.N. Zinin (1842) metóda syntézy anilínu slúžila ako základ pre vytvorenie priemyslu anilínových farieb. V laboratóriu A. Bayer Syntetizovali sa prírodné farbivá - indigo, alizarín, indigo, xantén a antrachinón.
Dôležitou etapou vo vývoji teoretickej organickej chémie bol vývoj F. Kekule teória valencie v roku 1857, ako aj klasická teória chemickej štruktúry A.M.. Butlerov v roku 1861, podľa ktorého sa atómy v molekulách kombinujú v súlade s ich valenciou, chemickými a fyzikálne vlastnosti zlúčeniny sú určené povahou a počtom ich základných atómov, ako aj typom väzieb a vzájomným vplyvom priamo neviazaných atómov. V roku 1865 g. F. Kekule navrhla štruktúrny vzorec benzénu, ktorý sa stal jedným z najdôležitejších objavov v organickej chémii. V.V. Markovnikov a A.M. Zaitsev sformuloval niekoľko pravidiel, ktoré najskôr spájali smerovanie organických reakcií so štruktúrou látok, ktoré do nich vstupujú. V roku 1875 Van't Hoff a Le Bel navrhla štvorboký model atómu uhlíka, podľa ktorého sú uhlíkové valencie nasmerované na vrcholy štvorstenu, v strede ktorého sa nachádza atóm uhlíka. Na základe tohto modelu v kombinácii s experimentálnym výskumom I. Vislicenus (! 873), ktoré preukázali identitu štruktúrnych vzorcov (+) - kyseliny mliečnej (z kyslého mlieka) a (±) -mliečnej kyseliny, vznikla stereochémia - veda o trojrozmernej orientácii atómov v molekulách, ktorá predpovedala prítomnosť 4 rôznych substituentov na atóm uhlíka (chirálne štruktúry) možnosť existencie izomérov vesmírneho zrkadla (antipódy alebo enantioméry).
V roku 1917 g. Lewis navrhuje zvážiť chemickú väzbu pomocou elektrónových párov.
V roku 1931 g. Hückel aplikovaná kvantová teória na vysvetlenie vlastností nebenzoových aromatických systémov, a tým nastolenie nového smeru v organickej chémii - kvantová chémia. To bolo impulzom pre ďalší intenzívny rozvoj kvanta chemické metódy, najmä metóda molekulárne orbitaly... Fázu prenikania orbitálnych konceptov do organickej chémie otvorila teória rezonancie L. Pauling (1931-1933) a ďalšie práce K. Fukui, R. Woodward a R. Hoffman o úlohe hraničných orbitálov pri určovaní smeru chemických reakcií.
Polovica 20. storočia charakterizovaný obzvlášť rýchlym vývojom organickej syntézy. To bolo určené objavom základných procesov, ako je výroba olefínov pomocou ylidov ( G. Wittig, 1954), syntéza diénu ( O. Diels a K. Jelša, 1928), hydroborácia nenasýtených zlúčenín ( G. Brown, 1959), syntéza nukleotidov a syntéza génov ( A. Todd, H. Korán). Pokroky v chémii kovovo-organických zlúčenín sú do veľkej miery spôsobené prácou A.N. Nesmeyanova a G.A. Razuvaeva... V roku 1951 sa uskutočnila syntéza ferocénu, ktorej vytvorenie bolo založené na „sendvičovej“ štruktúre R. Woodward a J. Wilkinson inicioval chémiu metalocénových zlúčenín a organickú chémiu prechodných kovov všeobecne.
V 20-30 g. A.E. Arbuzov vytvára základy chémie organofosforových zlúčenín, čo následne viedlo k objaveniu nových druhov fyziologicky aktívnych zlúčenín, komplexónov a pod.
O 60-80 rokov. C. Pedersen, D. Crum a J.M. Bielizeň vyvinúť chémiu korunových éterov, kryptandov a ďalších príbuzných štruktúr schopných vytvárať silné molekulárne komplexy, a tak pristupovať k najdôležitejšiemu problému „molekulárneho rozpoznávania“.
Moderná organická chémia pokračuje v rýchlom vývoji. Nové činidlá, zásadne nové syntetické metódy a techniky, nové katalyzátory sa zavádzajú do praxe organickej syntézy a syntetizujú sa doteraz neznáme organické štruktúry. Hľadanie nových organických biologicky aktívnych zlúčenín neustále prebieha. Na ich riešenie čaká oveľa viac problémov v organickej chémii, napríklad podrobné stanovenie vzťahu medzi štruktúrou a vlastnosťami (vrátane biologickej aktivity), stanovenie štruktúry a stereoskopická syntéza komplexných prírodných zlúčenín, vývoj nových metód regio- a stereoselektívnej syntézy, hľadanie nových univerzálnych reagencií a katalyzátorov. ...
Záujem svetovej komunity o vývoj organickej chémie názorne demonštroval prezentácia nobelová cena v chémii 2010 R. Heku, A. Suzuki a E. Negishi za prácu na použití paládiových katalyzátorov v organickej syntéze na tvorbu väzieb uhlík-uhlík.
Klasifikácia organických zlúčenín
Klasifikácia je založená na štruktúre organických zlúčenín. Základom pre opis štruktúry je štruktúrny vzorec.
Hlavné triedy organických zlúčenín
Uhľovodíky -zlúčeniny pozostávajúce iba z uhlíka a vodíka. Oni sú zase rozdelení na:
Nasýtený - obsahujú iba jednoduché (σ-väzby) a neobsahujú viacnásobné väzby;
Nenasýtené - obsahujú najmenej jednu dvojitú (n-väzbu) a / alebo trojitú väzbu;
Otvorená reťaz (alicyklický);
Uzavretý okruh (cyklické) - obsahujú slučku
Patria sem alkány, alkény, alkíny, diény, cykloalkány, arény
Zlúčeniny s heteroatómami vo funkčných skupinách - zlúčeniny, v ktorých je uhlíkový radikál R naviazaný na funkčnú skupinu. Takéto zlúčeniny sú klasifikované podľa povahy funkčnej skupiny:
Alkohol, fenoly(obsahujú hydroxylovú skupinu OH)
Étery(obsahujú zoskupenie R-O-R alebo R-O-R
Karbonylové zlúčeniny (obsahujú skupinu RR "C \u003d O), patria sem aldehydy, ketóny, chinóny.
Zlúčeniny obsahujúce karboxylovú skupinu (COOH alebo COOR), patria sem estery karboxylových kyselín
Elementárne a organokovové zlúčeniny
Heterocyklické zlúčeniny -obsahujú heteroatómy v kruhu. Líšia sa povahou cyklu (nasýtený, aromatický), počtom atómov v kruhu (troj-, štvor-, päť-, šesťčlenné kruhy atď.), Charakterom heteroatómu, počtom heteroatómov v kruhu. To určuje obrovskú škálu známych a každoročne syntetizovaných zlúčenín tejto triedy. Heterocyklická chémia je jednou z najfascinujúcejších a najdôležitejších oblastí organickej chémie. Stačí povedať, že viac ako 60% lieky syntetický a prírodný pôvod patria do rôznych tried heterocyklických zlúčenín.
Prírodné zlúčeniny -zlúčeniny spravidla pomerne zložitej štruktúry, často patriace do niekoľkých tried organických zlúčenín naraz. Medzi nimi sú: aminokyseliny, bielkoviny, sacharidy, alkaloidy, terpény atď.
Polyméry - Látky s veľmi vysokou molekulovou hmotnosťou pozostávajúce z periodicky sa opakujúcich fragmentov - monomérov.
Štruktúra organických zlúčenín
Organické molekuly sú tvorené hlavne kovalentnými nepolárnymi väzbami C-C alebo kovalentnými polárnymi väzbami ako C-O, C-N, C-Hal. Polarita sa vysvetľuje posunom hustoty elektrónov smerom k elektronegatívnejšiemu atómu. Na opísanie štruktúry organických zlúčenín používajú chemici jazyk štruktúrnych vzorcov molekúl, v ktorých sú väzby medzi jednotlivými atómami označené pomocou jednej (jednoduchej alebo jednoduchej väzby), dvoch (dvojitých) alebo troch (trojitých) valenčných čiar. Koncept valenčnej cievnej mozgovej príhody, ktorý dodnes nestratil na význame, bol zavedený do organickej chémie A. Cooper v roku 1858
Pre pochopenie štruktúry organických zlúčenín je veľmi dôležitý koncept hybridizácie atómov uhlíka. Atóm uhlíka v základnom stave má elektronickú konfiguráciu 1s 2 2s 2 2p 2, na základe ktorej nie je možné vysvetliť inherentnú valenciu uhlíka v jeho zlúčeninách a existenciu 4 identických väzieb v alkánoch smerujúcich k vrcholom štvorstena. V rámci metódy valenčnej väzby je tento rozpor vyriešený zavedením konceptu hybridizácie. Keď nadšený, s→pprechod elektrónu a následný tzv. sp-hybridizácia a energia hybridizovaných orbitálov je medzi energiami stredná s- a p-orbitály. Keď sa väzby tvoria v alkánoch, tri r-elektrón interaguje s jedným s-elektrón ( sp 3 -hybridizácia) a objavia sa 4 identické orbitaly umiestnené navzájom v štvorbokých uhloch (109 asi 28 "). Atómy uhlíka v alkénoch sú umiestnené v sp 2 -hybridný stav: každý atóm uhlíka má tri rovnaké orbitaly ležiace v rovnakej rovine pod uhlom 120 ° k sebe navzájom ( sp 2-orbitály) a štvrtý ( r-orbitál) je kolmý na túto rovinu. Prekrývanie r-orbitály dvoch atómov uhlíka tvoria dvojitú (π) väzbu. Atómy uhlíka nesúce trojitú väzbu sú v sp-hybridný stav.
Vlastnosti organických reakcií
V nie organické reakcie obvykle sú zahrnuté ióny, také reakcie prebiehajú rýchlo a nakoniec pri izbovej teplote. V organických reakciách často dochádza k zlomom kovalentných väzieb s tvorbou nových. Tieto procesy typicky vyžadujú špecifické podmienky: určitú teplotu, reakčný čas, určité rozpúšťadlá a často prítomnosť katalyzátora. Spravidla sa nevyskytuje jedna, ale viac reakcií naraz. Preto sa pri výbere organických reakcií nepoužívajú rovnice, ale schémy bez výpočtu stechiometrie. Výťažky cieľových látok v organických reakciách často nepresahujú 50% a ich izolácia z reakčnej zmesi a čistenie si vyžadujú špecifické metódy a techniky. Na čistenie pevných látok sa zvyčajne používa rekryštalizácia zo špeciálne vybraných rozpúšťadiel. Kvapalné látky sa čistia destiláciou za atmosférického tlaku alebo vo vákuu (v závislosti od teploty varu). Na riadenie priebehu reakcií a na oddelenie zložitých reakčných zmesí sa uchýlia k rôznym typom chromatografie [tenkovrstvová chromatografia (TLC), preparatívna vysokoúčinná kvapalinová chromatografia (HPLC) atď.].
Reakcie môžu prebiehať veľmi zložitým spôsobom a v niekoľkých fázach. Ako medziprodukty môžu vzniknúť radikály R ·, karbokationty R +, karbanióny R -, karbény: CX 2, radikálne katióny, radikálne anióny a ďalšie aktívne a nestabilné častice, ktoré zvyčajne žijú zlomok sekundy. Detailný popis nazývajú sa všetky transformácie, ktoré sa vyskytujú na molekulárnej úrovni počas reakcie reakčný mechanizmus... Podľa povahy prasknutia a tvorby väzieb sa rozlišujú radikálne (homolytické) a iónové (heterolytické) procesy. Podľa typov transformácií sa rozlišujú radikálne reťazové reakcie, reakcie nukleofilnej (alifatickej a aromatickej) substitúcie, eliminačné reakcie, elektrofilná adícia, elektrofilná substitúcia, kondenzácia, cyklizácia, procesy nového usporiadania atď. Reakcie sa tiež klasifikujú podľa metód ich iniciovania (excitácia). ), ich kinetické poradie (monomolekulárne, bimolekulárne atď.).
Stanovenie štruktúry organických zlúčenín
Počas celej existencie organickej chémie ako vedy bolo najdôležitejšou úlohou určiť štruktúru organických zlúčenín. To znamená zistiť, ktoré atómy sú súčasťou štruktúry, v akom poradí a ako sú tieto atómy spojené a ako sa nachádzajú v priestore.
Existuje niekoľko metód riešenia týchto problémov.
- Elementárna analýza spočíva v tom, že sa látka rozkladá na jednoduchšie molekuly, podľa počtu ktorých môžete určiť počet atómov, z ktorých sa zlúčenina skladá. Táto metóda znemožňuje stanoviť poradie väzieb medzi atómami. Často sa používa iba na potvrdenie navrhovanej štruktúry.
- Infračervená spektroskopia (IR spektroskopia) a Ramanova spektroskopia (Ramanova spektroskopia). Metóda je založená na skutočnosti, že látka interaguje s elektromagnetickým žiarením (svetlom) infračerveného rozsahu (absorpcia sa pozoruje v IR spektroskopii a rozptyl žiarenia v Ramanovej spektroskopii). Po absorpcii toto svetlo excituje vibračné a rotačné úrovne molekúl. Referenčnými údajmi sú počet, frekvencia a intenzita molekulárnych vibrácií spojených so zmenou dipólového momentu (IR) alebo polarizovateľnosti (RS). Metóda umožňuje zistiť prítomnosť funkčných skupín a tiež sa často používa na potvrdenie identity látky s niektorými už známymi látkami porovnaním ich spektier.
- Hmotnostná spektrometria... Látka sa za určitých podmienok (vplyv elektrónov, chemická ionizácia atď.) Zmení na ióny bez straty atómov (molekulárne ióny) a so stratou (fragmentácia, fragmentové ióny). Metóda umožňuje určiť molekulovú hmotnosť látky, jej izotopové zloženie a niekedy prítomnosť funkčných skupín. Povaha fragmentácie nám umožňuje vyvodiť určité závery o štruktúrnych vlastnostiach a znovu vytvoriť štruktúru študovanej zlúčeniny.
- Metóda nukleárnej magnetickej rezonancie (NMR) je založená na interakcii jadier s vlastným magnetickým momentom (spinom) a umiestnených vo vonkajšom konštantnom magnetickom poli (spinovom preorientovaní) s premenlivým elektromagnetickým žiarením vysokofrekvenčného rozsahu. NMR je jednou z najdôležitejších a najinformatívnejších metód na stanovenie chemickej štruktúry. Metóda sa tiež používa na štúdium priestorovej štruktúry a dynamiky molekúl. V závislosti od jadier interagujúcich so žiarením sa rozlišuje napríklad spôsob protónovej rezonancie (PMR, 1H NMR), ktorý umožňuje určiť polohu atómov vodíka v molekule. Metóda 19F NMR umožňuje určiť prítomnosť a polohu atómov fluóru. Metóda 31P NMR poskytuje informácie o prítomnosti, valenčnom stave a polohe atómov fosforu v molekule. Metóda 13C NMR umožňuje určiť počet a typy atómov uhlíka; používa sa na štúdium uhlíkového skeletu molekuly. Na rozdiel od prvých troch druhá metóda používa vedľajší izotop prvku, pretože jadro hlavného izotopu 12 C má nulovú rotáciu a nie je ho možné pozorovať pomocou NMR.
- Metóda ultrafialovej spektroskopie (UV spektroskopia)alebo spektroskopia elektronických prechodov. Metóda je založená na absorpcii elektromagnetického žiarenia v ultrafialových a viditeľných spektrálnych oblastiach počas prechodu elektrónov v molekule z vyšších obsadených energetických úrovní na voľné (excitácia molekuly). Najčastejšie sa používa na stanovenie prítomnosti a charakteristík konjugovaných π-systémov.
- Metódy analytickej chémieumožňujú určiť prítomnosť niektorých funkčných skupín špecifickými chemickými (kvalitatívnymi) reakciami, ktorých výskyt je možné zaznamenať vizuálne (napríklad vzhľad alebo zmena farby) alebo použitím iných metód. Okrem chemických metód analýzy sa v organickej chémii čoraz viac používajú inštrumentálne analytické metódy, ako je chromatografia (tenkovrstvá, plynová, kvapalná). Čestné miesto medzi nimi zaujíma chromatomasová spektrometria, ktorá umožňuje nielen hodnotenie stupňa čistoty získaných zlúčenín, ale aj získanie hmotnostných spektrálnych informácií o zložkách komplexných zmesí.
- Metódy štúdia stereochémie organických zlúčenín... Od začiatku 80. rokov. Bolo zrejmé, že je účelné vyvinúť nový smer vo farmakológii a farmácii spojený s vývojom enantiomérne čistých liekov s optimálnym pomerom terapeutickej účinnosti a bezpečnosti. V súčasnosti asi 15% všetkých syntetizovaných farmaceutík predstavuje čisté enantioméry. Tento trend sa odráža vo výskyte posledných rokov termínu vo vedeckej literatúre chirálna prepínač, čo v ruštine znamená „prechod na chirálne molekuly“. V tomto ohľade získavajú metódy stanovenia absolútnej konfigurácie chirálnych organických molekúl a stanovenia ich optickej čistoty osobitný význam v organickej chémii. Hlavnou metódou na stanovenie absolútnej konfigurácie by mala byť röntgenová štrukturálna analýza (XRD) a optická čistota - chromatografia na kolónach so stacionárnou chirálnou fázou a NMR s použitím ďalších špeciálnych chirálnych reagencií.
Vzťah organickej chémie s chemickým priemyslom
Hlavná metóda organickej chémie - syntéza - úzko spája organickú chémiu s chemickým priemyslom. Na základe metód a vývoja syntetickej organickej chémie vznikla nízkotonážna (jemná) organická syntéza vrátane výroby liečiv, vitamínov, enzýmov, feromónov, tekutých kryštálov, organických polovodičov, solárnych batérií atď. Rozvoj veľkej (hlavnej) organickej syntézy je tiež založený o úspechoch organickej chémie. Hlavná organická syntéza zahŕňa výrobu umelých vlákien, plastov, spracovania ropy, plynu a uhlia.
Odporúčané čítanie
- G.V. Bykov, Dejiny organickej chémie, M.: Mir, 1976 (http: //gen.lib/rus.ec/get? Md5 \u003d)
- J. March, Organická chémia: reakcie, mechanizmy a štruktúra, v 4 zväzkoch, M.: Mir, 1987
- F. Carey, R. Sandberg, Kurz pre pokročilých v organickej chémii, v 2 zväzkoch, Moskva: Chemistry, 1981
- O. A. Reutov, A.L. Kurtz, K.P. Ale v, Organická chémia, v 4 častiach, M.: „Binom, Laboratory of Knowledge“, 1999-2004. (http://edu.prometey.org./library/autor/7883.html)
- Chemická encyklopédia, vyd. Knunyants, Moskva: „Veľká ruská encyklopédia“, 1992.