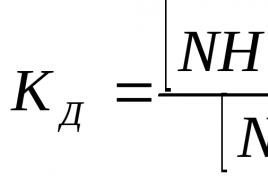Kolikšna je konstanta hitrosti reakcije. "O uporabi izraza" konstanta hitrosti kemijske reakcije
Predmet kemijske kinetike.
Termodinamika upošteva samo začetno in končno stanje sistema, omogoča zelo natančno napovedovanje temeljne možnosti procesa, ne daje pa nobenih informacij o mehanizmu procesa, o njegovih časovnih spremembah.
Vsa ta vprašanja fizikalna kemija obravnavano v poglavju o kemijski kinetiki.
Imenuje se del fizikalne kemije, posvečen zakonitostim, ki urejajo potek kemijskih procesov v času kemijska kinetika.
Naloge kemijske kinetike:
1. eksperimentalna študija hitrosti reakcij in njihove odvisnosti od pogojnih pojavov (koncentracija reaktantov, temperatura, prisotnost drugih snovi itd.);
2. vzpostavitev reakcijskega mehanizma, to je število osnovnih stopenj in sestava nastalih vmesnih produktov.
Kvantitativni opis odvisnosti hitrost reakcije o koncentraciji reakcijskih snovi temelji na osnovnem postulatu kemijske kinetike in predstavlja predmet formalna kinetika.
Na splošno lahko kemično reakcijo zapišemo tako:
ν 1 A 1 + ν 2 A 2 +… + ν i A i ν 1 ´A 1 ´ + ν 2 ´A 2 ´ +… + ν n ´A n ´,
kjer so ν i in ν n ´ stehiometrični koeficienti vhodnih snovi oziroma produkti reakcije; А i in А n ´ - začetne snovi in \u200b\u200bprodukti reakcije.
Hitrost kemijske reakcije υ je sprememba količine reaktantov na enoto časa na enoto prostornine (merjeno v mol / (l ∙ s)).
Ker se količina reaktantov sčasoma spreminja, je hitrost reakcije odvisna od časa. Koncept lahko predstavite povprečna hitrost reakcije, v določenem časovnem obdobju:
kje n 1 in n 2 - koncentracija ene od izhodnih snovi v izhodišču t 1 in končno t 2 trenutek časa.
Hitrost reakcije se določi z zmanjšanjem količine ene od reagirajočih snovi (z znakom "-") ali s povečanjem količine ene od nastalih snovi (z znakom "+") na enoto časa na enoto prostornine.
Z zmanjšanjem urnega intervala, kdaj, dobimo izraz za resnična hitrost ob določenem času:
Če je prostornina sistema konstantna ( V \u003d const), potem lahko uporabite koncept koncentracije:
Ta enačba se upošteva pri reakcijah v raztopinah, ko je spremembo prostornine mogoče zanemariti.
Kemijske reakcije praviloma potekajo v več fazah. Hitrost celotna reakcija je določena s hitrostjo najpočasnejše stopnje, imenovane omejujoča.
Hitrost reakcije je odvisna od številnih dejavnikov: narave in koncentracije reagirajočih snovi, temperature, prisotnosti drugih snovi (katalizatorji, inhibitorji) itd.
Na splošno po zakon množičnega delovanja, lahko pišete, da je hitrost kemijske reakcije neposredno sorazmerna z umnožkom koncentracije reakcijskih snovi v nekaterih močeh, enakih vrstnemu redu reakcije za določeno snov:
| , | (1) |
kje je hitrost kemijske reakcije;
k- konstanta hitrosti kemične reakcije;
- koncentracija reaktantov;
n i - vrstni red reakcije za določeno snov.
Kliče se izraz (1) glavni postulat kemijske kinetike.Kamor ν i \u003d n i v primerih, ko reakcija poteka v eni fazi, pa tudi pri vseh reakcijah, ki potekajo v ravnotežnih pogojih (ne glede na to, da lahko v pogojih, ki niso ravnotežni, nadaljujejo skozi številne vmesne stopnje). V večini primerov vrstni red reakcije ni enak stehiometričnemu koeficientu (za večstopenjske reakcije) in se določi eksperimentalno.
Imenuje se koeficient sorazmernosti v glavnem postulatu kemijske kinetike konstanta reakcijske hitrosti k ... Fizični pomen koeficienta k lahko določimo, če vzamemo koncentracijo reaktantov 1, potem bo konstanta hitrosti kemične reakcije enaka vrednosti hitrosti reakcije. Konstanta hitrosti k je odvisna od narave reakcijskih snovi, temperature, ni pa odvisna od koncentracije izhodnih snovi.
Mehanizme nastanka kemijskih transformacij in njihove hitrosti preučuje kemijska kinetika. Kemični procesi potekajo pravočasno z različnimi hitrostmi. Nekateri se zgodijo hitro, skoraj takoj, drugi nadaljujejo zelo dolgo.
V stiku z
Hitrostna reakcija - hitrost porabe reagentov (njihova koncentracija se zmanjša) ali reakcijski produkti nastanejo na enoto prostornine.
Dejavniki, ki lahko vplivajo na hitrost kemijske reakcije
Naslednji dejavniki lahko vplivajo na to, kako hitro poteka kemična interakcija:
- koncentracija snovi;
- narava reagentov;
- temperatura;
- prisotnost katalizatorja;
- tlak (za reakcije v plinskem okolju).
Tako lahko s spreminjanjem določenih pogojev kemičnega procesa vplivamo na to, kako hitro bo postopek potekal.
 V procesu kemijske interakcije delci reakcijskih snovi trčijo med seboj. Število takih naključij je sorazmerno s številom delcev snovi v prostornini reakcijske zmesi in je zato sorazmerno z molskimi koncentracijami reagentov.
V procesu kemijske interakcije delci reakcijskih snovi trčijo med seboj. Število takih naključij je sorazmerno s številom delcev snovi v prostornini reakcijske zmesi in je zato sorazmerno z molskimi koncentracijami reagentov.
Zakon o množičnih akcijah opisuje odvisnost hitrosti reakcije od molskih koncentracij medsebojno delujočih snovi.
Za osnovno reakcijo (A + B → ...) je ta zakon izražen s formulo:
υ \u003d k ∙ С A ∙ С B,
kjer je k konstanta hitrosti; C A in C B - molski koncentraciji reagentov, A in B.
Če je ena od reakcijskih snovi v trdnem stanju, potem pride do interakcije na vmesniku, zato koncentracija trdne snovi ni vključena v enačbo kinetičnega zakona efektivnih mas. Da bi razumeli fizični pomen konstante hitrosti, je treba C, A in C B vzeti za enak 1. Potem postane jasno, da je konstanta hitrosti enaka reakcijski hitrosti pri koncentracijah reagenta, enaki enoti.
Narava reagentov
Ker se v procesu interakcije uničijo kemične vezi reakcijskih snovi in \u200b\u200bse tvorijo nove vezi reakcijskih produktov, bosta igrala pomembno vlogo narava vezi, ki sodeluje pri reakciji spojin, in struktura molekul reakcijskih snovi.
Površina stika reagentov
Takšna značilnost, kot je površina stika trdnih reagentov, včasih precej pomembno vpliva na potek reakcije. Mletje trdne snovi vam omogoča, da povečate površino stika med reagenti in s tem pospešite postopek. Območje stika topnih snovi se zlahka poveča z raztapljanjem snovi.
Reakcijska temperatura
 Ko se temperatura dvigne, se bo energija trkajočih delcev povečala; očitno je, da ko temperatura naraste, kemični postopek bo pospešila. Podatke v tabeli lahko obravnavamo kot ponazoritveni primer, kako povišanje temperature vpliva na proces medsebojnega vplivanja snovi.
Ko se temperatura dvigne, se bo energija trkajočih delcev povečala; očitno je, da ko temperatura naraste, kemični postopek bo pospešila. Podatke v tabeli lahko obravnavamo kot ponazoritveni primer, kako povišanje temperature vpliva na proces medsebojnega vplivanja snovi.
Tabela 1. Vpliv temperaturnih sprememb na hitrost nastajanja vode (О 2 + 2Н 2 → 2Н 2 О)
Za kvantitativni opis, kako lahko temperatura vpliva na hitrost interakcije snovi, se uporablja Van't Hoffovo pravilo. Van't Hoffovo pravilo je, da ko temperatura naraste za 10 stopinj, pride do pospeška 2-4 krat.
Matematična formula, ki opisuje Van't Hoffovo pravilo, je naslednja:
Kjer je γ - temperaturni koeficient hitrost kemijske reakcije (γ \u003d 2-4).
Toda Arrheniusova enačba veliko natančneje opisuje temperaturno odvisnost konstante hitrosti:
Kjer je R univerzalna plinska konstanta, je A faktor, ki ga določa vrsta reakcije, E, A pa aktivacijska energija.
Aktivacijska energija je energija, ki jo mora molekula pridobiti, da lahko pride do kemijske preobrazbe. To pomeni, da gre za nekakšno energetsko oviro, ki jo bodo morali molekule, ki trčijo v reakcijski prostornini, premagati, da bodo lahko prerazporedile vezi.
Aktivacijska energija ni odvisna od zunanjih dejavnikov, ampak je odvisna od narave snovi. Vrednost aktivacijske energije do 40-50 kJ / mol omogoča, da snovi reagirajo precej aktivno. Če aktivacijska energija preseže 120 kJ / mol, potem bodo snovi (pri normalnih temperaturah) reagirale zelo počasi. Sprememba temperature vodi do spremembe števila aktivnih molekul, to je molekul, ki so dosegle energijo, večjo od aktivacijske energije, in so zato sposobne kemičnih transformacij.
Dejanje katalizatorja
 Katalizator je snov, ki lahko pospeši postopek, vendar ni del njegovih izdelkov. Kataliza (pospeševanje kemijske preobrazbe) se deli na · homogene, · heterogene. Če sta reaktanta in katalizator v istem agregatnem stanju, potem kataliza imenujemo homogena, če drugačna, pa heterogena. Mehanizmi delovanja katalizatorjev so različni in precej zapleteni. Poleg tega je treba opozoriti, da je za katalizatorje značilna selektivnost delovanja. To pomeni, da en in isti katalizator, medtem ko pospešuje eno reakcijo, nikakor ne sme spremeniti hitrosti drugega.
Katalizator je snov, ki lahko pospeši postopek, vendar ni del njegovih izdelkov. Kataliza (pospeševanje kemijske preobrazbe) se deli na · homogene, · heterogene. Če sta reaktanta in katalizator v istem agregatnem stanju, potem kataliza imenujemo homogena, če drugačna, pa heterogena. Mehanizmi delovanja katalizatorjev so različni in precej zapleteni. Poleg tega je treba opozoriti, da je za katalizatorje značilna selektivnost delovanja. To pomeni, da en in isti katalizator, medtem ko pospešuje eno reakcijo, nikakor ne sme spremeniti hitrosti drugega.
Pritisk
Če pri preoblikovanju sodelujejo plinaste snovi, bo sprememba tlaka v sistemu vplivala na hitrost postopka ... To je zato, kerda pri plinastih reaktantih sprememba tlaka vodi do spremembe koncentracije.
Eksperimentalno določanje hitrosti kemijske reakcije
Eksperimentalno je mogoče določiti hitrost kemične transformacije s pridobivanjem podatkov o tem, kako se spreminja koncentracija reagirajočih snovi ali produktov na enoto časa. Metode za pridobivanje takih podatkov so razdeljene na
- kemična,
- fizikalni in kemični.
 Kemične metode so dokaj preproste, cenovno dostopne in natančne. Z njihovo pomočjo se hitrost določi z neposrednim merjenjem koncentracije ali količine snovi reagentov ali izdelkov. V primeru počasne reakcije se odvzamejo vzorci za nadzor porabe reagenta. Nato se določi vsebnost reagenta v vzorcu. Z rednim odvzemom vzorcev je mogoče dobiti podatke o spremembi količine snovi med interakcijo. Najpogosteje uporabljeni vrsti analize sta titrimetrija in gravimetrija.
Kemične metode so dokaj preproste, cenovno dostopne in natančne. Z njihovo pomočjo se hitrost določi z neposrednim merjenjem koncentracije ali količine snovi reagentov ali izdelkov. V primeru počasne reakcije se odvzamejo vzorci za nadzor porabe reagenta. Nato se določi vsebnost reagenta v vzorcu. Z rednim odvzemom vzorcev je mogoče dobiti podatke o spremembi količine snovi med interakcijo. Najpogosteje uporabljeni vrsti analize sta titrimetrija in gravimetrija.
Če reakcija poteka hitro, jo je treba za odvzem vzorca ustaviti. To lahko storite s hlajenjem, nenadno odstranjevanje katalizatorja, lahko tudi razredčite ali prenesete enega od reagentov v neaktivno stanje.
Metode fizikalna in kemijska analiza v sodobni eksperimentalni kinetiki se uporabljajo pogosteje kot kemične. Z njihovo pomočjo lahko sproti opazujete spremembo koncentracije snovi. V tem primeru reakcije ni treba ustaviti in odvzeti vzorcev.
Fizikalno-kemijske metode temeljijo na merjenju fizične lastnosti, odvisno od količinske vsebnosti v sistemu določene spojine in se sčasoma spreminja. Če na primer v reakcijo sodelujejo plini, je to lahko tlak. Izmerijo tudi električno prevodnost, lomni količnik, absorpcijski spekter snovi.
Reakcija prvega reda [k] \u003d.
Reakcija drugega reda [k] \u003d [l / mol ∙ t]
Reakcija n-tega reda [k] \u003d [mol 1- n ∙ l n -1 ∙ t - t]
III. Temperatura.Z naraščanjem temperature se poveča kinetična energija molekul in posledično hitrost njihovega gibanja. Povečanje hitrosti vodi do povečanja števila trkov molekul in posledično do povečanja hitrosti reakcije. Eksperimentalno je bilo ugotovljeno, da se s povečanjem temperature na vsakih 10 0 hitrost kemične reakcije poveča za 2-4 krat:
V 2 \u003d V 1 ∙ γ (T 2 - T 1) / 10 ali V 2 / V 1 \u003d γ (T 2 - T 1) / 10
kjer je V 1 hitrost reakcije pri temperaturi T 1, V 2 hitrost reakcije pri temperaturi T 2,
γ je temperaturni koeficient hitrosti reakcije, njegova vrednost za večino anorganskih reakcij se giblje od dveh do štirih. Ta vzorec se imenuje pravilo Van't Hoffa.
Ko temperatura narašča, se hitrost reakcije poveča, vendar se koncentracija reaktantov ne spremeni. Posledično se konstanta hitrosti spreminja in povečuje z naraščanjem temperature. Odvisnost konstante hitrosti kemijske reakcije od temperature opisuje Arrheniusova enačba:
k \u003d k o ∙ e -Ea / RT
kjer je k o koeficient, ki upošteva število aktivnih trkov, R je univerzalna plinska konstanta, T temperatura, E a aktivacijska energija.
Aktivacijska energija Je energija molekul, pri katerih vsako trčenje vodi do kemične reakcije.
Fizični pomen aktivacijske energije je enostavno razbrati s slike.
prod.r-cija
Ordinata je vsota entalpij izhodnih snovi in \u200b\u200bproduktov reakcije, abscisa pa smer reakcije. V tem primeru razlika med vsoto energij začetnih snovi in \u200b\u200bmaksimumom krivulje daje vrednost aktivacijske energije neposredne reakcije (E a), razlika med vsoto energij produktov reakcije in enakim maksimumom pa energijo aktivacije povratne reakcije (E "a).
IV. Katalizator.Katalizatorji so snovi, ki spreminjajo hitrost kemijske reakcije, vendar niso vključene v enačbo stehiometrične reakcije. Katalizatorji lahko povečajo hitrost kemične reakcije ali pa jo zmanjšajo. Imenujemo snovi, ki zmanjšajo hitrost reakcije inhibitorji... Katalizatorji so neposredno vključeni v kemično reakcijo, vendar jih je na koncu reakcije mogoče izolirati iz reakcijske zmesi v začetni količini. Za katalizatorje je značilna selektivnost, tj. sposobnost vpliva na prehod reakcije v določeno smer:
4 NH 3 + 3 O 2 \u003d 6 H 2 O + 2 N 2 (brez katalizatorja)
4 NH 3 + 5 O 2 \u003d 4 NO + 6 H 2 O (Pt katalizator)
Co, Rh → CH 3 CH 2 CH 2 OH + CH 3 CH OH CH 3
Posebno mesto zasedajo biokatalizatorji - encimi,ki so beljakovine. Vplivajo na hitrost strogo določenih reakcij, tj. imajo visoko selektivnost. Sposobni so pri sobni temperaturi povečati hitrost reakcij milijard in bilijonov krat. Ko se temperatura dvigne, izgubijo svojo aktivnost, ker pride do denaturacije beljakovin.
Elementarno dejanje kemijske reakcije se zgodi v trenutku trka reagirajočih delcev. Povečanje koncentracije reagentov ustreza povečanju števila delcev v prostornini, kar vodi do pogostejših trkov in posledično do povečanja hitrosti reakcije. Kvantitativna odvisnost hitrosti reakcije od koncentracije je izražena z osnovnim postulatom kemijske kinetike, tj zakon množic v akciji.
Hitrost preproste homogene reakcije pri konstantni temperaturi je sorazmerna zmnožku koncentracij reaktantov, dvignjenih na moči, ki so številčno enake njihovim stehiometričnim koeficientom.
kje inin b -stehiometrični koeficienti reagentov; c (A) in c (B) sta molski koncentraciji reagentov; kje konstanta hitrosti reakcije.
Ta izraz za hitrost reakcije je kinetična enačba samo za preprosto reakcijo.
Konstanta hitrosti reakcije je posamezna značilnost reakcije. Vrednost konstante reakcijske hitrosti je odvisna od narave reaktantov, temperature sistema in prisotnosti katalizatorja v njem. Vrednost kza dane reakcijske pogoje ni odvisna od koncentracije reaktantov, zato konstanta hitrosti med reakcijo ostane nespremenjena in je njen temeljni kinetični parameter.
Vrednost konstante reakcijske hitrosti je številčno enaka reakcijski hitrosti pri koncentracijah reagenta, enakih 1 mol / l.
Konstanto hitrosti reakcije lahko določimo le eksperimentalno, s preučevanjem kinetike te reakcije in izdelavo njene kinetične enačbe glede na pridobljene podatke.
Kinetično enačbo vsake reakcije določimo eksperimentalno, saj je ni mogoče napovedati iz oblike kemijske enačbe reakcije. Zato se najprej pri konstantni temperaturi eksperimentalno ugotovi odvisnost hitrosti reakcije od koncentracije vsakega reagenta posebej, medtem ko naj ostanejo koncentracije vseh ostalih reagentov konstantne, kar običajno zagotavlja njihov velik presežek v reakcijskem mediju. Za določitev koncentracije reagenta, ki nas zanima, se kadar koli uporabljajo naslednje metode: titracija (oddelek 8.3.2), potenciometrija (oddelek 25.6), konduktometrija (oddelek 24.5), kromatografija (oddelek 26.7) ali druge, med katerimi lahko izbiramo tako vrednost lastnosti, izmerjena s to metodo, je bila jasno odvisna od koncentracije danega reagenta. Na podlagi pridobljenih eksperimentalnih podatkov je sestavljena kinetična enačba za preučevano reakcijo:
![]()
kje n Ain n b- vrstni red reakcije za reagente A oziroma B.
Reakcijski vrstni red po reagentuje enak eksponentu, do katerega je treba v kinetični enačbi zapletene reakcije zvišati koncentracijo danega reagenta, tako da je stopnja, izračunana s to enačbo, enaka hitrosti, ugotovljeni eksperimentalno.
Tako je vrstni red reakcije glede na reagent kinetični parameter za določeno reakcijo, skupaj s konstanto hitrosti.
Vrstni red reakcije glede na reagent ni odvisen od stehiometričnih koeficientov v reakcijski enačbi, temveč je določen z njegovim mehanizmom. Če vrednosti vrstnega reda reakcije za vsak reagent sovpadajo s stehiometričnimi koeficienti v kemijski enačbi reakcije, potem to običajno pomeni, da je preučevana reakcija preprosta.
Neskladje med zaporedjem reakcije glede na reagent in njenim stehiometričnim koeficientom v reakcijski enačbi kaže na kompleksnost in večstopenjo te reakcije. Ideja o mehanizmu takšne reakcije se lahko oblikuje, če predpostavimo, da je njena hitrost v glavnem odvisna od stopnje najpočasnejše, torej omejujoče stopnje. V tem primeru kinetična enačba, pridobljena iz eksperimentalnih podatkov, odraža predvsem potek omejevalne faze in ne celotnega postopka.
Razmislite o reakciji termične razgradnje dušikovega oksida (V):
Vendar eksperimentalni podatki kažejo, da hitrost te reakcije ni sorazmerna z drugo, temveč s prvo stopnjo koncentracije dušikovega oksida (V), v resnici pa je njegova kinetična enačba:
To nam omogoča, da predlagamo naslednji reakcijski mehanizem, ki vključuje dve stopnji, ki se močno razlikujeta po hitrosti pretoka:
![]()
Le če je stopnja I stopnje neprimerljivo nižja od stopnje druge stopnje, se bo popolnoma strinjalo s eksperimentalno pridobljenimi kinetičnimi podatki, ki se odražajo v kinetični enačbi, kjer je reakcijski vrstni red glede na N2O5 1.
Slika: 5.2. Določanje vrstnega reda reakcije n Akomponenta A
Za eksperimentalno določitev vrednosti konstante reakcijske hitrosti (k)in vrstni red reakcije glede na reagent A (n A)treba je raziskati odvisnost hitrosti te reakcije od koncentracije reagenta A, pod pogojem, da so koncentracije drugih reagentov v reakcijski zmesi tako visoke, da se med tem poskusom praktično ne spremenijo. Potem bo kinetična enačba preučevane reakcije imela obliko:
Po logaritmu tega izraza dobimo enačbo
ki ima, če je grafično izražen, obliko ravne črte, katere tangenta kota nagiba na os lg c (A) je enaka vrstnemu redu reakcije n A (slika 5.2). Odsek, odrezan s to ravno črto na osi lg y, ko je lg c (A) \u003d 0, da vrednost lg k.Posledično je s takšno obdelavo eksperimentalnih podatkov mogoče določiti vrednosti najpomembnejših kinetičnih parametrov reakcije - vrstni red reakcije glede na reagent in konstanto hitrosti te reakcije.
Kinetične krivulje sprememb koncentracije reagentov za dve zaporedni reakciji, ko sta konstanti hitrosti reakcij k1in k2se med seboj ne razlikujejo veliko, imajo zapleteno obliko (slika 5.3). Kinetična krivulja INustreza monotonemu zmanjšanju koncentracije izhodne snovi A.
Koncentracija intermediata B prehaja skozi maksimum, saj se sprva kopiči in nato izgine. Višina tega največjega Cl; (В) in čas doseganja (tl,) sta lahko zelo različna, odvisno od razmerja med vrednostmi konstant k1in k 2.Krivulja Doznačuje kopičenje reakcijskega produkta D.
Slika: 5.3. Kinetične krivulje sprememb koncentracij komponent A, B in D za navedeno transformacijo
Natančna analiza kinetike tako zapletenih reakcij zahteva reševanje sistema diferencialnih enačb.
Splošna kemija: učbenik / A. V. Zholnin; izd. V. A. Popkova, A. V. Žolnina. - 2012. - 400 str.: Ilustr.
Poglavje 2. OSNOVE KINETIKE KEMIJSKIH REAKCIJ
Poglavje 2. OSNOVE KINETIKE KEMIJSKIH REAKCIJ
Razlika med dihanjem in izgorevanjem je le v hitrosti postopka.
A.-L. Lavoisier
2.1. KEMIJSKA KINETIKA. PREDMET IN OSNOVNI KONCEPTI KEMIJSKE KINETIKE. HITROSTNA REAKCIJA
Smer, globino in temeljno možnost postopka ocenjujemo po obsegu spremembe prosta energija (ΔG ≤0). Vendar ta vrednost ne kaže na resnično možnost nadaljevanja reakcije v teh pogojih.
Na primer, reakcija interakcije dušikovega oksida s kisikom poteka takoj pri sobni temperaturi:
Hkrati je 2H 2 (g) + O 2 (g) \u003d 2H 2 O (l), Δ ° G\u003d -286,8 kJ / mol - reakcija, za katero je značilno bistveno večje zmanjšanje proste energije, interakcija ne poteka v običajnih pogojih, vendar pri 700 ° C ali v prisotnosti katalizatorja postopek poteka takoj. Zato termodinamika ne odgovarja na vprašanje pogojev in hitrosti postopka. To je omejitev termodinamičnega pristopa. Za opis kemijske reakcije je treba poznati tudi vzorce njenega poteka v času, ki jih preučuje kinetika.
Kinetika je kemijska veja, ki preučuje hitrost in mehanizem kemijske reakcije in vpliv različnih dejavnikov nanje.
Glede na to, ali so reakcijske komponente v eni ali več fazah, ločimo kinetiko homogenih in heterogenih reakcij. Glede na mehanizem se reakcije delijo na enostavne in zapletene, zato ločimo kinetiko enostavnih in zapletenih reakcij.
Osnovni koncept reakcijske kinetike je hitrost kemijske reakcije.Določanje hitrosti kemičnih reakcij je biološkega in ekonomskega pomena.
Hitrost kemične reakcije se določi s količino snovi, ki je reagirala na enoto časa na enoto prostornine (v primeru homogenih reakcij, ko so reaktanti v isti fazi) ali na vmesniku enote(v primeru heterogenih reakcij, ko so reaktanti v različnih fazah).
Za hitrost reakcije je značilna sprememba koncentracije katerega koli začetnega ali končnega reakcijskega produkta v odvisnosti od časa. Enačba, ki opisuje odvisnost hitrosti reakcije (v) od koncentracije (od)reaktanti, imenovani kinetična.Hitrost reakcije je pogosteje izražena v mol / l-s, v biokemiji v mg / 100 ml-s ali v masnem deležu v% / 100 ml-s. Ločite med povprečno hitrostjo reakcije v časovnem intervalu in resnično hitrostjo reakcije v določenem trenutku. Če v časovnem intervalu t 1in t 2koncentracija ene od izhodnih snovi ali reakcijskih produktov je enaka 1 oziroma 2, potem je povprečna hitrost reakcije (v) v časovnem intervalu t 1in t 2se lahko izrazi:
Zaradi prihaja v tem primeru zmanjšanje koncentracije izhodne snovi, tj. sprememba koncentracije snovi se v tem primeru upošteva z znakom minus (-). Če se hitrost reakcije oceni s spremembo (povečanjem) koncentracije enega od reakcijskih produktov, potem z znakom plus (+):
Enačba (2.2) določa povprečna hitrostkemijska reakcija. Prava (trenutna) hitrostreakcije se določijo grafično. Sestavite graf odvisnosti koncentracije izhodne snovi ali reakcijskega produkta (Ca) od časa (t) - kinetična krivulja reakcije Ca - f (t)za nelinearni postopek (slika 2.1).
Vsak trenutek (na primer t 1)resnična hitrost reakcije je enaka tangenti naklona tangente na kinetično krivuljo v točki, ki ustreza danemu trenutku v času. V skladu z grafom bomo trenutno hitrost reakcije izračunali po formuli:
V biokemiji se uporablja za opis kinetike encimskih reakcij enačba Michaelis-Menten,ki prikazuje odvisnost hitrosti reakcije, ki jo katalizira encim, od koncentracije substrata in encima. Najpreprostejša kinetična shema, za katero velja Michaelisova enačba: E+ S↔ ES→ E+ P:

Slika: 2.1Kinetična krivulja
kje V m- največja hitrost reakcije; K m - Michaelisova konstanta, enaka koncentraciji substrata, pri kateri je hitrost reakcije polovica največje; S- koncentracija substrata.
Preiskava hitrosti kemijske reakcije daje informacije o njenem mehanizmu. Hitrost reakcije je poleg koncentracije odvisna tudi od narave reagentov, zunanjih pogojev in prisotnosti katalizatorja.
2.2. MOLEKULARNOST IN RED REAKCIJE. OBDOBJE POL-TRANSFORMACIJE
V kinetiki se kemične reakcije razlikujejo glede na molekularnost in vrstni red reakcije. Molekularnost reakcijeje določeno s številom delcev (atomov, molekul ali ionov), ki hkrati sodelujejo v osnovnem kemijskem preoblikovanju. Ena, dve ali tri molekule lahko sodelujejo v osnovnem reakcijskem aktu. Verjetnost trka več delcev je zelo majhna. Na tej podlagi ločijo monomolekularne, bimolekularne in trimolekularne reakcije. Eksperimentalno je mogoče molekularnost reakcije določiti samo za osnovne (enostavne) reakcije, ki potekajo v eni fazi v skladu s stehiometrično enačbo. Večina teh reakcij zahteva visoko aktivacijsko energijo (150-450 kJ / mol).
Večina reakcij je zapletenih. Imenuje se niz osnovnih stopenj, ki sestavljajo zapleteno reakcijo mehanizem reakcije
nosti.Zato je za opredelitev kinetike reakcije uveden koncept vrstni red reakcije,ki je določena s stehiometrično enačbo.
Vsota stehiometričnih parametrov vseh vhodnih snovi, vključenih v reakcijsko enačbo (2.5) (a+ b) določi splošni vrstni red reakcije. Indeks, s katerim dani reagent vstopi v enačbo, se na primer imenuje vrstni red reakcije po snovi (določen vrstni red reakcije). in- vrstni red reakcije za snov A, b- za snov B. Vrstni red reakcije in molekularnost sovpadata samo pri preprostih reakcijah. Vrstni red reakcije določajo tiste snovi, ki vplivajo na hitrost reakcije.
Monomolekularne reakcije vključujejo razgradnjo in izomerizacijo.
Reakcije, katerih enačba hitrosti vključuje koncentracijo enega reaktanta v prvi stopnji, se imenujejo reakcije prvega reda.
Kinetična enačba vključuje snovi, katerih koncentracija se med reakcijo spremeni. Koncentracije snovi v znatnem presežku se med reakcijo ne spremenijo.
Vode pri hidrolizi natrijevega karbonata je v znatnem presežku in ni vključena v kinetično enačbo.
V heterogenih sistemih pride do trčenja delcev na meji, zato masa trdne faze ne vpliva na hitrost reakcije in se zato ne upošteva pri izražanju hitrosti reakcije.
Bimolekularne reakcije vključujejo reakcije dimerizacije in substitucijske reakcije, ki potekajo skozi fazo aktivirani kompleks.
Reakcije, katerih hitrost je sorazmerna zmnožku koncentracij dveh snovi v prvi jakosti ali kvadratu koncentracije ene snovi, se imenujejo reakcije drugega reda.
Trimolekularne reakcije so redke, reakcije štirih molekul pa neznane.
Med biokemijskimi procesi ni mogoče najti reakcij tretjega reda.
Reakcije, katerih hitrost ni odvisna od koncentracije izhodnih snovi, imenujemo reakcije ničelnega reda (v \u003d k).
Primer reakcij ničelnega reda so katalitične reakcije, katerih hitrost je odvisna samo od koncentracije katalizatorja. Encimske reakcije so poseben primer takšnih reakcij.
V biokemijske procese je praviloma vključenih več reagentov (substrat, koencim, kofaktor). Včasih niso znani vsi. Zato se med postopkom presodi ena snov. V tem primeru je kvantitativna značilnost poteka reakcij v času razpolovna doba (čas)reagent - čas, v katerem se količina ali koncentracija izhodne snovi prepolovi (za 50%) ali nastane polovica reakcijskih produktov. Ta metoda je značilna predvsem za razpad radionuklidov, saj njihov razpolovni čas ni odvisen od začetne količine.
Z analizo odvisnosti razpolovnega časa reakcije od začetne koncentracije je mogoče določiti vrstni red reakcije (metoda Ostwald-Noyes). Stalnost razpolovnega časa (pri dani temperaturi) je značilna za številne reakcije razgradnje in na splošno za reakcije prvega reda. Z naraščajočo koncentracijo reagenta se razpolovni čas zmanjša za reakcije drugega reda in poveča za reakcije ničelnega reda.
2.3. HITROST REAKCIJE, NJENA OPREDELITEV. ZAKON VELJAVNIH MAS
Hitrost homogenih reakcij je odvisna od števila srečanj reagirajočih delcev na enoto časa na enoto prostornine. Verjetnost trka medsebojno delujočih delcev je sorazmerna z umnožkom koncentracije reagirajočih snovi. Tako je hitrost reakcije neposredno sorazmerna z zmnožkom koncentracij reaktantov, prevzetih v močeh, enakih stehiometričnim koeficientom ustreznih snovi v reakcijski enačbi. Ta vzorec se imenuje zakon množic(zakon hitrosti kemijske reakcije), ki je
osnovni zakon kemijske kinetike. Zakon o množičnem delovanju so leta 1867 ustanovili norveški znanstveniki K. Guldberg in P. Vahe
Na primer, za reakcijski postopek na splošno v skladu s shemo
veljala bo kinetična enačba:
kje v- hitrost kemijske reakcije; zin z B- koncentracija snovi INin AT[mol / l]; v ain v b- kazalci vrstnega reda po reagentih Ain B; k- konstanta hitrosti kemijske reakcije - koeficient, ki ni odvisen od koncentracije reaktantov.
Konstanta hitrosti kemijske reakcije (k) je hitrost kemijske reakcije v pogojih, ko je zmnožek koncentracij reaktantov 1 mol / l. V tem primeru je v \u003d k.
Na primer, če sta v reakciji H2 (g) + I2 (g) \u003d 2HI (g) c (H2) in c (I2) enaka 1 mol / L ali če je c (H2) 2 mol / l in c (I2) 0,5 mol / L, potem v\u003d k.
Enote konstante ravnotežja določimo z reakcijsko stehiometrijo. Napačno je primerjati konstante hitrosti reakcij različnih vrst med seboj, saj gre za vrednosti, ki so različne po pomenu in imajo različne dimenzije.
2.4. MEHANIZEM KEMIJSKIH REAKCIJ. RAZVRSTITEV KOMPLEKSNIH REAKCIJ
Reakcijski mehanizem upošteva vsa trčenja posameznih delcev, ki se zgodijo sočasno ali zaporedno. Mehanizem daje podrobno stehiometrično sliko vsake faze reakcije, tj. razumevanje mehanizma pomeni določitev molekularnosti vsakega koraka reakcije. Preučevanje mehanizma kemijskih reakcij je zelo težka naloga. Navsezadnje ne moremo neposredno opazovati poteka interakcij molekul. Dobljeni rezultati so včasih odvisni od velikosti in oblike posode. V nekaterih primerih je mogoče iste rezultate razložiti z različnimi mehanizmi.
Upoštevana je bila reakcija plinastega vodika z jodom H2 (g) + I2 (g) \u003d 2HI (g) klasičen primer bimolekularna reakcija drugega
red, toda leta 1967 je N.N. Semenov, G. Eyring in J. Sullivan so pokazali, da ima kompleksen značaj in je sestavljen iz 3 osnovnih reakcij: I 2 \u003d 2I; 2I \u003d I 2; 2I + H2 \u003d 2HI. Čeprav je reakcijo formalno mogoče razvrstiti kot trimolekularno, je njena hitrost opisana s kinetično enačbo, ki spominja na reakcijsko enačbo drugega reda:

Pri zapletenih reakcijah molekularnost in vrstni red reakcije običajno nista enaka. Nenavadno - delno ali negativno - vrstni red reakcije nedvoumno kaže na njen zapleten mehanizem.
Kinetična enačba za oksidacijo ogljikovega monoksida s kisikom 2CO (g) + O2 (g) \u003d CO 2 (g) ima v CO negativni (minus prvi) vrstni red:
s povečanjem koncentracije ogljikovega monoksida se hitrost reakcije zmanjša.
Mehanizem reakcije lahko razdelimo na več vrst.
Zaporedne reakcijeimenujejo se zapletene reakcije, pri katerih produkt (X 1) prve osnovne faze reagira z izdelkom druge stopnje, produkt (X 2) druge stopnje vstopi v tretjo itd., dokler ne nastane končni produkt:

kje S- substrat (začetni reagent); k 1, k 2, k 3 ... - konstanta hitrosti 1, 2 itd. reakcijske faze; P- končni izdelek.
Faze zaporednih reakcij potekajo različno hitro. Stopnja, katere konstanta hitrosti je minimalna, se imenuje omejevalna.Določa kinetični vzorec reakcije kot celote. Snovi, ki nastanejo v vmesnih fazah, se imenujejo vmesni proizvodiali vmesni proizvodi,ki so podlage za nadaljnje stopnje. Če se intermediat počasi oblikuje in hitro razpade, se njegova koncentracija dolgo ne spreminja. Skoraj vsi presnovni procesi so zaporedne reakcije (npr. Presnova glukoze).
Vzporedne reakcijese imenujejo reakcije z enakimi začetnimi reagenti, ki ustrezajo različnim produktom. OD hitrost vzporednih reakcij je enaka vsoti stopenj posameznih reakcij.To pravilo velja tudi za bimolekularne vzporedne kemijske reakcije.
Serijsko vzporedne reakcijese nanaša na reakcije z enakimi začetnimi reagenti, ki lahko reagirajo na dva ali več načinov (mehanizmov), vključno z različnim številom vmesnih stopenj. Ta primer temelji na pojavu kataliza,ko bo vmesna pot ene od poti povečala hitrost drugih poti.
Konkurenčne reakcijeimenujemo zapletene reakcije, pri katerih ista snov INhkrati deluje z enim ali več reagenti B 1, B 2itd., sodeluje pri sočasnih reakcijah: IN+ B 1 → X 1; IN+ B 2 → X 2.Te reakcije tekmujejo med seboj za reagent IN.
Konjugirane reakcijese imenujejo zapletene reakcije, pri katerih ena reakcija poteka samo v prisotnosti druge. V povezanih reakcijah intermediat služi kot vez med primarnim in sekundarnim procesom in določa potek obeh.
Živa celica potrebuje energijo za svoj obstoj. Adenozin trifosforna kislina (ATP) je univerzalni vir energije v živih organizmih. Ta spojina deluje kot akumulator energije, saj ob interakciji z vodo, tj. hidroliza, nastaneta adenozin difosforna (ADP) in fosforna (P) kislina in energija se sprosti. Zato se imenuje ATP makroergična povezava,in poči med njegovo hidrolizo p-O-P komunikacija - makroergična. Makroergična povezavapoklical kemična vez, pri čigar pretrganju se zaradi reakcije hidrolize sprosti pomembna energija:
Kot veste, prekinitev katere koli vezi (tudi makroergične) vedno zahteva porabo energije. V primeru hidrolize ATP poleg postopka prekinitve vezi med fosfatnimi skupinami, za katere je Δ G\u003e 0, potekajo postopki hidracije, izomerizacije in nevtralizacije produktov, ki nastanejo med hidrolizo. Kot rezultat vseh teh procesov ima celotna sprememba Gibbsove energije negativno vrednost
vrednost. Posledično ni pretrganje vezi visokoenergijsko, temveč energijski rezultat njene hidrolize.
Da bi endergonske reakcije (ΔG\u003e 0) potekale v živih sistemih, je nujno, da so povezane z eksergoničnimi reakcijami (ΔG<0). Такое сопряжение возможно, если обе реакции имеют какое-либо общее промежуточное соединение, и на всех стадиях сопряженных реакций суммарный процесс характеризуется отрицательным значением изменения энергии Гиббса (∑ΔG сопр.р <0). Например, синтез сахарозы является эндэргонической реакцией и самопроизвольно происходить не может:
Konjugacija te reakcije z eksergonično reakcijo hidrolize ATP, ki jo spremlja tvorba skupne vmesne spojine glukoza-1-fosfat, vodi k dejstvu, da ima celoten postopek ∑ΔG<0:
Verižne reakcijese imenujejo kemijske in jedrske reakcije, pri katerih pojav aktivnega delca (prosti radikali ali atom v kemijskih, nevtronski v jedrskih procesih) povzroči veliko število (verigo) zaporednih transformacij neaktivnih molekul ali jeder. Verižne reakcije so pogoste v kemiji. Številni fotokemični reakcije, oksidacija (zgorevanje, eksplozija), polimerizacija in razpoke potekajo po verižnem mehanizmu. Teorijo verižnih reakcij je razvil akademik H.H. Semenov, S.N. Hinshelwood (Anglija) in drugi. Glavne stopnje verižnih reakcij so: nukleacija (iniciacija), nadaljevanje (raztezanje) in prekinitev verige (prekinitev). Obstajata dve vrsti verižnih reakcij: ravne in razvejane reakcije. Posebnost verižnih reakcij je, da eno primarno aktivacijsko dejanje vodi do transformacije velikega števila molekul začetnih snovi. Biokemijske reakcije oksidacije prostih radikalov so verižne reakcije.
Periodične (samo nihajoče) reakcijeimenovane zapletene večstopenjske avtokatalitične reakcije, ki vključujejo več snovi, pri katerih periodično nihajo koncentracije oksidiranih in reduciranih oblik. Nihajne reakcije je odkril B.P. Belousov, preiskal A.M. Zhabotinsky in drugi. Pogostost in oblika nihanja sta odvisna od koncentracije začetnih snovi, kislin
nosti, temperatura. Primer takšnih reakcij je lahko interakcija bromolonske kisline s kalijevim bromatom v kislem mediju, katalizator je cerijeva (III) sol. Periodične reakcije so zelo pomembne za biološke predmete, kjer so tovrstne reakcije zelo razširjene.
Reakcije zgorevanja v trdnem stanju(reakcije samorazmnožujoče se visokotemperaturne sinteze, SHS) so odkrili leta 1967 na Inštitutu za kemijsko fiziko Akademije znanosti ZSSR A.G. Merzhanov in I.G. Borovinskaya. Bistvo metode SHS je v tem, da se po lokalnem zagonu reakcije interakcije med reaktanti fronta zgorevalne reakcije spontano razširi po sistemu zaradi prenosa toplote od vročih produktov do začetnih snovi in \u200b\u200bsproži reakcijo interakcije v njih. Tako poteka proces zgorevanja, ki je hkrati vzrok in posledica reakcije. Mehanizem SHS reakcij je precej zapleten in vključuje procese reakcionarna difuzija.Izraz "reaktivna difuzija" opredeljuje sklop pojavov, ki se pojavijo med interakcijo dveh kemično različnih komponent, ki lahko tvorita kemične spojine v obliki trdnih faz. Produkti kemične interakcije tvorijo neprekinjeno plast, ki se po svoji strukturi razlikuje od začetnih komponent, vendar ne moti nadaljnje interakcije.
2.5. TEORIJA AKTIVNEGA VPLIVA. ENERGIJA AKTIVACIJE. ODVISNOST STOPNJE REAKCIJE OD NARAVE REAKCIJSKIH SNOVI IN TEMPERATURE
Da bi lahko prišlo do elementarnega dejanja kemijske interakcije, morajo reakcijski delci trčiti med seboj. Vendar pa vsako trčenje ne povzroči kemijske reakcije. Slednje se zgodi, ko se delci približajo razdaljam, na katerih sta mogoča prerazporeditev elektronske gostote in nastanek novih kemičnih vezi. Vzajemno delujoči delci morajo imeti dovolj energije, da premagajo odbojne sile, ki se pojavijo med njihovimi elektronskimi lupinami.
Prehodno stanje- stanje sistema, v katerem sta uravnoteženi uničenje in ustvarjanje povezave. V prehodnem stanju sistem
je za kratek čas (10 -15 s). Kliče se energija, ki jo je treba porabiti, da sistem pripelje v prehodno stanje aktivacijska energija.V večstopenjskih reakcijah, ki vključujejo več prehodnih stanj, aktivacijska energija ustreza najvišji energijski vrednosti. Po premagovanju prehodnega stanja se molekule spet razpršijo z uničenjem starih vezi in tvorbo novih ali s preoblikovanjem prvotnih vezi. Možni sta obe možnosti, saj se pojavita s sproščanjem energije. Obstajajo snovi, ki lahko zmanjšajo aktivacijsko energijo te reakcije.
V trku se aktivni molekuli A 2 in B 2 združita v vmesni aktivni kompleks A 2 ... B 2 z oslabitvijo in nato prekinitvijo vezi A-A in B-B ter krepitvijo vezi A-B.

"Aktivacijska energija" reakcije tvorbe HI (168 kJ / mol) je veliko manjša od energije, potrebne za popolno cepitev vezi v začetnih molekulah H2 in I2 (571 kJ / mol). Zato pot reakcije skozi izobraževanje aktivni (aktivirani) kompleksenergijsko ugodnejša od poti skozi popolno prekinitev vezi v prvotnih molekulah. Velika večina reakcij poteka s tvorbo vmesno aktivnih kompleksov. Določbe teorije aktivnega kompleksa sta razvila G. Eyring in M. Polyani v tridesetih letih 20. stoletja.
Aktivacijska energijaje presežek kinetične energije delcev glede na povprečno energijo, potrebno za kemično preobrazbo trkajočih delcev. Za reakcije so značilne različne vrednosti aktivacijske energije (E a). V večini primerov se energija aktivacije kemičnih reakcij med nevtralnimi molekulami giblje med 80 in 240 kJ / mol. Za biokemijske procese so vrednosti E a pogosto nižje - do 20 kJ / mol. To je posledica dejstva, da velika večina biokemijskih procesov poteka skozi fazo encimsko-substratnih kompleksov. Energijske ovire omejujejo potek reakcije. Zaradi tega so načeloma možne reakcije (za G<0) практически всегда не протекают
ali upočasnite. Reakcije z aktivacijskimi energijami nad 120 kJ / mol so tako počasne, da je njihov napredek težko opaziti.
Da pride do reakcije, morajo biti molekule med trkom usmerjene na določen način in imeti dovolj energije. Verjetnost pravilne orientacije pri trku je značilna aktivacijska entropijaΔ S a.Prerazporeditvi elektronske gostote v aktivnem kompleksu je naklonjen pogoj, ko sta ob trku molekuli A2 in B2 usmerjeni, kot je prikazano na sl. 2.2, a, medtem ko je z usmeritvijo, prikazano na sl. 2.2, b, je verjetnost reakcije še veliko manjša - na sl. 2.2, c.

Slika: 2.2.Ugodne (a) in neugodne (b, c) usmeritve molekul A 2
in B 2 pri trku
Enačba, ki označuje odvisnost hitrosti in reakcije od temperature, aktivacijske energije in aktivacijske entropije, ima obliko:
kje k- konstanta hitrosti reakcije; A je v prvem približku skupno število trkov med molekulami na enoto časa (sekundo) na enoto prostornine; e - osnova naravnih logaritmov; R- univerzalna plinska konstanta; T- absolutna temperatura; E a- aktivacijska energija; Δ S a- sprememba entropije aktiviranja.
Enačbo (2.8) je leta 1889 izpeljal Arrhenius. Predeksponentni faktor A je sorazmeren s skupnim številom trkov med molekulami na enoto časa. Njegova dimenzija sovpada z dimenzijo konstante hitrosti in je zato odvisna od celotnega reda reakcije. Eksponent je enak deležu aktivnih trkov njihovega skupnega števila, tj. trkajoče molekule morajo imeti dovolj
natančna energija interakcije. Verjetnost njihove želene orientacije v trenutku trka je sorazmerna z e ΔSa / R
Ko smo razpravljali o zakonu efektivnih mas za hitrost (2.6), je bilo posebej določeno, da je konstanta hitrosti konstanta, neodvisna od koncentracij reaktantov. Predpostavljalo se je, da se vse kemične transformacije dogajajo pri konstantni temperaturi. Hkrati je dobro znano, da se lahko hitrost kemijske pretvorbe bistveno spremeni z zniževanjem ali zvišanjem temperature. S stališča zakona masnega delovanja je ta sprememba hitrosti posledica temperaturne odvisnosti konstante hitrosti, saj se koncentracije reaktantov le nekoliko spremenijo zaradi toplotnega raztezanja ali krčenja tekočine.
Najbolj znano dejstvo je povečanje hitrosti reakcij z naraščajočo temperaturo. Ta vrsta temperaturne odvisnosti hitrosti se imenuje normalna (slika 2.3, a). Ta vrsta odvisnosti je značilna za vse preproste reakcije.

Slika: 2.3.Vrste temperaturne odvisnosti hitrosti kemijskih reakcij: a - normalno; b - nenormalno; c - encimska
Trenutno pa so dobro znane kemijske transformacije, katerih hitrost se z naraščanjem temperature zmanjšuje. Primer je reakcija dušikovega (II) oksida v plinasti fazi z bromom (slika 2.3, b). Ta vrsta temperaturne odvisnosti hitrosti se imenuje nepravilna.
Za zdravnike je še posebej zanimiva temperaturna odvisnost hitrosti encimskih reakcij, tj. reakcije, ki vključujejo encime. Skoraj vse reakcije, ki se pojavijo v telesu, spadajo v ta razred. Na primer, pri razgradnji vodikovega peroksida v prisotnosti encima katalaze je hitrost razgradnje odvisna od temperature. V območju 273-320 ° K je temperaturna odvisnost normalna. S povečanjem temperature se hitrost poveča, z zmanjšanjem pa se zmanjša. Ko se temperatura dvigne nad
Pri 320 ° K opazimo močan nenormalen padec hitrosti razgradnje peroksida. Podobna slika je tudi pri drugih encimskih reakcijah (slika 2.3, c).
Iz Arrheniusove enačbe za kse vidi, da od Tvključena v eksponent, je hitrost kemijske reakcije zelo občutljiva na temperaturne spremembe. Odvisnost hitrosti homogene reakcije od temperature lahko izrazimo z Van't Hoffovim pravilom, po katerem s povečanjem temperature za vsakih 10 ° se hitrost reakcije poveča za 2-4 krat;imenuje se število, ki kaže, kolikokrat se hitrost te reakcije poveča s povišanjem temperature za 10 ° temperaturni koeficient reakcijske hitrosti- γ.
kje k- konstanta hitrosti pri temperaturi t° C. Če poznamo vrednost γ, je mogoče izračunati spremembo hitrosti reakcije, ko se temperatura spremeni iz T 1prej T 2po formuli:
Ko temperatura narašča v aritmetičnem napredovanju, se hitrost povečuje v geometrijskem zaporedju.
Na primer, če je γ \u003d 2,9, potem s povečanjem temperature za 100 ° hitrost reakcije naraste 2,9 10-krat, t.j. 40 tisočkrat. Odstopanje od tega pravila so biokemične reakcije, katerih hitrost se z rahlim zvišanjem temperature desetkrat poveča. To pravilo velja le v grobem približku. Za reakcije, ki vključujejo velike molekule (beljakovine), je značilen velik temperaturni koeficient. Hitrost denaturacije beljakovin (jajčni albumin) se poveča 50-krat, ko temperatura naraste za 10 ° C. Po doseganju določenega maksimuma (50–60 ° C) se hitrost reakcije močno zmanjša zaradi termodenaturacije beljakovin.
Za mnoge kemijske reakcije zakon masnega delovanja hitrosti ni znan. V takih primerih lahko izraz uporabimo za opis temperaturne odvisnosti stopnje pretvorbe:
Predeksponent In sni odvisno od temperature, ampak od koncentracije. Enota je mol / L s.
Teoretična odvisnost omogoča vnaprej izračunano hitrost pri kateri koli temperaturi, če sta znani aktivacijska energija in predeksponent. Tako je napovedan vpliv temperature na hitrost kemične preobrazbe.
2.6. OBRATLJIVE IN OBRATLJIVE REAKCIJE. STANJE KEMIJSKEGA BILANCA. REAKCIJSKA ENOTA ISOTHERM
Kemična reakcija ne pride vedno do konca, z drugimi besedami, vhodne snovi niso vedno popolnoma pretvorjene v reakcijske produkte. Ko se reakcijski produkti kopičijo, se lahko ustvarijo pogoji, da reakcija poteka v nasprotni smeri. Če na primer zmešate jodno paro z vodikom pri temperaturi ~ 200 ° C, potem pride do reakcije: H2 + I2 \u003d 2HI. Znano pa je, da se vodikov jodid že segret na 180 ° С začne razpadati v jod in vodik: 2HI \u003d Н 2 + I 2.
Imenujejo se kemijske reakcije, ki lahko v enakih pogojih gredo v nasprotni smeri reverzibilna.Pri zapisovanju enačb reverzibilnih reakcij namesto enačbe postavimo dve nasprotno usmerjeni puščici. Kliče se reakcija, ki teče od leve proti desni naravnost(konstanta hitrosti naprej reakcije k 1),od desne proti levi - vzvratno(konstanta hitrosti reakcije k 2).
Pri reverzibilnih reakcijah ima hitrost neposredne reakcije sprva največjo vrednost, nato pa se zmanjša zaradi zmanjšanja koncentracije izhodnih snovi. Nasprotno pa ima povratna reakcija v začetnem trenutku minimalno hitrost, ki se poveča, ko se koncentracija reakcijskih produktov poveča. Končno pride trenutek, ko se stopnje reakcij naprej in nazaj izenačijo. Pokliče se stanje, v katerem hitrost povratne reakcije postane enaka hitrosti naprej reakcije kemijsko ravnovesje.
Kvantitativno je opredeljeno stanje kemičnega ravnovesja reverzibilnih procesov ravnotežna konstanta.V trenutku doseganja stanja kemičnega ravnovesja sta hitrosti neposredne in povratne reakcije enake (kinetično stanje).
kjer K - ravnotežna konstanta,kar je razmerje med hitrostnimi konstantami reakcij naprej in nazaj.
Desna stran enačbe vsebuje tiste koncentracije medsebojno delujočih snovi, ki so določene v ravnovesju - ravnotežne koncentracije.Ta enačba je matematični izraz zakona o masnem delovanju v kemijskem ravnovesju. Posebej je treba opozoriti, da so v nasprotju z zakonom masnega delovanja za hitrost reakcije v tej enačbi eksponenti a, b, d, f initd. so vedno enaki stehiometričnim koeficientom v ravnotežni reakciji.
Številčna vrednost ravnotežne konstante dane reakcije določa njen izkoristek. Donos reakcijese nanaša na razmerje med količino dejansko pridobljenega produkta in količino, ki bi jo dobili, če bi se reakcija nadaljevala do konca (običajno izraženo v odstotkih). Torej, pri K \u003e\u003e 1 je reakcijski izkoristek visok in obratno pri K<<1 выход реакции очень мал.
Konstanta ravnotežja je povezana z standardna Gibbsova energijareakcije po naslednjem razmerju:
Z uporabo enačbe (2.12) lahko poiščemo vrednost Gibbsove energije reakcije glede na ravnotežne koncentracije:

Ta enačba se imenuje enačba izoterme kemijske reakcije.Omogoča vam izračun spremembe Gibbsove energije med postopkom in določitev smeri reakcije:
pri ΔG<0 - реакция идет в прямом направлении, слева направо;
Kdaj ΔG \u003d 0 - reakcija je dosegla ravnotežje (termodinamično stanje);
ko je ΔG\u003e 0, gre reakcija v nasprotno smer.
Pomembno je razumeti, da ravnotežna konstanta ni odvisna od koncentracije snovi. Res je obratno: v ravnotežnem stanju koncentracije same prevzamejo take vrednosti, da razmerje njihovih produktov v močeh stehiometričnih koeficientov
izkaže se konstantna pri dani temperaturi. Ta izjava je v skladu z zakonom o množičnem delovanju in jo je mogoče celo uporabiti kot eno od njegovih formulacij.
Kot smo že omenili, reverzibilne reakcije ne gredo do konca. Če pa eden od produktov reverzibilne reakcije zapusti sfero reakcije, se v bistvu reverzibilni postopek nadaljuje praktično do konca. Če so elektroliti vključeni v reverzibilno reakcijo in je eden od produktov te reakcije šibek elektrolit, oborina ali plin, potem tudi v tem primeru reakcija poteka skoraj do konca. Nepovratne reakcijeimenujejo se takšne reakcije, katerih produkti med seboj ne vplivajo na tvorbo vhodnih snovi. Nepovratne reakcije praviloma "dosežejo konec", tj. E. dokler se vsaj en vhodni material popolnoma ne porabi.
2.7. NAČELO LE CHATELIER
Stanje kemijskega ravnovesja v stalnih zunanjih pogojih lahko teoretično traja neomejeno dolgo. V resnici, ko se temperatura, tlak ali koncentracija reaktantov spremeni, se lahko ravnotežje "premakne" v eno ali drugo smer procesa.
Spremembe, ki se v sistemu pojavijo zaradi zunanjih vplivov, določa načelo mobilnega ravnotežja - načelo Le Chatelierja.
Zunanji vpliv na sistem v stanju ravnotežja vodi do premika tega ravnotežja v smer, v kateri je učinek učinka, ki ga povzroči, oslabljen.
Glede na tri glavne vrste zunanjih vplivov - spremembe koncentracije, tlaka in temperature - se Le Chatelierjevo načelo razlaga takole.
S povečanjem koncentracije ene od reagirajočih snovi se ravnotežje premakne k porabi te snovi, z zmanjšanjem koncentracije pa se ravnotežje premakne k nastanku te snovi.
Vpliv tlaka je zelo podoben učinku spreminjanja koncentracij reaktantov, vendar vpliva le na plinske sisteme. Oblikujmo splošno trditev o vplivu tlaka na kemijsko ravnovesje.
S povečanjem tlaka se ravnotežje premakne v smeri zmanjšanja količine plinastih snovi, tj. v smeri padajočega tlaka; z znižanjem tlaka se ravnotežje premakne proti povečanju
količine plinastih snovi, tj. v smeri naraščajočega tlaka. Če reakcija poteka brez spreminjanja števila molekul plinastih snovi, tlak ne vpliva na položaj ravnotežja v tem sistemu.
S spremembo temperature se tako neposredne kot povratne reakcije spreminjajo, vendar v različnih stopnjah. Zato je za razjasnitev vpliva temperature na kemijsko ravnovesje treba poznati znak toplotnega učinka reakcije.
Ko se temperatura dvigne, se ravnotežje premakne proti endotermni reakciji, in ko temperatura pada, k eksotermni reakciji.
Kot velja za biosisteme, načelo Le Chatelierja pravi, da se v biosistemu za vsako delovanje, enako po moči in naravi, oblikuje reakcija, ki uravnoteži biološke regulativne procese in reakcije in tvori konjugirano raven njihovega neravnovesja.
V patoloških procesih je kršena obstoječa zaprtost regulacijskega kroga. Glede na stopnjo neravnovesja se kakovost medsistemskih in medorganskih odnosov spreminja, postajajo vedno bolj nelinearni. Strukturo in specifičnost teh razmerij potrjuje analiza razmerja med indikatorji sistema lipidne peroksidacije in nivojem antioksidantov med harmonskimi kazalniki v pogojih prilagoditve in patologije. Ti sistemi sodelujejo pri vzdrževanju antioksidativne homeostaze.
2.8. VPRAŠANJA IN NALOGE ZA PRIPRAVO SAMO PREVERJANJA ZA VADBE IN PREGLEDE
1. Katere reakcije imenujemo homogene in katere heterogene? Navedite en primer vsake vrste reakcije.
2. Katere reakcije imenujemo enostavne in katere zapletene? Navedite dva primera preprostih in zapletenih reakcij.
3. V katerem primeru se lahko molekularnost in vrstni red kinetične enačbe numerično ujemata?
4. Hitrost neke reakcije se s časom ne spremeni. Se bo razpolovni čas te reakcije sčasoma spremenil in če se, kako? Daj pojasnilo.
5. V katerem primeru lahko sovpadata resnična (trenutna) hitrost in povprečna hitrost reakcije (v dovolj dolgem časovnem intervalu)?
6. Izračunajte konstanto hitrosti reakcije A + B → AB, če je pri koncentracijah snovi A in B enaka 0,5 oziroma 0,1 mol / l, njena hitrost je 0,005 mol / l min.
7. Razpolovni čas neke reakcije prvega reda je 30 minut. Kateri del prvotne količine snovi bo ostal v eni uri?
8. Dati koncept splošnega reda reakcije in vrstnega reda reakcij po snovi.
9. Metode za določanje hitrosti reakcije.
10. Osnovni zakon kemijske kinetike.
11. Navedite koncept mehanizma kemijskih reakcij.
12. Preproste in zapletene reakcije.
13. Konjugirane reakcije. Od katerih dejavnikov je odvisna konstanta hitrosti kemičnih reakcij?
14. Ali je hitrost reakcije res sorazmerna zmnožku koncentracij reaktantov na moč njihovih stehiometričnih koeficientov?
15. Kateri eksperimentalni podatki so potrebni za določitev vrstnega reda reakcij?
16. Napiši kinetično enačbo reakcije H 2 O 2 + 2HI → I 2 + + 2H 2 O, če se pomešata enaki količini 0,02 mol / L raztopine H 2 O 2 in 0,05 mol / L raztopine HI. Konstanta hitrosti 0,05 L / mol s.
17. Zapišite kinetično enačbo reakcije H 2 O 2 + 2HI → I 2 + + 2H 2 O, pri čemer upoštevajte, da je zanjo značilen prvi vrstni red reakcije glede na koncentracijo obeh izhodnih snovi.
18. Dokažite, da je hitrost kemijske reakcije največja pri stehiometričnem razmerju komponent.
19. Naštejte možne razlage vpliva temperature na hitrost reakcije.
2.9. PRESKUSNI PROBLEMI
1. V skladu z Van't Hoffovim pravilom, ko se temperatura dvigne za 10 °, stopnja številnih reakcij:
a) zmanjša se 2-4 krat;
b) zmanjša se 5-10 krat;
c) poveča se za 2-4 krat;
d) se poveča za 5-10 krat.
2. Število osnovnih aktov interakcije v enoti časa določa:
a) vrstni red reakcije;
b) hitrost reakcije;
c) molekularnost reakcije;
d) razpolovna doba.
3. Kateri dejavniki vplivajo na povečanje hitrosti reakcije?
a) naravo reagirajočih snovi;
b) temperatura, koncentracija, katalizator;
c) samo katalizator;
d) samo koncentracija;
e) samo temperatura.
4. Kolikokrat se bo povečala hitrost reakcije 2A (g) + B (g)?→ A 2 B (d) z dvakratnim povečanjem koncentracije snovi A?
a) hitrost se ne bo spremenila;
b) se bo povečala 18-krat;
c) se bo povečala za 8-krat;
d) se bo povečala za 4-krat;
e) se bo povečala 2-krat.
5. Elementarna reakcija А (tv) + 2В (g)→ AB 2 (d). Navedite pravilno kinetično enačbo za to reakcijo:
a) k [A] [B] 2;
b) k [A] [B];
c) do [B];
d) do [B] 2;
e) do [A].
6. Kako spremeniti tlak v sistemu za povečanje reakcijske hitrosti A (tv) + 2B (g)→ AB 2 (d) 9-krat?
a) tlak zvišajte 9-krat;
b) zmanjšajte tlak za 9-krat;
c) povečati tlak za 3-krat;
d) tlak zmanjšajte za 3-krat.
7. Kolikšen je temperaturni koeficient reakcijeγ 10 , če se pri ohlajanju reakcijske zmesi za 30 ° hitrost reakcije zmanjša za 8-krat?
a) 16;
b) 8;
ob 6;
d) 4;
d 2.
8. Katera reakcija gre hitreje?
in) E deluje\u003d 40 kJ / mol;
b) Ekt \u003d 80 kJ / mol;
ob) Ekt \u003d 160 kJ / mol;
d) Ekt \u003d 200 kJ / mol.