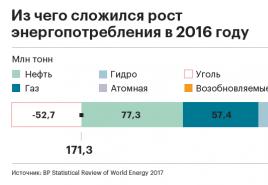
Termodinamični potenciali. Metoda termodinamičnih potencialov
Vsi izračuni v termodinamiki temeljijo na uporabi funkcij stanja, imenovanih termodinamični potenciali. Vsak niz neodvisnih parametrov ima svoj lasten termodinamični potencial. Spremembe potencialov, ki se pojavijo med katerim koli procesom, določajo delo, ki ga opravi sistola, ali toploto, ki jo prejme sistem.
Pri obravnavi termodinamičnih potencialov bomo uporabili zvezo (103.22), ki jo predstavimo v obliki
Enakost se nanaša na reverzibilne procese, znak neenakosti - na nepovratne procese.
Termodinamični potenciali so funkcije stanja. Zato je prirastek katerega koli od potencialov enak celotnemu diferencialu funkcije, s katero je izražen. Celotni diferencial funkcije spremenljivk in y je določen z izrazom
![]()
Če torej med transformacijami dobimo izraz oblike za prirastek določene vrednosti
lahko trdimo, da je ta količina funkcija parametrov, funkcije pa so delni odvodi funkcije
Notranja energija. Enega izmed termodinamičnih potencialov že poznamo. To je notranja energija sistema. Prvi zakonski izraz za reverzibilni proces lahko predstavimo kot
![]() (109.4)
(109.4)
Primerjava z (109.2) pokaže, da spremenljivki S in V delujeta kot ti naravni spremenljivki za potencial V. Iz (109.3) sledi, da
![]()
Iz razmerja sledi, da je v primeru, ko telo ne izmenjuje toplote z zunanjim okoljem, delo, ki ga opravi, enako
![]()
ali v integralni obliki:
Tako je v odsotnosti izmenjave toplote z zunanjim okoljem delo enako zmanjšanju notranje energije telesa.
Pri konstantni glasnosti
Zato je - toplotna kapaciteta pri stalni prostornini enaka
![]() (109.8)
(109.8)
Brezplačna energija. V skladu z (109.4) lahko delo, ki ga opravi toplota v reverzibilnem izotermnem procesu, predstavimo kot
Državna funkcija
![]() (109.10)
(109.10)
imenujemo prosta energija telesa.
V skladu s formulama "(109.9) in (109.10) v reverzibilnem izotermnem procesu je delo enako zmanjšanju proste energije telesa:
![]()
Primerjava s formulo (109.6) pokaže, da ima v izotermičnih procesih prosta energija enako vlogo kot notranja energija v adiabatskih procesih.
Upoštevajte, da formula (109.6) velja tako za reverzibilne kot ireverzibilne procese. Formula (109.12) velja samo za reverzibilne procese. Z ireverzibilnimi procesi (glej). Če zamenjamo to neenakost v relacijo, lahko dobimo, da za ireverzibilne izotermne procese
Zato izguba proste energije določa zgornjo mejo količine dela, ki ga sistem lahko opravi v izotermnem procesu.
Vzemimo diferencial funkcije (109.10). Ob upoštevanju (109.4) dobimo:
Iz primerjave z (109.2) sklepamo, da sta naravni spremenljivki za prosto energijo T in V. V skladu z (109.3)
Zamenjajmo: v (109.1) dQ skozi in dobljeno relacijo delimo z ( - čas). Kot rezultat dobimo
![]()
Če temperatura in prostornina ostaneta konstantni, lahko razmerje (109.16) pretvorimo v obliko
Iz te formule izhaja, da nepovraten proces, ki poteka pri stalni temperaturi in prostornini, spremlja zmanjšanje proste energije telesa. Ko je doseženo ravnotežje, se F s časom neha spreminjati. V to smer; pri konstantnih T in V je ravnotežno stanje stanje, za katerega je prosta energija minimalna.
Entalpija. Če proces "poteka pri konstantnem tlaku, potem lahko količino toplote, ki jo telo prejme, predstavimo na naslednji način:
Državna funkcija
![]()
imenujemo entalpija ali toplotna funkcija.
Iz (109.18) in (109.19) sledi, da je količina toplote, ki jo telo prejme med izobatskim procesom, enaka
ali v integralni obliki
![]()
Zato je v primeru, ko tlak ostane konstanten, količina toplote, ki jo telo prejme, enaka prirastku entalpije. Diferenciranje izraza (109.19) glede na (109.4) da
Od tu sklepamo. entalpija je termodinamični potencial v spremenljivkah, njeni parcialni odvodi pa so
1. Skupina potencialov “E F G H” z dimenzijo energije.
2. Odvisnost termodinamičnih potencialov od števila delcev. Entropija kot termodinamični potencial.
3. Termodinamični potenciali večkomponentnih sistemov.
4. Praktična izvedba metode termodinamičnih potencialov (na primeru problema kemijskega ravnovesja).
Ena glavnih metod sodobne termodinamike je metoda termodinamičnih potencialov. Ta metoda je nastala predvsem zaradi uporabe potencialov v klasična mehanika, kjer je bila njegova sprememba povezana z opravljenim delom, sam potencial pa je energetska značilnost termodinamičnega sistema. Zgodovinsko gledano so prvotno uvedeni termodinamični potenciali imeli tudi razsežnost energije, kar je določilo njihovo ime.
V omenjeno skupino sodijo naslednji sistemi:
Notranja energija;
Brezplačna energija ali Helmholtzov potencial;
Gibbsov termodinamični potencial;
Entalpija.
Potencial notranje energije je bil prikazan v prejšnji temi. Nakazuje potencialnost preostalih količin.
Razlike termodinamičnih potencialov imajo obliko:
Iz razmerij (3.1) je razvidno, da ustrezni termodinamični potenciali označujejo isti termodinamični sistem z različnimi metodami .... opisi (metode nastavitve stanja termodinamičnega sistema). Torej je za adiabatno izoliran sistem, opisan v spremenljivkah, primerno uporabiti notranjo energijo kot termodinamični potencial.Takrat so parametri sistema, termodinamično konjugirani s potenciali, določeni iz razmerij:
Če kot opisno metodo uporabimo "sistem v termostatu", ki ga podajajo spremenljivke, je najbolj priročno uporabiti prosto energijo kot potencial. V skladu s tem za sistemske parametre dobimo:
Nato bomo kot način opisa izbrali model »sistem pod batom«. V teh primerih funkcije stanja tvorijo množico (), kot termodinamični potencial pa se uporabi Gibbsov potencial G. Nato se sistemski parametri določijo iz izrazov:
In v primeru "adiabatnega sistema nad batom", ki ga določajo funkcije stanja, vlogo termodinamičnega potenciala igra entalpija H. Potem imajo parametri sistema obliko:
Ker relacije (3.1) določajo skupne diferenciale termodinamičnih potencialov, lahko enačimo njihove druge odvode.
Na primer glede na to

dobimo
Podobno za preostale parametre sistema, povezane s termodinamičnim potencialom, zapišemo:
Podobne identitete lahko zapišemo tudi za druge nize parametrov termodinamičnega stanja sistema na podlagi potenciala ustreznih termodinamičnih funkcij.
Torej, za "sistem v termostatu" s potencialom imamo:
Za sistem "nad batom" z Gibbsovim potencialom bodo veljale enakosti:
In končno, za sistem z adiabatnim batom s potencialom H dobimo:
Enakosti oblike (3.6) - (3.9) se imenujejo termodinamične identitete in se v številnih primerih izkažejo za priročne za praktične izračune.
Z uporabo termodinamičnih potencialov je precej enostavno določiti delovanje sistema in toplotni učinek.
Relacije (3.1) torej pomenijo:
Iz prvega dela enakosti izhaja dobro znana določba, da se delo toplotno izoliranega sistema () izvaja zaradi zmanjšanja njegove notranje energije. Druga enakost pomeni, da je prosta energija tisti del notranje energije, ki se v izotermnem procesu popolnoma spremeni v delo (oziroma "preostali" del notranje energije včasih imenujemo vezana energija).
Količina toplote je lahko predstavljena kot:
Iz zadnje enakosti je jasno, zakaj entalpijo imenujemo tudi toplotna vsebnost. Med zgorevanjem in drugimi kemičnimi reakcijami, ki potekajo pri konstantnem tlaku (), je količina sproščene toplote enaka spremembi entalpije.
Izraz (3.11), ob upoštevanju drugega zakona termodinamike (2.7), nam omogoča določitev toplotne kapacitete:


Vsi termodinamični potenciali energijskega tipa imajo lastnost aditivnosti. Zato lahko zapišemo:
Preprosto je videti, da Gibbsov potencial vsebuje samo en aditivni parameter, tj. Gibbsov specifični potencial ni odvisen od. Potem iz (3.4) sledi:
To pomeni, da je kemični potencial specifičen Gibbsov potencial in enakost se zgodi
Termodinamični potenciali (3.1) so med seboj povezani z neposrednimi razmerji, ki omogočajo prehod iz enega potenciala v drugega. Na primer, izrazimo vse termodinamične potenciale z notranjo energijo.
Pri tem smo dobili vse termodinamične potenciale kot funkcije (). Če jih želite izraziti v drugih spremenljivkah, uporabite postopek re….
Naj bo tlak podan v spremenljivkah ():
Zapišimo zadnji izraz kot enačbo stanja, tj. poiščite obrazec
Zlahka je videti, da če je stanje podano v spremenljivkah (), potem je termodinamični potencial notranja energija. Na podlagi (3.2) najdemo
Ob upoštevanju (3.18) kot enačbe za S najdemo njeno rešitev:
Če nadomestimo (3.19) v (3.17), dobimo
To pomeni, da smo iz spremenljivk () prešli na spremenljivke ().
Druga skupina termodinamičnih potencialov nastane, če poleg zgoraj obravnavanih kot termodinamične spremenljivke vključimo še kemični potencial. Tudi potenciali druge skupine imajo razsežnost energije in jih lahko s potenciali prve skupine povežemo z razmerji:
V skladu s tem imajo potencialne razlike (3.21) obliko:
Tako kot za termodinamične potenciale prve skupine lahko tudi za potenciale (3.21) konstruiramo termodinamične identitete, najdemo izraze za parametre termodinamičnega sistema ipd.
Oglejmo si značilne relacije za »omega potencial«, ki izraža kvaziprosto energijo in se v praksi najpogosteje uporablja med ostalimi potenciali skupine (3.22).
Potencial je podan v spremenljivkah (), ki opisujejo termodinamični sistem z namišljenimi stenami. Parametri sistema so v tem primeru določeni iz razmerij:
Termodinamične identitete, ki izhajajo iz potencialnosti, imajo obliko:
Zelo zanimive so aditivne lastnosti termodinamičnih potencialov druge skupine. Ker v tem primeru število delcev ni med parametri sistema, se volumen uporablja kot aditivni parameter. Potem za potencial dobimo:
Tukaj - specifični potencial na 1. Ob upoštevanju (3.23) dobimo:
V skladu s tem (3.26)
Veljavnost (3.26) lahko dokažemo tudi na podlagi (3.15):
Potencial se lahko uporabi tudi za pretvorbo termodinamičnih funkcij, zapisanih v obliki, v obliko. Za to razmerje (3.23) za N:
dovoljeno glede:
Kot termodinamični potenciali lahko delujejo ne samo energijske značilnosti sistema, ampak tudi vse druge količine, vključene v razmerje (3.1). Kot pomemben primer obravnavajte entropijo kot termodinamični potencial. Začetno diferencialno razmerje za entropijo sledi iz splošnega zapisa I. in II. principa termodinamike:
Tako je entropija termodinamični potencial za sistem, ki ga določajo parametri. Drugi sistemski parametri izgledajo takole:
Z razrešitvijo prve izmed relacij (3.28) je prehod od spremenljivk k spremenljivkam relativno možen.
Aditivne lastnosti entropije vodijo do znanih odnosov:
Pojdimo k določanju termodinamičnih potencialov na podlagi danih makroskopskih stanj termodinamičnega sistema. Za poenostavitev izračunov predpostavimo odsotnost zunanjih polj (). To ne zmanjša splošnosti rezultatov, saj se dodatni sistemi preprosto pojavijo v dobljenih izrazih za .
Kot primer poiščimo izraze za prosto energijo z uporabo enačbe stanja, kalorične enačbe stanja in obnašanja sistema pri kot začetnih. Ob upoštevanju (3.3) in (3.12) ugotovimo:
Integrirajmo drugo enačbo sistema (3.30) ob upoštevanju robnega pogoja pri:




Nato ima sistem (3.30) obliko:

Rešitev sistema (3.31) omogoča iskanje specifične proste energije v obliki
Izvor specifične proste energije je mogoče najti tudi iz pogojev na:
Potem ima (3.32) obliko:
in izraz za celotno prosto energijo sistema, do aditivne konstante, ima obliko:
Takrat je reakcija sistema na vključitev zunanjega polja podana z dodatno enačbo stanja, ki ima glede na nabor spremenljivk stanja obliko:
Nato se sprememba ustreznega termodinamičnega potenciala, povezana z vključitvijo ničle od nič do določi iz izrazov:
Tako je nastavitev termodinamičnega potenciala v makroskopski teoriji možna le na podlagi uporabe podanih enačb termodinamičnega stanja, ki pa so same pridobljene na podlagi nastavitev termodinamičnih potencialov. Ta »začarani krog« je mogoče prekiniti le na podlagi mikroskopske teorije, v kateri je stanje sistema postavljeno na podlagi porazdelitvenih funkcij ob upoštevanju statističnih značilnosti.
Dobljene rezultate posplošimo na primer večkomponentnih sistemov. Ta posplošitev se izvede z zamenjavo parametra z nizom. Oglejmo si konkretne primere.
Predpostavimo, da je termodinamično stanje sistema podano s parametri, tj. obravnavamo sistem v termostatu, sestavljen iz več komponent, v katerih je število delcev enako Prosta energija, ki je v tem opisu termodinamični potencial, ima obliko:
Aditivni parameter v (3.37) ni število delcev, temveč prostornina sistema V. Tedaj je gostota sistema označena z . Funkcija je neaditivna funkcija neaditivnih argumentov. To je zelo priročno, saj ko je sistem razdeljen na dele, se funkcija ne spremeni za vsak del.
Potem lahko za parametre termodinamičnega sistema zapišemo:
Glede na to, da imamo
Za kemijski potencial posamezne komponente zapišemo:
Obstajajo tudi drugi načini za upoštevanje aditivnih lastnosti proste energije. Predstavimo relativne gostote števila delcev vsake od komponent:

neodvisno od prostornine sistema V. Tukaj je skupno število delcev v sistemu. Potem
Izraz za kemični potencial ima v tem primeru bolj zapleteno obliko:
Izračunajte odpeljanke in in jih nadomestite v zadnji izraz:
Nasprotno pa bo izraz za pritisk poenostavljen:
Podobne relacije lahko dobimo tudi za Gibbsov potencial. Torej, če je prostornina podana kot aditivni parameter, potem ob upoštevanju (3.37) in (3.38) zapišemo:
isti izraz lahko dobimo iz (3.yu), ki ima v primeru številnih delcev obliko:
Če nadomestimo izraz (3.39) v (3.45), ugotovimo:
kar popolnoma sovpada z (3.44).
Za preklop na tradicionalno snemanje Gibbsovega potenciala (prek spremenljivk stanja ()) je treba rešiti enačbo (3.38):
Glede volumna V in nadomestite rezultat v (3.44) ali (3.45):
Če je skupno število delcev v sistemu N podano kot aditivni parameter, ima Gibbsov potencial ob upoštevanju (3.42) naslednjo obliko:

Če poznamo vrsto določenih vrednosti: , dobimo:

V zadnjem izrazu je seštevek končan j zamenjati s seštevanjem čez jaz. Potem je seštevek drugega in tretjega člena enak nič. Potem za Gibbsov potencial končno dobimo:
Enako zvezo lahko dobimo tudi na drug način (iz (3.41) in (3.43)):
Nato za kemijski potencial vsake od komponent dobimo:
Pri izpeljavi (3.48) so bile transformacije, podobne tistim, uporabljenim pri izpeljavi (3.42), izvedene z uporabo namišljenih sten. Parametri stanja sistema tvorijo niz ().
Vlogo termodinamičnega potenciala ima potencial, ki ima obliko:
Kot je razvidno iz (3.49), je edini aditivni parameter v tem primeru prostornina sistema V.
Določimo nekaj termodinamičnih parametrov takega sistema. Število delcev v tem primeru določimo iz razmerja:
Za brezplačno energijo F in Gibbsov potencial G se lahko napiše:
Tako so razmerja za termodinamične potenciale in parametre v primeru večkomponentnih sistemov spremenjena samo zaradi potrebe po upoštevanju števila delcev (ali kemijskih potencialov) vsake komponente. Hkrati ostaja sama ideja metode termodinamičnih potencialov in izračunov, ki temeljijo na njej, nespremenjena.
Kot primer uporabe metode termodinamičnih potencialov razmislite o problemu kemijskega ravnovesja. Poiščimo pogoje kemijskega ravnovesja v mešanici treh snovi, ki vstopijo v reakcijo. Dodatno predpostavimo, da so začetni produkti reakcije redčeni plini (to nam omogoča, da zanemarimo medmolekularno medsebojno produkcijo), v sistemu pa se vzdržujeta konstantna temperatura in tlak (ta proces je v praksi najlažje izvesti, zato je pogoj konstantnega tlaka in temperatura se ustvari v industrijskih obratih za kemično reakcijo).
Stanje ravnovesja termodinamičnega sistema, odvisno od načina opisa, je določeno z največjo entropijo sistema ali minimalno energijo sistema (za več podrobnosti glej Bazarov Thermodynamics). Potem lahko dobimo naslednje ravnotežne pogoje za sistem:
1. Za stanje ravnotežja adiabatno izoliranega termodinamičnega sistema, podanega s parametri (), je značilna največja entropija:
Drugi izraz v (3.53a) označuje stabilnost ravnotežnega stanja.
2. Za stanje ravnotežja izohorno-izotermnega sistema, podanega s parametri (), je značilna minimalna prosta energija. Ravnotežni pogoj ima v tem primeru obliko:
3. Za ravnotežje izobarično-izotermnega sistema, podanega s parametri (), so značilni pogoji:
4. Za sistem v termostatu s spremenljivim številom delcev, ki ga določajo parametri (), so za ravnotežne pogoje značilni potencialni minimumi:
Obrnemo se na uporabo kemijskega ravnovesja v našem primeru.
V splošnem primeru je enačba kemijske reakcije zapisana kot:
Tukaj - simboli kemikalij - tako imenovane stehiometrične številke. Torej za reakcijo
Ker sta tlak in temperatura izbrana kot parametra sistema, za katera se predpostavlja, da sta konstantna. Gibbsov potencial je primerno obravnavati kot stanje termodinamičnega potenciala G. Potem bo pogoj ravnotežja za sistem sestavljen iz zahteve po konstantnosti potenciala G:
Ker razmišljamo o trikomponentnem sistemu, smo postavili Poleg tega lahko ob upoštevanju (3.54) zapišemo enačbo bilance za število delcev ():
Če predstavimo kemijske potenciale za vsako od komponent: in ob upoštevanju postavljenih predpostavk ugotovimo:
Enačbo (3.57) je prvi dobil Gibbs leta 1876. in je želena enačba kemijskega ravnotežja. Če primerjamo (3.57) in (3.54), lahko vidimo, da enačbo kemijskega ravnovesja dobimo iz enačbe kemijske reakcije tako, da preprosto zamenjamo simbole reagirajočih snovi z njihovimi kemijskimi potenciali. To tehniko lahko uporabimo tudi pri pisanju enačbe kemijskega ravnotežja za poljubno reakcijo.
V splošnem primeru je rešitev enačbe (3.57) tudi za tri komponente dovolj obremenjena. Prvič, to je posledica dejstva, da je zelo težko dobiti eksplicitne izraze za kemični potencial tudi za enokomponentni sistem. Drugič, relativne koncentracije in niso majhne količine. To pomeni, da na njih ni mogoče izvesti razširitve serije. To dodatno zaplete problem reševanja enačbe kemijskega ravnovesja.
Fizično opažene težave so razložene s potrebo po upoštevanju preureditve elektronskih lupin atomov, ki vstopajo v reakcijo. To povzroča določene težave pri mikroskopskem opisu, kar vpliva tudi na makroskopski pristop.
Ker smo se dogovorili, da se omejimo na preučevanje redčenja plina, lahko uporabimo model idealnega plina. Predpostavljamo, da so vse reagirajoče komponente idealni plini, ki zapolnjujejo celotno prostornino in ustvarjajo tlak str. V tem primeru lahko zanemarimo kakršno koli interakcijo (razen kemičnih reakcij) med komponentami mešanice plinov. To nam omogoča domnevo, da je kemični potencial jaz-ta komponenta je odvisna le od parametrov iste komponente.
Tukaj je parcialni tlak jaz-ta komponenta in:
Ob upoštevanju (3.58) ima pogoj ravnotežja za trikomponentni sistem (3.57) obliko:
Za nadaljnjo analizo uporabimo enačbo stanja idealnega plina, ki jo zapišemo v obliki:
Tukaj, kot prej, označujemo termodinamično temperaturo. Potem dobi zapis, znan iz šole, obliko: , ki je zapisana v (3.60).
Nato za vsako komponento mešanice dobimo:
Določimo obliko izraza za kemijski potencial idealnega plina. Kot izhaja iz (2.22), ima kemični potencial obliko:
Ob upoštevanju enačbe (3.60), ki jo lahko zapišemo v obliki, se problem določanja kemijskega potenciala reducira na določanje specifične entropije in specifične notranje energije.
Sistem enačb za specifično entropijo sledi iz termodinamičnih identitet (3.8) in izraza toplotne kapacitete (3.12):
Ob upoštevanju enačbe stanja (3.60) in prehodu na specifične značilnosti imamo:
Rešitev (3.63) ima obliko:
Sistem enačb za specifično notranjo energijo idealnega plina sledi iz (2.23):
Rešitev tega sistema lahko zapišemo kot:
Z zamenjavo (3.64) - (3.65) v (3.66) in ob upoštevanju enačbe stanja idealnega plina dobimo:
Za mešanico idealnih plinov ima izraz (3.66) obliko:
Če nadomestimo (3.67) v (3.59), dobimo:
Izvajamo transformacije, pišemo:

S potenciranjem v zadnjem izrazu imamo:
Relacija (3.68) se imenuje zakon delovanja mase. Vrednost je samo funkcija temperature in se imenuje komponenta kemijske reakcije.
V to smer kemijsko ravnovesje smer kemijske reakcije pa določata tlak in temperatura.
Metodo termodinamičnih potencialov ali metodo karakterističnih funkcij je razvil Gibbs. To je analitična metoda, ki temelji na uporabi osnovne enačbe termodinamike za kvazistatične procese.
Ideja metode je, da osnovna enačba termodinamike omogoča, da sistem pod različnimi pogoji uvede nekatere funkcije stanja, imenovane termodinamični potenciali, katerih sprememba s spremembo stanja je popolna razlika; z uporabo tega je mogoče sestaviti enačbe, potrebne za analizo določenega pojava.
Razmislite o preprostih sistemih. V tem primeru ima osnovna enačba TD za kvazistatične procese obliko za zaprt sistem.
Kako se bo ta enačba spremenila, če se spremeni število delcev? Notranja energija in entropija sta sorazmerni s številom delcev v sistemu: ~, ~, torej ~, ~, in enačba bo videti kot za odprt sistem, kjer
- kemijski potencial bo posplošena sila za neodvisno spremenljivko števila delcev v sistemu.
Ta enačba povezuje pet količin, od katerih sta dve funkciji stanja: . Samo stanje preprostega sistema določata dva parametra. Če torej izberemo dve od petih imenovanih količin kot neodvisni spremenljivki, ugotovimo, da glavna enačba vsebuje še tri neznane funkcije. Za njihovo določitev je potrebno glavni enačbi dodati še dve enačbi, ki sta lahko toplotna in kalorična enačba stanja: , , če , so izbrani kot neodvisni parametri.
Vendar je definicija teh treh neznanih količin poenostavljena z uvedbo termodinamičnih potencialov.
Iz glavne enačbe izrazimo: za zaprt sistem
ali za odprt sistem
Vidimo, da je povečanje notranje energije popolnoma odvisno od povečanja entropije in povečanja prostornine, tj. če izberemo ali za odprt sistem kot neodvisne spremenljivke, moramo za določitev ostalih treh spremenljivk poznati samo eno enačbo za notranjo energijo kot funkcijo ali kot funkcijo .
Torej, če poznamo odvisnost, je mogoče z uporabo osnovne TD identitete s preprosto diferenciacijo (ob prvih odvodih) določiti obe drugi toplotni spremenljivki:
Če vzamemo druge derivate , potem lahko določimo kalorične lastnosti sistema: in - adiabatni modul elastičnosti sistema (določa spremembo tlaka \ elastičnosti \ na enoto spremembe prostornine in je recipročna vrednost stisljivosti koeficient):
Upoštevajoč, da je to skupni diferencial, in enačimo mešane odvode, najdemo razmerje med dvema lastnostma sistema - spremembo temperature med njegovo adiabatno širitvijo in spremembo tlaka med izohornim prenosom toplote v sistem:
Tako je notranja energija kot funkcija spremenljivk značilna funkcija. Njegovi prvi derivati določajo toplotne lastnosti sistema, drugi - kalorične lastnosti sistema, mešani - razmerje med drugimi lastnostmi sistema. Vzpostavitev tovrstnih povezav je vsebina metode TD potencialov. A je eden izmed mnogih potencialov TD.
Izraz za TD potenciale, njegov ekspliciten izraz, lahko najdemo samo za 2 sistema, od katerih je eden idealen plin, drugi pa ravnotežno sevanje, ker zanje so znane tako enačbe stanja kot notranja energija v odvisnosti od parametrov. Za vse druge sisteme TD se potenciali najdejo bodisi izkustveno bodisi z metodami statistične fizike, nato pa se s pomočjo dobljenih TD relacij določijo enačbe stanja in druge lastnosti. Za pline se funkcije TD najpogosteje izračunajo z metodami statistične fizike, za tekočine in trdne snovi pa se običajno ugotovijo eksperimentalno z uporabo kaloričnih definicij toplotne kapacitete.
Dobimo izraz za notranjo energijo idealnega plina kot potencial TD, tj. kot funkcije:
Pri idealnem plinu je notranja energija odvisna le od ,
po drugi strani pa je entropija idealnega plina odvisna od: . Izrazite iz druge enačbe in nadomestite v prvo enačbo:
Vzemimo logaritem
To upoštevamo
Če transformiramo drugi faktor, dobimo:
Dobljeni izraz nadomestimo v prvo enačbo in dobimo potencialno notranjo energijo TD: .
S praktičnega vidika je notranja energija kot potencial TD neprijetna, ker ene od njenih neodvisnih spremenljivk, entropije, ni mogoče neposredno izmeriti, tako kot količine .
Upoštevajte druge potenciale TD, transformirajte osnovno termodinamično identiteto tako, da vključuje razlike in .
Vidimo, da je entalpija funkcije TD potencial TD z neodvisnimi spremenljivkami, saj odvodi te funkcije podajajo ostale značilnosti sistema.
Kalorični in adiabatni modul elastičnosti;
podajte druge izpeljanke.
Razmerje med obema lastnostma sistema, in sicer adiabatno spremembo temperature s spremembo tlaka in izobarično spremembo volumna, ko je sistemu dovedena toplota, bo pridobljeno z izračunom mešanih odvodov:
Upoštevajte potencial TD v neodvisnih spremenljivkah, primernih za merjenje. Preoblikujemo glavno identiteto TD tako, da vključuje razlike in .
Vidimo, da je TD funkcija proste energije ali Helmholtzeva funkcija TD potencial z neodvisnimi spremenljivkami, saj odvodi te funkcije dajejo preostale značilnosti sistema.
Toplotni, daj prve izpeljanke.
Kalorična toplotna kapaciteta in koeficient stisljivosti - drugi derivati:
To pomeni;
To pomeni.
Mešani derivati vzpostavljajo razmerje med dvema lastnostma sistema - spremembo entropije med njegovo izotermično ekspanzijo in spremembo tlaka med izohornim segrevanjem:
Razmislite o drugi funkciji z drugačnim nizom spremenljivk, ki so primerne za merjenje. Preoblikujemo glavno identiteto TD tako, da vključuje razlike in .
TD funkcija se imenuje Gibbsov potencial, Gibbsova prosta energija je TD potencial z neodvisnimi spremenljivkami, saj odvodi te funkcije podajajo preostale karakteristike sistema.
Toplotna , , ki omogoča, da poznamo eksplicitno obliko funkcije, najdemo toplotno enačbo stanja sistema.
Kalorična toplotna kapaciteta in faktor stisljivosti:
To pomeni;
To pomeni.
Mešane izpeljanke vzpostavljajo razmerje med dvema lastnostma sistema −
sprememba entropije med njeno izotermno spremembo tlaka in sprememba prostornine med izobaričnim segrevanjem:
Kot lahko vidite, so termodinamični potenciali v splošnem primeru funkcije treh spremenljivk za odprte enokomponentne sisteme in funkcije samo dveh spremenljivk za zaprte sisteme. Vsak TD potencial vsebuje popolnoma vse značilnosti sistema. in; iz in izraze, ki jih dobimo za .
Metoda TD potencialov in metoda ciklov sta dve metodi, ki se uporabljata v TD za preučevanje fizikalnih pojavov.
Predavanje 14
Osnovna neenakost in osnovna enačba termodinamike. Pojem termodinamičnih potencialov. Joule-Thompsonov učinek. Le Chatelier-Brownovo načelo. Uvod v termodinamiko ireverzibilnih procesov.
Osnovna neenakost in osnovna enačba termodinamike
Za entropijo je razmerje izpolnjeno. Z uporabo prvega zakona termodinamike dobimo osnovna neenakost termodinamike:
 .
.
Enakost ustreza ravnotežnim procesom . Osnovna enačba ravnotežnih (reverzibilnih) procesov:
 .
.
Metoda termodinamičnih potencialov.
Uporaba zakonov termodinamike omogoča opis številnih lastnosti makrosistemov. Za tak opis sta se v zgodovini razvili dve poti: metoda ciklov in metoda termodinamičnih funkcij. Prvi temelji na analizi reverzibilnih ciklov, drugi pa na uporabi termodinamičnih funkcij (potencialov), ki jih je uvedel Gibbs.
Izhodišče za izpeljavo vseh termodinamičnih potencialov je osnovna enačba termodinamike:
 ,
,
povezovanje petih vrednosti ( T, S, U, str, V), ki so lahko parametri stanja ali obravnavani kot funkcije stanja sistema.
Za določitev stanja najpreprostejšega termodinamičnega sistema zadostuje nastavitev vrednosti dveh neodvisnih parametrov. Zato je za iskanje vrednosti preostalih treh parametrov potrebno definirati še tri enačbe, od katerih je ena osnovna termodinamična enačba, preostali dve pa sta lahko na primer enačba stanja in dodatna enačba, ki izhaja iz lastnosti določenega stanja sistema:
 ;
;
 ;
;
 .
.
Na splošno se lahko termodinamični potenciali nanašajo na katero koli funkcijo stanja (na primer notranjo energijo ali entropijo), če je definirana kot neodvisna funkcija parametrov stanja. Zato je število termodinamičnih funkcij zelo veliko. Običajno veljajo za tiste, ki imajo naslednja lastnina: delni odvodi funkcije glede na ustrezne parametre so enaki enemu ali drugemu parametru stanja sistema.
Termodinamični potenciali ( termodinamične funkcije ) – to so določene funkcije prostornine, tlaka, temperature, entropije, števila delcev sistema in drugih makroskopskih parametrov, ki označujejo stanje sistema, ki imajo naslednjo lastnost: če je termodinamični potencial znan, potem ga z diferenciacijo glede na zgoraj navedenih parametrov je mogoče pridobiti vse druge parametre, ki določajo stanje sistema.
Primeri termodinamičnih potencialov.
1)
V
in entropija
S
.
Potem iz osnovne enačbe termodinamike sledi:  . Kje najdemo
. Kje najdemo  ,
,
 . Posledično notranja energija
. Posledično notranja energija  - potencial.
- potencial.
Pomen notranje energije kot potenciala
: z V=const dobimo:  , tj. sprememba notranje energije je enaka količini toplote, dovedene v sistem med izohornim procesom.
, tj. sprememba notranje energije je enaka količini toplote, dovedene v sistem med izohornim procesom.
Če je proces nepovraten, potem  oz
oz  .
.
2) Izberimo tlak kot neodvisne parametre str in entropija S .
Ob upoštevanju enakosti  in osnovna enačba termodinamike:
in osnovna enačba termodinamike:  , to dobimo iz razmerja: sledi:
, to dobimo iz razmerja: sledi:  . Zdaj pa uvedimo zapis:
. Zdaj pa uvedimo zapis:  . Potem
. Potem  in
in  ,
,
 . pomeni, funkcijo
. pomeni, funkcijo  je termodinamični potencial in se imenuje: entalpija.
je termodinamični potencial in se imenuje: entalpija.
Pomen entalpije kot termodinamičnega potenciala
:
pri str=const to dobimo  , tj. sprememba entalpije je enaka količini toplote, dovedeni v izobaričnem procesu.
, tj. sprememba entalpije je enaka količini toplote, dovedeni v izobaričnem procesu.
Če je proces nepovraten, potem  ali,
ali,  .
.
3) Kot neodvisen parameter izberemo glasnost V in temperaturo T .
Prepišimo osnovno enačbo termodinamike  kot:
kot:  in ob upoštevanju enakosti
in ob upoštevanju enakosti  dobimo: ali. Zdaj uvajamo zapis:
dobimo: ali. Zdaj uvajamo zapis:  , potem
, potem  ,
,
 ,
,
 . V to smer, funkcijo
. V to smer, funkcijo  - termodinamični potencial, ki ga imenujemo prosta energija ali Helmholtzov termodinamični potencial.
- termodinamični potencial, ki ga imenujemo prosta energija ali Helmholtzov termodinamični potencial.
Pomen proste energije kot termodinamičnega potenciala : za T=const dobimo: , tj. zmanjšanje proste energije je enako delu, ki ga opravi sistem v izotermnem procesu.
Če je proces nepovraten, potem  ali, tj.
ali, tj.
 .
.
Z ireverzibilnim izotermnim in izohornim procesom  - prosta energija se zmanjšuje, dokler sistem ne pride v termodinamično ravnotežje - v tem primeru zavzame prosta energija minimalno vrednost.
- prosta energija se zmanjšuje, dokler sistem ne pride v termodinamično ravnotežje - v tem primeru zavzame prosta energija minimalno vrednost.
V termodinamiki je potencial povezan z energijo, potrebno za reverzibilen prenos ionov iz ene faze v drugo. Takšen potencial je seveda elektrokemijski potencial ionske komponente. Elektrostatični potencial, razen težav, povezanih z njegovim določanjem v kondenziranih fazah, ni neposredno povezan z reverzibilnim delom. Čeprav se lahko termodinamika znebi elektrostatičnega potenciala z uporabo elektrokemičnega potenciala, ostaja potreba po opisu električnega stanja faze.
Pogosto je elektrokemijski potencial ionske komponente predstavljen kot vsota električnega in "kemijskega" izraza:
kjer je F "elektrostatični" potencial in koeficient aktivnosti, za katerega se tukaj domneva, da je neodvisen od električnega stanja dane faze. Najprej ugotavljamo, da takšna razširitev ni potrebna, saj so bile ustrezne formule, ki so pomembne s termodinamičnega vidika, pridobljene že v pogl. 2.
Elektrostatični potencial F lahko definiramo tako, da bo merljiv ali neizmerljiv. Odvisno od tega, kako je definiran F, bo vrednost enolično definirana ali popolnoma nedefinirana. Možno je razviti teorijo, ne da bi imeli tako jasno definicijo elektrostatičnega potenciala, kot jo daje elektrostatika, in ne da bi skrbeli za natančno opredelitev njenega pomena. Če je analiza izvedena pravilno, je mogoče na koncu pridobiti fizično pomembne rezultate s kompenzacijo negotovih izrazov.
Vsaka izbrana definicija F mora izpolnjevati en pogoj. Treba ga je zmanjšati na definicijo (13-2), ki se uporablja za razliko v električnih potencialih med fazami z enako sestavo. Torej, če imajo faze enako sestavo, potem
Tako je F kvantitativno merilo električnega stanja ene faze glede na drugo, ki ima enako sestavo. Ta pogoj je izpolnjen s številnimi možnimi definicijami F.
Namesto F se lahko uporabi zunanji potencial, ki je načeloma merljiv. Njegova pomanjkljivost je težava pri merjenju in uporabi v termodinamičnih izračunih. Prednost je v tem, da daje določen pomen Φ in se ta potencial ne pojavi v končnih rezultatih, tako da potreba po njegovem merjenju pravzaprav odpade.
Druga možnost je uporaba potenciala ustrezne referenčne elektrode. Ker je referenčna elektroda reverzibilna glede na nekatere ione, ki so prisotni v raztopini, je to enakovredno uporabi elektrokemičnega potenciala iona ali Poljubnost te definicije je razvidna iz potrebe po izbiri specifične referenčne elektrode ali ionske komponente. Dodatna pomanjkljivost te izbire je, da v raztopini, ki ne vsebuje komponente i, vrednost postane minus neskončna. Tako se elektrokemijski potencial ne ujema z našim običajnim konceptom elektrostatičnega potenciala, kar je razloženo z njegovim odnosom z reverzibilnim delom. Ta izbira potenciala ima to prednost, da je povezana z meritvami z referenčnimi elektrodami, ki se običajno uporabljajo v elektrokemiji.
Razmislite zdaj o tretji možnosti. Izberemo ionsko komponento in definiramo potencial F na naslednji način:
Potem lahko elektrokemijski potencial katere koli druge komponente izrazimo kot

Upoštevati je treba, da so kombinacije v oklepajih natančno definirane in niso odvisne od električnega stanja v skladu s pravili, določenimi v odd. 14. V tem primeru lahko zapišete gradient elektrokemičnega potenciala
Spet je vidna poljubnost te definicije Φ, povezana s potrebo po izbiri ionske komponente n. Prednost takšne definicije F je v nedvoumni povezavi z elektrokemijski potenciali in skladnost z našo običajno predstavo o elektrostatičnem potencialu. Zaradi prisotnosti člena v enačbi (26-3) lahko slednjo uporabimo za raztopino z izginjajočo koncentracijo komponente.
V meji neskončno razredčenih raztopin členi s koeficienti aktivnosti izginejo zaradi izbire sekundarnega standardnega stanja (14-6). V tej meji postane definicija F neodvisna od izbire standardnega iona n. To je osnova za to, kar bi morali imenovati teorija razredčenih raztopin elektrolitov. Istočasno enačbi (26-4) in (26-5) pokažeta, kako popraviti koeficient aktivnosti v teoriji razredčenih raztopin, ne da bi se zatekli k koeficientom aktivnosti posameznih ionov. Odsotnost odvisnosti od vrste iona v primeru neskončno razredčenih raztopin je posledica možnosti merjenja razlike v električnih potencialih med fazami z enako sestavo. Takšne raztopine imajo v bistvu enake sestave v smislu, da ion v raztopini medsebojno deluje le s topilom in ne občuti celo interakcije na dolge razdalje drugih ionov.
Uvedba takšnega električnega potenciala je uporabna pri analizi transportnih procesov v raztopinah elektrolitov. Za tako definiran potencial Smurl in Newman uporabljata izraz kvazielektrostatični potencial.
Razpravljali smo o možnih načinih uporabe električnega potenciala v elektrokemijski termodinamiki. Uporaba potenciala v transportni teoriji je v bistvu enaka
in v termodinamiki. Pri delu z elektrokemičnimi potenciali se lahko opustimo električni potencial, čeprav je njegova uvedba lahko koristna ali priročna. V kinetiki elektrodnih procesov se lahko sprememba proste energije uporabi kot gonilna sila reakcije. To je enakovredno uporabi površinske prenapetosti, opredeljene v oddelku. osem.
Električni potencial najde uporabo tudi v mikroskopskih modelih, kot je Debye-Hücklova teorija, omenjena zgoraj in predstavljena v naslednjem poglavju. Nemogoče je vedno strogo določiti tak potencial. Jasno je treba razlikovati med makroskopskimi teorijami – termodinamiko, teorijo transportnih procesov in mehaniko tekočin – ter mikroskopskimi teorijami – statistično mehaniko in kinetična teorija plini in tekočine. Na podlagi lastnosti molekul ali ionov mikroskopske teorije omogočajo izračun in povezavo takšnih makroskopskih značilnosti, kot so na primer koeficienti aktivnosti in difuzijski koeficienti. V tem primeru je redko mogoče dobiti zadovoljive kvantitativne rezultate brez dodatnih eksperimentalnih informacij. Makroskopske teorije po eni strani zagotavljajo osnovo za najbolj ekonomično merjenje in tabeliranje makroskopskih značilnosti, po drugi strani pa omogočajo uporabo teh rezultatov za napovedovanje obnašanja makroskopskih sistemov.