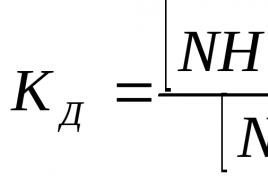Reakcije ionske izmenjave. Elektrolitska disocijacija
Elektrolitska disocijacija - To je postopek razgradnje molekul elektrolitov na ione pod delovanjem polarnih molekul topil.
ElektrolitiSo snovi, katerih taline ali vodne raztopine prevajajo električni tok. Sem spadajo raztopine kislin, talin in raztopine alkalij in soli. Neelektroliti So snovi, ki ne prevajajo električnega toka. Sem spadajo številne organske snovi.
Imenujemo elektrolite, ki se skoraj popolnoma disociirajo na ione močna; imenujemo elektrolite, ki se delno ločijo na ione šibka.Za kvantitativno oceno popolnosti disociacije je uveden koncept stopnje disociacije. Stopnja disociacije elektrolit se imenuje razmerje med številom molekul, razgrajenih v ione, in celotnim številom molekul v raztopini.
Običajno je stopnja disociacije ( α ) so izraženi v delih enote ali%:
kje n - število delcev, ki so izpostavljeni elektrolitski disociaciji;
n 0 - skupno število delcev v raztopini.
Močni elektroliti - skoraj vse soli, topne baze ( NaOH, KOH, Ba(OH) 2 in drugi), anorganske kisline ( H 2 Torej 4 , HCl, HNO 3 , HBr, Živjo in itd.) .
Šibki elektroliti - netopne baze in NH 4 OH, anorganske kisline ( H 2 CO 3, , H 2 S, HNO 2, H 3 PO 4 in drugi), organske kisline in voda H 2 O.
Močni elektroliti se skoraj v celoti ločijo na ione (tj. Postopek disociacije je nepovraten) in v enem koraku:
HCl \u003d H + + Kl – H 2 Torej 4 \u003d 2H + + SO 4 2–
Šibki elektroliti se delno disociirajo (tj. Postopek disociacije je reverzibilen) in postopoma . Na primer, za večbazne kisline se na vsaki stopnji odvzame en vodikov ion:
1.H 2 Torej 3 ⇄ H + + HSO 3 - 2. Hso 3 - ⇄ H + + SO 3 2-
Tako je število stopenj večbaznih kislin določeno z bazičnostjo kisline (število vodikovih ionov), število stopenj večkislinskih baz pa s kislostjo baze (ali številom hidroksilnih skupin): NH 4
OH
⇄
NH 4
+
+
OH –
.
Proces elektrolitske disociacije se konča z vzpostavitvijo stanja kemičnega ravnovesja v sistemu, za katerega je značilna ravnotežna konstanta: 
Konstanta ravnotežja elektrolitskega disociacijskega procesa se imenuje disociacijska konstanta - TO D ... Disociacijska konstanta je odvisna od narave elektrolita, narave topila in temperature, ni pa odvisna od koncentracije elektrolita.
Med TO D in α obstaja količinsko razmerje:
 (13)
(13)
Razmerje (13) se imenuje Ostwaldov zakon redčenja: stopnja disociacije šibkega elektrolita narašča z redčenjem raztopine.
Za šibke elektrolite, kadar je α 1, TO D = α 2 OD.
Voda je šibek elektrolit, zato reverzibilno disociira:
H 2 O ⇄ H + + OH – ∆ H \u003d + 56,5 kJ / mol
Disociacijska konstanta vode: 
Stopnja disociacije vode je zelo nizka (gre za zelo šibek elektrolit). Ker je voda prisotna v velikem presežku, lahko njeno koncentracijo štejemo za konstantno in je  potem
potem
TO D [ H 2 O] = [ H + ]∙[ OH - ] = 55,6∙1,8∙10 -16 = 10 -14
[ H + ]∙[ OH - ] = 10 -14 = K W - ionski produkt vode
Ker so koncentracije vodikovih kationov in hidroksidnih ionov v vodi enake, potem: [
H +
]
= [
OH -
]
=
 .
.
Raztapljanje drugih snovi (kislin, baz, soli) v vodi spremeni koncentracijo ionov H + ali ON – , njihov produkt pa vedno ostane konstanten in enak 10 -14 pri T \u003d 25 0 С. Koncentracija ionov H + lahko služi kot merilo kislosti ali alkalnosti raztopine. Običajno se v ta namen uporablja pH: pH = - lg[ H + ]. V to smer, pH vrednost Je decimalni logaritem koncentracije vodikovih ionov, vzet z nasprotnim predznakom.
Tri medije razlikujemo glede na koncentracijo vodikovih ionov.
AT nevtralnookolje [ H + ] = [ OH - ]= 10 -7 mol / L, pH \u003d -lg 10 -7 = 7 ... To okolje je značilno tako za čisto vodo kot za nevtralne raztopine. AT kislo rešitve [ H + ] > 10 -7 mol / l, pH< 7 ... V kislem okolju pH se spreminja znotraj 0 < рН < 7 ... AT alkalna okoljih [ H + ] < [ОН – ] in [ H + ] < 10 -7 mol / L, Posledično pH\u003e 7... Območje spremembe pH: 7 < рН < 14 .
Reakcije ionske izmenjave (RIO) So reakcije med ioni, ki potekajo v vodnih raztopinah elektrolitov. Posebnost presnovnih reakcij: elementi, ki sestavljajo reaktante, ne spremenijo oksidacijskega stanja. Reakcije ionske izmenjave so nepopravljive reakcije in se nadaljujejo pod pogojem: 1) tvorba slabo topne snovi, 2) sproščanje plinaste snovi, 3) tvorba šibkega elektrolita.
Med RIO se nasprotno nabiti ioni vežejo in odstranijo iz reakcijske sfere. Bistvo reakcij ionske izmenjave je izraženo z uporabo ionskih enačb, ki v nasprotju z molekularnimi kažejo prave udeležence v reakciji. Pri sestavljanju ionskih enačb se moramo voditi z dejstvom, da so nizko disociacijske, nizko topne (oborjene) in plinaste snovi zapisane v molekularni obliki. Močno topni elektroliti so zabeleženi kot ioni. Zato je treba pri pisanju ionskih enačb uporabiti tabelo topnosti soli in baz v vodi.
Hidroliza- to je postopek interakcije solnih ionov z molekulami vode, ki vodi do tvorbe nizko disociirajočih spojin; je poseben primer reakcij ionske izmenjave. Nastale soli se podvržejo hidrolizi:
šibka kislina in močna baza ( NaCH 3 COO, Na 2 CO 3 , Na 2 S, );
šibka baza in močna kislina ( NH 4 Kl, FeCl 3 , AlCl 3 ,);
šibka baza in šibka kislina ( NH 4 CN, NH 4 CH 3 COO).
Soli, ki jih tvori močna kislina in močna baza, niso podvržene hidrolizi: Na 2 Torej 4 , BaCl 2 , NaCl, NaJ itd.
Hidroliza soli poveča koncentracijo ionov H + ali ON – ... To vodi do premika ionskega ravnovesja vode in, odvisno od narave soli, raztopini da kislo ali alkalno gojišče (glej primere reševanja problemov).
Formule za izračun.
1. Izračunajte normalno koncentracijo raztopine kisline (preskus št. 1) ali raztopine alkalij (preskus št. 2) iz formule zakona enakovrednosti raztopin:
2. Izračunajte maso kisline (preskus št. 1) ali alkalije (preskus št. 2), ki jo vsebuje 10 ml ustrezne raztopine, iz formule normalne koncentracije:
3. Izračunajte maso vode (topila) v 10 ml raztopine, ob predpostavki, da je gostota raztopine 1:
4. Na podlagi pridobljenih podatkov izračunajte določene koncentracije po ustreznih formulah.
Laboratorijske vaje št
Cilj: preučiti pogoje poteka reakcij ionske izmenjave in pravila za zapisovanje reakcij ionske izmenjave v molekularni in ionsko-molekularni obliki.
Teoretični del.
Elektrolitska disocijacija imenuje se delni ali popolni razpad molekul elektrolitov na ione pod delovanjem molekul polarnega topila. Disociacija nastane kot posledica zapletene fizikalno-kemijske interakcije molekul elektrolitov z molekulami polarnih topil. Interakcija ionov z molekulami polarnih topil se imenuje solvatacija (za vodne raztopine - hidracija) ionov. Solvirani ioni nastajajo v raztopinah elektrolitov.
Elektroliti prevajajo električni tok, saj raztopine vsebujejo nabite delce: katione in anione.
Proces disociacije je kvantitativno označen z stopnja elektrolitske disociacije α. Stopnja disociacije je razmerje med številom molekul, razpadlih v ione n, in celotnim številom molekul N topljene snovi:
Stopnja disociacije je izražena kot odstotek ali delež enote.
Elektrolite delimo v tri skupine: a) močni (α\u003e 30%), b) srednji (3<α<30%), в) слабые (α<3%).
Izobraževalna literatura vsebuje tabele o stopnjah disociacije kislin, baz in soli. Stopnja disociacije je odvisna od narave topljene snovi in \u200b\u200btopil, temperature, koncentracije in prisotnosti podobnih ionov v raztopini. Pri šibkih elektrolitih je stopnja disociacije bistveno odvisna od koncentracije: nižja kot je koncentracija raztopine, večja je stopnja elektrolitske disocijacije.
Veliko bolj priročno je opisati sposobnost elektrolitov, da se disociirajo v raztopino disociacijska konstanta K , kar ni odvisno od koncentracije raztopine. Disociacijska konstanta K je ravnotežna konstanta reverzibilnega disociacijskega procesa šibkega elektrolita - kisline ali baze. Disociacijsko konstanto kislin imenujemo tudi konstanta kislosti, osnovno konstanto pa bazičnost. Vrednosti disociacijskih konstant šibkih elektrolitov so podane v tabelah za standardne pogoje.
Disociacijska konstanta (osnovnost) se izrazi z razmerjem med produktom ravnotežnih koncentracij ionov v raztopini danega šibkega elektrolita in koncentracijo nedecificiranih molekul:
![]()
Disociacijska konstanta je merilo relativne moči šibkih elektrolitov: manjši je, šibkejši je elektrolit. Upošteva se razmerje med konstanto in stopnjo disociacije šibkega binarnega elektrolita ostwaldov vzrejni zakon:
![]()
Z vidika elektrolitske disociacije se kisline imenujejo elektroliti, ki v vodnih raztopinah tvorijo pozitivno nabite vodikove ione in kislinske ostanke. Vodikovi ioni so značilni za kisline in določajo njihove lastnosti. Kisline, ki so močni elektroliti: dušikova HNO 3, klorovodikova HCl, vodikov bromid HBr, hidrojodna HJ, žveplova H 2 SO 4, manganova HMnO 4 in druge.
Šibkih elektrolitov je bistveno več kot močnih. Šibki elektroliti so kisline: žveplova H 2 SO 3, fluorovodikova HF, ogljikova H 2 CO 3, vodikov sulfid H 2 S, ocetna CH 3 COOH itd. Večbazne kisline se postopno ločijo. Primeri disociacije kisline:
HCl \u003d H + + Cl -
CH 3 COOH CH 3 COO - + H +
Stopnja I: H 2 SO 3 H + + HSO 3 -
ali H2SO3 2H + + SO3 2-,
II stopnja: HSО 3 - H + + SO 3 2 -
Z vidika elektrolitske disociacije se baze imenujejo elektroliti, ki v vodnih raztopinah tvorijo negativno nabite OH - hidroksidne ione in kovinske katione. Hidroksidni ioni določajo splošne lastnosti baz. Osnove z valenco kationa večjo od ene se disociirajo postopoma. Močni elektroliti so baze, v katerih so kationi alkalijske in zemeljskoalkalijske kovine, z izjemo Be (OH) 2 in Mg (OH) 2.
Osnove so v osnovi šibki elektroliti, zlasti tisti, ki jih tvorijo amfoterne kovine. Amfoterični hidroksidi se ločijo kot baze v kislem mediju in kot kisline v alkalnem mediju. Primeri disociacije baz in amfoternih hidroksidov:
NaOH \u003d Na + + OH -
1. st. Fe (OH) 2 FeOH + + OH -
II. Čl. FeOH + Fe 2+ + OH - ali Fe (OH) 2 Fe 2+ + 2OH -
Zn 2+ + 2OH - Zn (OH) 2 H 2 ZnО 2 2H + + ZnO 2 2-
Soli so elektroliti, ki se v vodi disociirajo na pozitivne kovinske ione in negativne ione kislega ostanka.Vse soli, ki so v vodi dobro topne, so močni elektroliti. Primeri disociacije normalne (srednje), kisle, bazične, kompleksne in dvojne soli:
KBr \u003d K + + Br -; K3 \u003d 3K + + 3-;
NaHCO 3 \u003d Na + + HCO 3 -; KAl (SO 4) 2 \u003d K + + Al 3+ + 2SO 4 2-.
AlOHCl2 \u003d AlOH 2+ + 2C1 -;
Študija različnih reakcij, predvsem v nevodnih medijih, je privedla do oblikovanja splošnejših konceptov kislin in baz. Najpomembnejša med sodobnimi teorijami kislin in baz pripada protonski teoriji, po kateri je kislina darovalec protona, to je delček (molekula ali ion), ki je sposoben darovati vodikov ion - proton, baza pa je akceptor protona, tj. delček (molekula ali ion), ki je sposoben pritrditi proton. Na primer, v reakciji:
HC1 + NH 3 \u003d NH 4 + + Cl -
ion C1 - je baza, konjugirana s HCl kislino, in NH 4 + ion je kislina, konjugirana z bazo NH 3. V raztopinah elektrolitov pride do reakcij med ioni, v katere se molekule topljenih snovi razgradijo. Reakcije se beležijo v treh oblikah: molekularna, polno ionsko-molekularna in skrajšana ionsko-molekularna. Močni elektroliti so zabeleženi v obliki ionov, srednjih in šibkih elektrolitov, oborin in plinov - v obliki molekul. Bistvo reakcije se odraža v skrajšani ionsko-molekularni enačbi, v kateri so navedeni le delci, ki neposredno vstopijo v reakcijo, in ioni in molekule, katerih koncentracija se bistveno ne spremeni. Reakcije med elektroliti potekajo v smeri tvorbe plina, usedlin ali šibkejše
elektrolit.
Primer reakcije v raztopinah elektrolitov: nevtralizacija močne dušikove kisline s šibko bazo (amonijevim hidroksidom). Enačba molekularne reakcije:
HNO 3 + NH 4 OH \u003d NH 4 NO 3 + H 2 O.
Pri tej reakciji so močni elektroliti dušikova kislina in nastala amonijeva nitratna sol, ki jo zapišemo v obliki ionov, šibki elektroliti pa amonijev hidroksid in voda, ki ju zapišemo v obliki molekul. Popolna ionsko-molekularna enačba je:
H + + NO 3 - + NH 4 OH \u003d NH 4 + + NO 3 - + H 2 O.
Kot lahko vidite, se le ioni NO 3 - med reakcijo ne spreminjajo, razen če jih zapišemo v skrajšani ionsko-molekularni enačbi:
H + + NH 4 OH \u003d NH 4 + + H 2 O.
Praktični del
Reakcije ionsko - molekularne izmenjave
Izvedite reakcije med raztopinami elektrolitov v skladu z nalogo. Za to v epruveto vlijemo 7-8 kapljic enega reagenta in dodamo 7-8 kapljic drugega reagenta. Opazite znake reakcije: padavine, razvoj plinov ali sprememba vonja (kar kaže na tvorbo snovi, ki ne disociira)
Nato v skladu z opaženimi znaki reakcijo razvrstite med tri vrste:
1) reakcije ionske izmenjave s tvorbo slabo topne snovi (oborine);
2) reakcije ionske izmenjave z razvojem plinov;
3) reakcije ionske izmenjave s tvorbo šibkega elektrolita.
Vsako reakcijo zapišite v 3 oblike:
a) molekularni,
b) polni ionski - molekularni,
c) zmanjšana ionsko - molekularna.
Naredite zaključek o smeri reakcij ionske izmenjave.
Seznam opravil:
| 1. CH 3 COONa + H 2 SO 4 2. NaNO 2 + H 2 SO 4 3. MgCl 2 + Na 3 PO 4 4. NH 4 Cl + KOH 5. Na 2 CO 3 + HCl 6. Na 2 CO 3 + Ba (NO 3) 2 7. (CH 3 COO) 2 Pb + HCl 8. Hg (NO 3) 2 + NaOH 9. H 2 SO 4 + BaCl 2 10. NaCl + Pb (NO 3) 2 11. NiSO 4 + KOH 12. NaNO 2 + HCl 13. Bi (NO 3) 3 + KOH 14. Na 2 S + CdCl 2 15. Bi (NO 3) 3 + Na 2 S 16. CoSO 4 + KOH 17. CuSO 4 + KOH 18. Na 2 CO 3 + HNO 3 19. K 2 CrO 4 + CuSO 4 20. K 2 CrO 4 + MnSO 4 21. K 2 CrO 4 + NiSO 4 22. K 2 CO 3 + MnSO 4 23. Na 2 SO 3 + HCl | 24. Hg (NO 3) 2 + Na 2 S 25. NiSO 4 + NH 4 OH 26. NiSO 4 + NH 4 OH g 27. AlCl 3 + KOH 28. FeCl 3 + Na 3 PO 4 29. K 2 CrO 4 + Ba (NO 3) 2 30. NaNO 2 + HNO 3 31. MgCl 2 + NaOH 32. CuSO 4 + NH 4 OH 33. CuSO 4 + NH 4 OH g 34. AlCl 3 + KOH g 35. Pb (NO 3 ) 2 + KI 36. CH 3 COOK + HCl 37. Al 2 (SO 4) 3 + NaOH 38. Al 2 (SO 4) 3 + NaOH g 39. CoSO 4 + Na 2 S 40. Pb (NO 3) 2 + Na 3 PO 4 41. Na 3 PO 4 + CuSO 4 42. CH 3 COOK + HNO 3 43. CH 3 COOH + KOH 44. CoSO 4 + NH 4 OH 45. CoSO 4 + NH 4 OH g 46. Hg (NO 3 ) 2 + KI | 47. Hg (NO 3) 2 + KI g 48. CdCl 2 + NH 4 OH 49. CdCl 2 + NH 4 OH g 50. NaHCO 3 + HNO 3 51. ZnSO 4 + BaCl 2 52. ZnSO 4 + KOH 53. ZnSO 4 + KOH g 54. (CH 3 COO) 2 Pb + H 2 SO 4 55. NaHCO 3 + H 2 SO 4 56. (NH 4) 2 SO 4 + KOH 57. K 2 CO 3 + H 2 SO 4 58 . (NH 4) 2 SO 4 + NaOH 59. K 2 CO 3 + HCl 60. CrCl 3 + KOH 61. CrCl 3 + KOH g 62. ZnCl 2 + NaOH 63. ZnCl 2 + NaOH g 64. MnSO 4 + KOH 65. MnSO 4 + Na 3 PO 4 66. Na 2 SO 3 + H 2 SO 4 67. K 2 CO 3 + CH 3 COOH 68. Na 2 CO 3 + CH 3 COOH 69. NaHCO 3 + CH 3 COOH |
Laboratorijske vaje št. 6
ELEKTROLITIČNA DISCOCIJA
ELEKTROLITI IN NEELELEKROLITI
Teorija elektrolitske disocijacije
(S. Arrhenius, 1887)
Ko se elektroliti raztopijo v vodi (ali se stopijo), se razgradijo v pozitivno in negativno nabite ione (podvrženi elektrolitski disociaciji).
Pod delovanjem električnega toka se kationi (+) premaknejo na katodo (-), anioni (-) pa na anodo (+).
Elektrolitska disocijacija je reverzibilen postopek (obratna reakcija se imenuje molarizacija).
Stopnja elektrolitske disociacije (a) odvisno od narave elektrolita in topila, temperature in koncentracije. Prikazuje razmerje med številom molekul, razpadlih v ione (n) na skupno število molekul, vnesenih v raztopino (N).
a \u003d n / N 0< a < 1
Mehanizem elektrolitske disociacije ionskih snovi
Pri raztapljanju spojin z ionskimi vezmi (npr. NaCl) postopek hidracije se začne z usmeritvijo vodnih dipolov okoli vseh grebenov in robov kristalov soli.
Molekule vode, ki se orientirajo okoli ionov kristalne rešetke, tvorijo z njimi bodisi vodikove bodisi donor-akceptorske vezi. V tem procesu se sprosti velika količina energije, ki ji pravimo hidracijska energija.
Hidracijska energija, katere vrednost je primerljiva z energijo kristalne rešetke, se uporablja za uničenje kristalne rešetke. V tem primeru hidratirani ioni plast za plastjo prehajajo v topilo in v mešanju z njegovimi molekulami tvorijo raztopino.
Mehanizem elektrolitske disociacije polarnih snovi
Snovi, katerih molekule nastanejo glede na vrsto polarne kovalentne vezi (polarne molekule), se ločijo na podoben način. Okoli vsake polarne molekule snovi (npr. HCl), vodni dipoli so usmerjeni na določen način. Zaradi interakcije z vodnimi dipoli se polarna molekula še bolj polarizira in spremeni v ionsko molekulo, nato se zlahka tvorijo prosti hidratirani ioni.
Elektroliti in neelektroliti
Elektrolitska disociacija snovi, ki nastane s tvorbo prostih ionov, pojasnjuje električno prevodnost raztopin.
Običajno je postopek elektrolitske disociacije zapisan v obliki diagrama, ne da bi razkrili njegov mehanizem in izpustili topilo (H 2 O), čeprav veliko prispeva.
CaCl 2 «Ca 2+ + 2Cl -
KAl (SO 4) 2 "K + + Al 3+ + 2SO 4 2-
HNO 3 "H + + NO 3 -
Ba (OH) 2 «Ba 2+ + 2OH -
Iz elektronevtralnosti molekul izhaja, da mora biti skupni naboj kationov in anionov enak nič.
Na primer, za
Al 2 (SO 4) 3–– 2 (+3) + 3 (-2) \u003d +6 - 6 \u003d 0
KCr (SO 4) 2–– 1 (+1) + 3 (+3) + 2 (-2) \u003d +1 + 3 - 4 \u003d 0
Močni elektroliti
To so snovi, ki se v vodi, ko se raztopijo, skoraj popolnoma razgradijo v ione. Močni elektroliti praviloma vključujejo snovi z ionskimi ali močno polarnimi vezmi: vse dobro topne soli, močne kisline (HCl, HBr, HI, HClO4, H2S04, HNO3) in močne baze (LiOH, NaOH, KOH, RbOH, CsOH, Ba (OH) 2, Sr (OH) 2, Ca (OH) 2).
V močni raztopini elektrolita se raztopljena snov nahaja predvsem v obliki ionov (kationov in anionov); nedisociiranih molekul praktično ni.
Šibki elektroliti
Snovi, ki se delno ločijo na ione. Raztopine šibkih elektrolitov skupaj z ioni vsebujejo nedociirane molekule. Šibki elektroliti ne morejo dati visoke koncentracije ionov v raztopini.
Šibki elektroliti vključujejo:
skoraj vse organske kisline (CH 3 COOH, C 2 H 5 COOH itd.);
nekatere anorganske kisline (H2CO3, H2S itd.);
skoraj vse soli, baze in amonijev hidroksid, ki so v vodi slabo topne(Ca 3 (PO 4) 2; Cu (OH) 2; Al (OH) 3; NH 4 OH);
vode.
Slabo (ali komaj prevajajo) električni tok.
CH 3 COOH "CH 3 COO - + H +
Cu (OH) 2 «[CuOH] + + OH - (prva stopnja)
[CuOH] + "Cu 2+ + OH - (druga stopnja)
H 2 CO 3 «H + + HCO - (prva stopnja)
HCO 3 - "H + + CO 3 2- (druga stopnja)
Neelektroliti
Snovi, katerih vodne raztopine in taline ne prevajajo električnega toka. Vsebujejo kovalentne nepolarne ali nizkopolarne vezi, ki ne razpadajo v ione.
Plini, trdne snovi (nekovine), organske spojine (saharoza, bencin, alkohol) ne prevajajo električnega toka.
IONSKE REAKCIJE. HIDROLIZA
Jonske reakcije v raztopini
Reakcije ionske izmenjave so reakcije med ioni, ki nastanejo kot posledica disociacije elektrolitov.
Pravila za pripravo enačb ionske reakcije
Spojine, netopne v vodi (preproste snovi, oksidi, nekatere kisline, baze in soli), ne ločijo.
V reakcijah se uporabljajo raztopine snovi, zato so celo slabo topne snovi v raztopinah v obliki ionov.
Če zaradi reakcije nastane slabo topna snov, potem se pri pisanju ionske enačbe šteje za netopno.
Vsota električnih nabojev ionov na levi in \u200b\u200bdesni strani enačbe mora biti enaka.
Postopek priprave enačb ionske reakcije
Zapišite enačbo molekularne reakcije
MgCl 2 + 2AgNO 3 ® 2AgCl + Mg (NO 3) 2
S pomočjo tabele topnosti določite topnost vsake snovi
LEKCIJA 9 10. razred (prvo leto študija)
Teorija elektrolitske disocijacije. Načrt reakcij na ionsko izmenjavo
1. Elektroliti in neelektroliti.
2. Teorija elektrolitske disocijacije (TED) S. A. Arrhenius.
3. Mehanizem elektrolitske disociacije elektrolitov z ionskimi in kovalentnimi polarnimi vezmi.
4. Stopnja disociacije.
5. Kisline, baze, amfoterni hidroksidi, soli z vidika TED.
6. Vrednost elektrolitov za žive organizme.
7. Disociacija vode. Jonski produkt vode. Kazalnik vodika. Gojišča vodnih raztopin elektrolitov. Kazalniki.
8. Reakcije ionske izmenjave in pogoji njihovega poteka.
Glede na sposobnost vodenja električnega toka v vodni raztopini ali taljenju lahko vse snovi razdelimo na elektrolite in neelektrolite.
Elektroliti - gre za snovi, raztopine ali taline, ki prevajajo električni tok; elektroliti (kisline, soli, alkalije) imajo ionske ali polarne kovalentne vezi.
Neelektroliti - gre za snovi, katerih raztopine ali taline ne prevajajo električnega toka; v neelektrolitnih molekulah (organske snovi, plini, voda) so vezi kovalentne nepolarne ali nizkopolarne.
Da bi razložil električno prevodnost raztopin in talin elektrolitov, je Arrhenius leta 1887 ustvaril teorija elektrolitske disocijacije, katere glavne določbe so naslednje.
1. Molekule elektrolitov v raztopini ali talini se disociirajo (razpadejo na ione). Proces razgradnje molekul elektrolita na ione v raztopini ali talini se imenuje elektrolitska disociacija. Jonah So delci, ki imajo naboj. Pozitivno nabiti ioni - kationi, negativno nabit - anioni... Lastnosti ionov se razlikujejo od lastnosti ustreznih nevtralnih atomov, kar je razloženo z različno elektronsko strukturo teh delcev.
2. V raztopini ali talini se ioni premikajo kaotično. Ko pa gre električni tok skozi raztopino ali talino, postane gibanje ionov urejeno: kationi se premaknejo na katodo (negativno nabita elektroda), anioni pa na anodo (pozitivno nabito elektrodo).
3. Disociacija je reverzibilen postopek. Hkrati z disocijacijo gre združenje - postopek tvorjenja molekul iz ionov.
4. Skupna vsota nabojev kationov v raztopini ali talini je enaka skupni vsoti nabojev anionov in je v predznaku nasprotna; rešitev je praviloma električno nevtralna.
Glavni razlog za disociacijo v raztopinah s polarnim topilom je solvatacija ionov (v primeru vodnih raztopin hidracija). Disociacija ionskih spojin v vodni raztopini poteka v celoti (KCl, LiNO 3, Ba (OH) 2 itd.). Elektroliti s polarno kovalentno vezjo se lahko disociirajo delno ali v celoti, odvisno od polarnosti vezi (H 2 SO 4, HNO 3, HI itd.). V vodni raztopini nastanejo hidratirani ioni, vendar zaradi enostavnosti enačbe prikazujejo ione brez molekul vode:

Nekateri elektroliti se popolnoma ločijo, drugi delno. Za označitev disociacije je uveden koncept stopnja elektrolitske disociacije ... Količina prikazuje razmerje med številom disociiranih molekul n na število raztopljenih molekul N elektrolit v raztopini:
= n/N.
Stopnja disociacije narašča z redčenjem raztopine in z zvišanjem temperature raztopine. Glede na stopnjo disociacije elektrolite delimo na močne, srednje trdne in šibke. Močni elektroliti se skoraj popolnoma disociirajo v raztopini, njihova stopnja disociacije je več kot 30% in se nagiba k 100%. Med srednje elektrolite spadajo elektroliti, katerih stopnja disociacije je od 3% do 30%. Stopnja disociacije šibkih elektrolitov je manjša od 3%. Močni elektroliti vključujejo soli, močne kisline, alkalije. Šibke - šibke kisline, netopne baze, amonijev hidroksid, voda.
Z vidika teorije elektrolitske disociacije je mogoče opredeliti snovi različnih razredov.
Kisline - to so elektroliti, ki med disocijacijo tvorijo vodikove katione in kislinske ostanke. Število disociacijskih korakov je odvisno od bazičnosti kisline, na primer:
HCl H + + Cl -,
H 2 CO 3 H + + HCO 3 - 2H + + CO 3 2–.
Temelji Ali se elektroliti disociirajo na kovinske katione in anione hidroksi skupine. Število disociacijskih korakov je odvisno od kislosti baze, na primer:
NaOH Na + + 2OH -,
Ca (OH) 2 CaOH + + OH - Ca 2+ + 2OH -.
Amfoterični hidroksidi So šibki elektroliti, ki ob disociaciji tvorijo vodikove katione in anione hidroksi skupine, na primer:
Zn (OH) 2 ZnOH + + OH - Zn 2+ + 2OH -,
H 2 ZnO 2 H + + HZnO 2 - 2H + + ZnO 2 2–.
Srednje soli Ali se elektroliti disociirajo na kovinske katione in kislinske ostanke, na primer:
Na 2 SO 4 2Na + + SO 4 2–.
Kisle soli Ali so elektroliti, ki se ločijo na kovinske katione in kompleksne anione, ki vključujejo vodikove atome in kislinske ostanke, na primer:
NaHCO 3 Na + + HCO 3 -.
Osnovne soli Ali se elektroliti disociirajo v anione kislih ostankov in kompleksne katione, sestavljene iz kovinskih atomov in hidroksi skupin, na primer:
Сu (OH) Сl CuОН + + Сl -.
Kompleksne soli Ali so elektroliti, ki med disociacijo tvorijo kompleksne kompleksne ione, ki so v vodnih raztopinah precej stabilni, na primer:
K 3 3K + + 3–.
Elektroliti so sestavni del tekočin in tkiv živih organizmov. Za normalen potek fizioloških in biokemijskih procesov so potrebni natrij, kalij, kalcij, magnezij, vodikovi kationi, klorovi anioni, sulfatni ioni, bikarbonatni ioni, hidroksidni ioni itd. Koncentracije teh ionov v človeškem telesu so različne. Koncentracije natrijevih in klorovih ionov so na primer zelo pomembne in se dnevno dopolnjujejo. Koncentracije vodikovih ionov in hidroksidnih ionov so zelo nizke, vendar imajo veliko vlogo v življenjskih procesih in prispevajo k normalnemu delovanju encimov, presnovi, prebavi hrane itd.
Disociacija vode.
Vodikova eksponenta
Voda je šibek amfoterni elektrolit. Enačba disociacije vode je:
H 2 O H + + OH -
2H 2 O H 3 O + + OH -.
Koncentracija protonov in hidroksidnih ionov v vodi je enaka in znaša 10–7 mol / l pri 25 ° С.
Zmnožek koncentracij vodikovih ionov in hidroksidnih ionov se imenuje ionski produkt vode in pri 25 ° С je 10 –14.
Okolje katere koli vodne raztopine je lahko označeno s koncentracijo H + ali OH - ionov. Ločite nevtralne, kisle in alkalne raztopine.
V okolju z nevtralno raztopino:
10 -7 mol / l,
v kisli raztopini:
\u003e, tj. \u003e 10 -7 mol / l,
v alkalni raztopini:
\u003e, tj. \u003e 10 –7 mol / l.
Za karakterizacijo raztopinskega medija je primerno uporabiti vrednost pH (tabela 1, glej str. 14). Vodikova eksponenta Je negativni decimalni logaritem koncentracije vodikovih ionov:
pH \u003d –lg.
Med poukom bomo preučevali temo »Elektrolitska disocijacija. Reakcije ionske izmenjave ". Upoštevajte teorijo elektrolitske disociacije in se seznanite z definicijo elektrolitov. Spoznajmo fizikalno in kemijsko teorijo raztopin. Poglejmo si v luči teorije elektrolitske disociacije določanje baz, kislin in soli ter se naučimo, kako sestaviti enačbe reakcij ionske izmenjave in spoznajmo pogoje za njihovo nepovratnost.
Tema: Raztopine in njihove koncentracije, razpršeni sistemi, elektrolitska disociacija
Lekcija: Elektrolitska disocijacija. Reakcije ionske izmenjave
1. Fizikalna in kemijska teorija raztopin
Že na zori preučevanja električnih pojavov so znanstveniki opazili, da lahko ne le kovine, temveč tudi rešitve prevajajo tok. Vendar ne vsi. Torej, vodne raztopine natrijevega klorida in drugih soli, raztopine močnih kislin in alkalij dobro prevajajo tok. Raztopine ocetne kisline, ogljikovega dioksida in žveplovega dioksida ga vodijo veliko slabše. Toda raztopine alkohola, sladkorja in večine drugih organskih spojin sploh ne prevajajo električne energije.
Električni tok je usmerjeno gibanje prostih nabitih delcev... V kovinah to gibanje izvajajo razmeroma prosti elektroni, elektronski plin. Toda ne samo kovine so sposobne voditi električni tok.
Elektroliti - to so snovi, katerih raztopine ali taline prevajajo električni tok.
Neelektroliti - to so snovi, katerih raztopine ali taline ne prevajajo električnega toka.
Za opis električne prevodnosti nekaterih raztopin je treba razumeti, kaj je rešitev. Do konca 19. stoletja sta obstajali dve glavni teoriji rešitev:
· Fizično. Po tej teoriji je rešitev - gre za povsem mehansko mešanico komponent in v njej ni medsebojnih vplivov. Dobro je opisala lastnosti elektrolitov, vendar je imela določene težave pri opisovanju raztopin elektrolitov.
· Kemični. V skladu s to teorijo pri raztapljanju med topljeno topilo pride do kemične reakcije. To potrjuje prisotnost toplotnega učinka pri raztapljanju in sprememba barve. Na primer, ko se raztopi beli brezvodni bakrov sulfat, nastane nasičena modra raztopina.
Resnica je med tema dvema skrajnima točkama. V raztopinah namreč poteka tako kemični kot fizikalni proces.
Slika: 1. Svante Arrhenius
Leta 1887 je švedski fizik - kemik Svante Arrhenius (slika 1), ki je preučeval električno prevodnost vodnih raztopin, predlagal, da se v takih raztopinah snovi razgradijo v nabite delce - ione, ki se lahko premaknejo na elektrode - negativno nabito katodo in pozitivno nabito anodo.
To je razlog za električni tok v rešitvah. Ta proces se imenuje elektrolitska disociacija (dobesedno prevajanje - cepljenje, razgradnja pod vplivom električne energije). To ime tudi nakazuje, da do disociacije pride z delovanjem električnega toka. Nadaljnje študije so pokazale, da temu ni tako: ioni so v raztopini samo nosilci naboja in v njej obstajajo ne glede na to, ali tok teče skozi raztopino ali ne. Z aktivnim sodelovanjem Svanteja Arrheniusa je bila oblikovana teorija elektrolitske disocijacije, ki je pogosto poimenovana po tem znanstveniku. Glavna ideja te teorije je, da se elektroliti pod vplivom topila spontano razgradijo v ione. In prav ti ioni so nosilci naboja in so odgovorni za električno prevodnost raztopine.
2. Glavne določbe teorije elektrolitske disociacije
1. Elektroliti v raztopinah pod delovanjem topila spontano razpadejo v ione. Ta postopek se imenuje elektrolitska disocijacija. Do disociacije lahko pride tudi, ko se stopijo trdni elektroliti.
2. Ioni se od atomov razlikujejo po sestavi in \u200b\u200blastnostih. V vodnih raztopinah so ioni v hidriranem stanju. Ioni v hidriranem stanju se po lastnostih razlikujejo od ionov v plinastem stanju snovi. To je razloženo na naslednji način: kioni in anioni so že v začetku prisotni v ionskih spojinah. Ko se molekula vode raztopi, se začne približevati nabitim ionom: pozitivnemu polu - na negativni ion, negativni pol - na pozitivno. Ioni se imenujejo hidrirani (slika 2).
3. V raztopinah ali talinah elektrolitov se ioni premikajo kaotično, ko pa preide električni tok, se ioni premikajo usmerjeno: kationi na katodo, anioni - na anodo.
3. Baze, kisline, soli v luči teorije elektrolitske disocijacije
V luči teorije elektrolitske disociacije je mogoče baze, kisline in soli opredeliti kot elektrolite.
Temelji- to so elektroliti, katerih posledica disociacije v vodnih raztopinah nastane samo ena vrsta anionov: hidroksid anion: OH-.
NaOH ↔ Na + + OH−
Disociacija baz, ki vsebujejo več hidroksilnih skupin, poteka postopoma:
Ba (OH) 2↔ Ba (OH) + + OH− Prva stopnja
Ba (OH) + ↔ Ba2 + + 2OH - druga stopnja
Ba (OH) 2↔ Ba2 + + 2 OH− Splošna enačba
Kisline - to so elektroliti, zaradi disociacije katerih v vodnih raztopinah nastane samo ena vrsta kationov: H +. Hidrirani proton se imenuje vodikov ion in ima oznako H3O +, vendar je zaradi enostavnosti zapisan H +.
HNO3↔ H + + NO3−
Večbazne kisline se ločijo v korakih:
H3PO4↔ H + + H2PO4- Prva stopnja
H2PO4- ↔ H + + HPO42- Druga stopnja
HPO42-↔ H + + PO43- Tretja stopnja
H3PO4↔ 3H + + PO43-Skupna enačba
Sol - to so elektroliti, ki v vodnih raztopinah disociirajo na kovinske katione in anione kislega ostanka.
Na2SO4 ↔ 2Na + + SO42−
Srednje soli - to so elektroliti, ki v vodnih raztopinah disociirajo na kovinske katione ali amonijeve katione in anione kislega ostanka.
Osnovne soli - to so elektroliti, ki se v vodnih raztopinah disociirajo na kovinske katione, hidroksidne anione in anione kislega ostanka.
Kisle soli - to so elektroliti, ki se v vodnih raztopinah disociirajo na kovinske katione, vodikove katione in kislinske ostanke.
Dvojne soli - to so elektroliti, ki se v vodnih raztopinah disociirajo na katione več kovin in anione kislega ostanka.
KAl (SO4) 2↔ K + + Al3 + + 2SO42
Mešane soli - to so elektroliti, ki v vodnih raztopinah disociirajo na kovinske katione in anione več kislinskih ostankov
4. Močni in šibki elektroliti
Elektrolitska disocijacija v različni meri - postopek je reverzibilen. Toda po raztapljanju nekaterih spojin se ravnotežje disociacije v veliki meri premakne v disociirano obliko. V raztopinah takih elektrolitov disociacija poteka skoraj nepovratno. Zato se pri pisanju enačb za disociacijo takšnih snovi napiše bodisi znak enačbe bodisi ravna puščica, kar pomeni, da je reakcija skoraj nepovratna. Takšne snovi se imenujejo močnaelektroliti.
Šibko imenujejo se elektroliti, pri katerih pride do disociacije rahlo. Pri pisanju uporabite znak povratnosti. Tab. 1.
Za merjenje jakosti elektrolita je bil uveden koncept stopnja elektrolitskedisocijacija.
Moč elektrolita je lahko tudi značilna kemijske ravnotežne konstante disocijacija. Imenuje se disociacijska konstanta.
Dejavniki, ki vplivajo na stopnjo elektrolitske disociacije:
Narava elektrolita
Koncentracija elektrolita v raztopini
· Temperatura
Z naraščanjem temperature in redčenjem raztopine stopnja elektrolitske disociacije narašča. Zato je moč elektrolita mogoče oceniti le s primerjavo pod enakimi pogoji. Za standard se vzameta T \u003d 180C in c \u003d 0,1 mol / L.
5. Reakcije ionske izmenjave
Bistvo reakcije v raztopinah elektrolitov je izraženo z ionsko enačbo. Upošteva dejstvo, da so v eni raztopini prisotni elektroliti v obliki ionov. Šibki elektroliti in nerazdružljive snovi so zabeleženi v obliki, ločeni na ione. Topnosti elektrolita v vodi ni mogoče uporabiti kot merilo njegove trdnosti. Mnoge v vodi netopne soli so močni elektroliti, vendar je koncentracija ionov v raztopini zelo nizka ravno zaradi njihove majhne topnosti. Zato je pri pisanju enačb reakcij s sodelovanjem takih snovi običajno, da jih pišemo v nerazdruženi obliki .
Reakcije v raztopinah elektrolitov potekajo v smeri vezave ionov.
Obstaja več oblik vezave ionov:
1. Nastajanje usedlin
2. Razvoj plina
3. Nastanek šibkega elektrolita.
· 1. Nastanek usedlin:
BaCl2 + Na2CO3 → BaCO3 ↓ + 2NaCl.
Ba2 ++ 2Cl - + 2Na ++ CO32- → BaCO3 ↓ + 2Na ++ 2Cl- popolna ionska enačba
Ba2 + + CO32- → BaCO3 ↓ skrajšana ionska enačba.
Okrajšana ionska enačba kaže, da kadar katera koli topna spojina, ki vsebuje ion Ba2 +, sodeluje s spojino, ki vsebuje karbonatni anion CO32-, je rezultat netopna oborina BaCO3 CO.
· 2. Razvoj plina:
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2 in