Imaju amfoterna svojstva. Svojstva amfoternih metala
Amfoterični spojevi
Hemija je uvijek jedinstvo suprotnosti.
Pogledajte periodni sistem.
Neki elementi (gotovo svi metali koji pokazuju oksidaciona stanja +1 i +2) nastaju glavni oksidi i hidroksidi. Na primer, kalijum stvara oksid K 2 O, a hidroksid KOH. Pokazuju osnovna svojstva, poput interakcije s kiselinama.
K2O + HCl → KCl + H2O
Neki elementi (većina nemetala i metala sa oksidacionim stanjem +5, +6, +7) nastaju kisela oksidi i hidroksidi. Kiseli hidroksidi su kiseline koje sadrže kiseonik, zovu se hidroksidi, jer struktura sadrži hidroksilna grupa, na primjer, sumpor tvori kiseli oksid SO 3 i kiseli hidroksid H 2 SO 4 (sumporna kiselina):

Takva jedinjenja pokazuju kisela svojstva, na primjer, reagiraju s bazama:
H2SO4 + 2KOH → K2SO4 + 2H2O
A postoje elementi koji tvore takve okside i hidrokside koji pokazuju kisela i osnovna svojstva. Ovaj fenomen se naziva amfoternost ... Takvi oksidi i hidroksidi bit će nam fokus u ovom članku. Svi amfoterični oksidi i hidroksidi su čvrste materije, netopive u vodi.
Za početak, kako odrediti da li je oksid ili hidroksid amfoterni? Postoji pravilo, malo uslovno, ali svejedno ga možete koristiti:
Amfoterne hidrokside i okside tvore metali, u oksidacionim stanjima +3 i +4, npr. (Al 2 O 3 , Al(OH) 3 , Fe 2 O 3 , Fe(OH) 3)
I četiri izuzetka:metaliZn , Budi , Pb , Sn tvore slijedeći oksidi i hidroksidi:ZnO , Zn ( OH ) 2 , BeO , Budi ( OH ) 2 , PbO , Pb ( OH ) 2 , SnO , Sn ( OH ) 2 , u kojem pokazuju oksidacijsko stanje +2, ali uprkos tome, ovi spojevi pokazuju amfoterna svojstva .
Najčešći amfoterični oksidi (i njihovi odgovarajući hidroksidi): ZnO, Zn (OH) 2, BeO, Be (OH) 2, PbO, Pb (OH) 2, SnO, Sn (OH) 2, Al 2 O 3, Al (OH) 3, Fe 2 O 3, Fe (OH) 3, Cr 2 O 3, Cr (OH) 3.
Svojstva amfoternih spojeva nije teško zapamtiti: oni međusobno djeluju kiseline i lužine.
- s interakcijom s kiselinama, sve je jednostavno, u tim reakcijama amfoterni spojevi se ponašaju kao osnovni:
Al 2 O 3 + 6HCl → 2AlCl 3 + 3H 2 O
ZnO + H 2 SO 4 → ZnSO 4 + H 2 O
BeO + HNO 3 → Be (NO 3) 2 + H 2 O
Hidroksidi reagiraju na isti način:
Fe (OH) 3 + 3HCl → FeCl 3 + 3H 2 O
Pb (OH) 2 + 2HCl → PbCl 2 + 2H 2 O
- Interakcija s lužinama je malo složenija. U tim se reakcijama amfoterni spojevi ponašaju poput kiselina, a produkti reakcije mogu biti različiti, sve ovisi o uvjetima.
Ili se reakcija odvija u otopini, ili se reaktanti uzimaju čvrste i sjedinjene.
Interakcija osnovnih jedinjenja sa amfoternim jedinjenjima tokom fuzije.
Pogledajmo primjer cink hidroksida. Kao što je ranije spomenuto, amfoterni spojevi komuniciraju s baznim i ponašaju se poput kiselina. Pa napišimo cink hidroksid Zn (OH) 2 kao kiselinu. Kiselina ima vodonik sprijeda, mi ga vadimo: H 2 ZnO 2. A reakcija lužine s hidroksidom nastavit će se kao da je riječ o kiselini. "Kiseli ostatak" ZnO 2 2 - dvovalentni:
2K OH (tv.) + H 2 ZnO 2 (čvrsta supstanca) (t, fuzija) → K 2 ZnO 2 + 2 H 2 O
Dobivena supstanca K 2 ZnO 2 naziva se kalijum metazinkat (ili jednostavno kalijum cinkat). Ova supstanca je sol kalijuma i hipotetska "cinkova kiselina" H 2 ZnO 2 (nije u potpunosti ispravno takve spojeve nazivati \u200b\u200bsolima, ali zbog vlastite pogodnosti zaboravit ćemo na to). Samo cink hidroksid treba pisati ovako: H 2 ZnO 2 nije dobar. Zn (OH) 2 pišemo kao i obično, ali mislimo (iz vlastitih razloga) da je "kiselina":
2KOH (s) + Zn (OH) 2 (s) (t, fuzija) → K 2 ZnO 2 + 2H 2 O
S hidroksidima, u kojima postoje 2 OH skupine, sve će biti isto kao i s cinkom:
Be (OH) 2 (s) + 2NaOH (s) (t, fuzija) → 2H 2 O + Na 2 BeO 2 (natrijum metaberilat ili berilat)
Pb (OH) 2 (tv.) + 2NaOH (tv.) (T, fuzija) → 2H 2 O + Na 2 PbO2 (natrijum metaplumbat, ili plumbat)
Amfoterični hidroksidi sa tri OH grupe (Al (OH) 3, Cr (OH) 3, Fe (OH) 3) malo se razlikuju.
Analizirajmo na primjeru aluminijumskog hidroksida: Al (OH) 3, napišimo ga u obliku kiseline: H 3 AlO 3, ali ga ne ostavljamo u ovom obliku, već odatle vadimo vodu:
H 3 AlO 3 - H 2 O → HAlO 2 + H 2 O.
Radimo sa ovom „kiselinom“ (HAlO 2):
HAlO 2 + KOH → H 2 O + KAlO 2 (kalijum meta-aluminat, ili jednostavno aluminat)
Ali aluminijum hidroksid se ne može zapisati kao ovaj HAlO 2, zapisujemo ga kao i obično, ali tu mislimo na "kiselinu":
Al (OH) 3 (s) + KOH (s) (t, fuzija) → 2H 2 O + KAlO 2 (kalijum metaaluminat)
Isto je i sa hrom hidroksidom:
Cr (OH) 3 → H 3 CrO 3 → HCrO 2
Cr (OH) 3 (s) + KOH (s) (t, fuzija) → 2H 2 O + KCrO 2 (kalijum metakromat,
ALI NE KROMAT, hromati su soli hromske kiseline).
Sa hidroksidima koji sadrže četiri OH grupe, vrijedi isto: pomičemo vodik naprijed i uklanjamo vodu:
Sn (OH) 4 → H 4 SnO 4 → H 2 SnO 3
Pb (OH) 4 → H 4 PbO 4 → H 2 PbO 3
Treba imati na umu da olovo i kositar čine po dva amfoterna hidroksida: sa oksidacionim stanjem +2 (Sn (OH) 2, Pb (OH) 2) i +4 (Sn (OH) 4, Pb (OH) 4).
A ovi hidroksidi će formirati različite "soli":
|
Stanje oksidacije |
||||
|
Formula hidroksida |
|
|
|
|
|
Hidroksid Formula kiselina |
H 2 SnO 2 |
H 2 PbO 2 |
H 2 SnO 3 |
H 2 PbO 3 |
|
Sol (kalijum) |
K 2 SnO 2 |
K 2 PbO 2 |
K 2 SnO 3 |
K 2 PbO 3 |
|
Ime soli |
metastannAT |
metablumbAT |
||
Isti principi kao u imenima običnih "soli", element u najvišem oksidacijskom stanju je AT sufiks, u srednjem - IT.
Takve "soli" (metakromati, metaaluminati, metaberilati, metacinkati itd.) Se dobijaju ne samo kao rezultat interakcije alkalija i amfoternih hidroksida. Ovi spojevi se uvijek stvaraju kada jako osnovni "svijet" i amfoterni (kada se stapaju) dođu u kontakt. Odnosno, poput amfoternih hidroksida, amfoterni oksidi i soli metala koji tvore amfoterne okside (soli slabih kiselina) reagirat će s lužinama. I umjesto lužine, možete uzeti jako bazični oksid i sol metala koja tvori lužinu (sol slaba kiselina).

Interakcije:
Zapamtite, reakcije u nastavku odvijaju se tokom fuzije.
Amfoterični oksid sa jakim osnovnim oksidom:
ZnO (čvrsta supstanca) + K 2 O (čvrsta supstanca) (t, fuzija) → K 2 ZnO 2 (kalijum metazinkat ili samo kalijum cinkat)
Amfoterični oksid s lužinom:
ZnO (s) + 2KOH (s) (t, fuzija) → K 2 ZnO 2 + H 2 O
Amfoterični oksid sa soli slabe kiseline i metalom koji formira lužinu:
ZnO (s) + K 2 CO 3 (s) (t, fuzija) → K 2 ZnO 2 + CO 2
Jaki bazični oksid amfoterni hidroksid:
Zn (OH) 2 (s) + K 2 O (s) (t, fuzija) → K 2 ZnO 2 + H 2 O
Amfoterični hidroksid s lužinom:
Zn (OH) 2 (s) + 2KOH (s) (t, fuzija) → K 2 ZnO 2 + 2H 2 O
Amfoterični hidroksid sa soli slabe kiseline i metalom koji formira lužinu:
Zn (OH) 2 (s) + K 2 CO 3 (s) (t, fuzija) → K 2 ZnO 2 + CO 2 + H 2 O
Soli slabe kiseline i metala koji tvore amfoterni spoj sa jako bazičnim oksidom:
ZnCO 3 (s) + K 2 O (s) (t, fuzija) → K 2 ZnO 2 + CO 2
Soli slabe kiseline i metala koji tvore amfoterni spoj s lužinom:
ZnCO 3 (s) + 2KOH (s) (t, fuzija) → K 2 ZnO 2 + CO 2 + H 2 O
Soli slabe kiseline i metal koji tvori amfoterni spoj sa solju slabe kiseline i metal koji tvori lužinu:
ZnCO 3 (s) + K 2 CO 3 (s) (t, fuzija) → K 2 ZnO 2 + 2CO 2
Ispod su informacije o solima amfoternih hidroksida, najčešće u SAD-u, označene crvenom bojom.
|
Hidroksid |
Hidroksid kao kiselina |
Kiseli ostatak |
Ime soli |
||
|
BeO |
Budi (OH) 2 |
H 2 BeO 2 |
BeO 2 2- |
K 2 BeO 2 |
Metaberilat (berilat) |
|
ZnO |
Zn (OH) 2 |
H 2 ZnO 2 |
ZnO 2 2- |
K 2 ZnO 2 |
Metazinkat (cink) |
|
Al 2 O 3 |
Al (OH) 3 |
HAlO 2 |
AlO 2 — |
KAlO 2 |
Metaaluminat (aluminat) |
|
Fe 2 O 3 |
Fe (OH) 3 |
HFeO 2 |
FeO 2 - |
KFeO 2 |
Metaferrat (ALI NE FERAT) |
|
Sn (OH) 2 |
H 2 SnO 2 |
SnO 2 2- |
K 2 SnO 2 |
||
|
Pb (OH) 2 |
H 2 PbO 2 |
PbO 2 2- |
K 2 PbO 2 |
||
|
SnO 2 |
Sn (OH) 4 |
H 2 SnO 3 |
SnO 3 2- |
K 2 SnO 3 |
MetastannAT (stannate) |
|
PbO 2 |
Pb (OH) 4 |
H 2 PbO 3 |
PbO 3 2- |
K 2 PbO 3 |
Metablumbat (plumbat) |
|
Cr 2 O 3 |
Cr (OH) 3 |
HCrO 2 |
CrO 2 - |
KCrO 2 |
Metakromat (ALI NE KROMAT) |
Interakcija amfoternih spojeva sa lužnatim rastvorima (ovdje samo lužine).
Na Jedinstvenom državnom ispitu to se naziva „rastvaranje alkalijskih aluminijum hidroksida (cinka, berilija, itd.)“. To je zbog sposobnosti metala u sastavu amfoternih hidroksida u prisustvu viška hidroksidnih jona (u alkalnom mediju) da vežu te ione za sebe. Čestica je formirana s metalom (aluminij, berilij, itd.) U središtu, koji je okružen hidroksidnim ionima. Ova čestica postaje negativno nabijena (anion) zbog hidroksidnih jona, a taj će se jon nazvati hidroksoaluminat, hidroksizinkat, hidroksiberilat, itd. Štoviše, postupak se može odvijati na različite načine; metal može biti okružen različitim brojem hidroksidnih jona.
Razmotrit ćemo dva slučaja: kada je metal okružen četiri hidroksidna jonai kad je okružen šest hidroksidnih jona.
Zapišimo skraćenu jonsku jednadžbu ovih procesa:
Al (OH) 3 + OH - → Al (OH) 4 -
Rezultirajući ion naziva se tetrahidroksoaluminatni jon. Dodaje se prefiks "tetra-" jer postoje četiri hidroksidna jona. Tetrahidroksoaluminatni jon ima naboj - budući da aluminij ima naboj od 3+, a četiri hidroksidna iona su 4-, ukupni je -.
Al (OH) 3 + 3OH - → Al (OH) 6 3-
Jon koji nastaje u ovoj reakciji naziva se heksahidroksoaluminatni jon. Dodaje se prefiks "hexo" jer je hidroksidni jon šest.
Obavezno je dodati prefiks koji označava količinu hidroksidnih jona. Jer ako samo napišete "hidroksoaluminat", nije jasno na koji jon mislite: Al (OH) 4 - ili Al (OH) 6 3-.
Kada alkalije stupe u interakciju s amfoternim hidroksidom, u otopini nastaje sol. Kation koji je alkalni kation, a anion složeni jon, čiji smo nastanak razmatrali ranije. Anion je uglate zagrade.
Al (OH) 3 + KOH → K (kalijum tetrahidroksoaluminat)
Al (OH) 3 + 3KOH → K 3 (kalijum heksahidroksoaluminat)
Kakvu vrstu (heksa- ili tetra-) soli pišete kao proizvod nije bitno. Čak je i kod ispitanika na ispitu zapisano: "... K 3 (formiranje K je dozvoljeno." Glavno je osigurati da su svi indeksi pravilno stavljeni. Pratite optužbe i imajte na umu da njihov zbroj treba biti nula.
Pored amfoternih hidroksida, amfoterni oksidi reagiraju i s lužinama. Proizvod će biti isti. Samo ako reakciju napišete ovako:
Al 2 O 3 + NaOH → Na
Al 2 O 3 + NaOH → Na 3
Ali ove reakcije se neće izjednačiti. Potrebno je dodati vodu s lijeve strane, jer se interakcija odvija u otopini, vode ima dovoljno i sve će se izjednačiti:
Al 2 O 3 + 2NaOH + 3H 2 O → 2Na
Al 2 O 3 + 6NaOH + 3H 2 O → 2Na 3
Pored amfoternih oksida i hidroksida, neki posebno aktivni metali stupaju u interakciju sa alkalnim rastvorima koji tvore amfoterna jedinjenja. Naime: aluminij, cink i berilij. Da bi se izjednačilo, lijeva takođe treba vodu. Osim toga, glavna razlika između ovih procesa je oslobađanje vodika:
2Al + 2NaOH + 6H2O → 2Na + 3H 2
2Al + 6NaOH + 6H 2 O → 2Na 3 + 3H 2
Tabela u nastavku prikazuje najčešće primjere svojstava amfoternih spojeva u ispitu:
|
Amfoterična supstanca |
Ime soli |
||
|
Al 2 O 3 Al (OH) 3 |
Natrijum tetrahidroksoaluminat |
Al (OH) 3 + NaOH → Na Al 2 O 3 + 2NaOH + 3H 2 O → 2Na 2Al + 2NaOH + 6H 2 O → 2Na + 3H 2 |
|
|
Na 3 |
Natrijum heksahidroksoaluminat |
Al (OH) 3 + 3NaOH → Na 3 Al 2 O 3 + 6NaOH + 3H 2 O → 2Na 3 2Al + 6NaOH + 6H 2 O → 2Na 3 + 3H 2 |
|
|
Zn (OH) 2 |
K 2 |
Natrijum tetrahidroksozinkat |
Zn (OH) 2 + 2NaOH → Na 2 ZnO + 2NaOH + H 2 O → Na 2 Zn + 2NaOH + 2H 2 O → Na 2 + H 2 |
|
K 4 |
Natrijum heksahidroksozinkat |
Zn (OH) 2 + 4NaOH → Na 4 ZnO + 4NaOH + H 2 O → Na 4 Zn + 4NaOH + 2H 2 O → Na 4 + H 2 |
|
|
Budi (OH) 2 |
Li 2 |
Litijum tetrahidroksoberilat |
Budi (OH) 2 + 2LiOH → Li 2 BeO + 2LiOH + H 2 O → Li 2 Budite + 2LiOH + 2H 2 O → Li 2 + H 2 |
|
Li 4 |
Litij heksahidroksoberilat |
Budi (OH) 2 + 4LiOH → Li 4 BeO + 4LiOH + H 2 O → Li 4 Budite + 4LiOH + 2H 2 O → Li 4 + H 2 |
|
|
Cr 2 O 3 Cr (OH) 3 |
Natrijum tetrahidroksohromat |
Cr (OH) 3 + NaOH → Na Cr 2 O 3 + 2NaOH + 3H 2 O → 2Na |
|
|
Na 3 |
Natrijum heksahidroksohromat |
Cr (OH) 3 + 3NaOH → Na 3 Cr 2 O 3 + 6NaOH + 3H 2 O → 2Na 3 |
|
|
Fe 2 O 3 Fe (OH) 3 |
Natrijum tetrahidroksoferat |
Fe (OH) 3 + NaOH → Na Fe 2 O 3 + 2NaOH + 3H 2 O → 2Na |
|
|
N / A 3 |
Natrijum heksahidroksoferat |
Fe (OH) 3 + 3NaOH → Na 3 Fe 2 O 3 + 6NaOH + 3H 2 O → 2Na 3 |
Soli dobivene u ovim interakcijama reagiraju s kiselinama, tvoreći dvije druge soli (soli ove kiseline i dva metala):
2Na 3 + 6H 2 TAKO 4 → 3Na 2 TAKO 4 + Al 2 (SO 4 ) 3 + 12H 2 O
To je sve! Ništa komplicirano. Glavna stvar je da se ne zbunite, sjetite se što nastaje tijekom fuzije, što je u otopini. Vrlo često se naiđu zadaci po ovom pitanju B dijelova.
Amfoterični oksidi reagiraju s jakim kiselinama stvarajući soli tih kiselina. Takve reakcije manifestacija su glavnih svojstava amfoternih oksida, na primjer:
ZnO + H 2 SO 4 → ZnSO 4 + H 2 O
Oni također reagiraju s jakim lužinama, pokazujući na taj način svoja kisela svojstva, na primjer:
ZnO + 2NaOH → Na 2 ZnO 2 + H 2 O Amfoterični oksidi mogu reagirati s lužinama na dva načina: u otopini i u talini.
- Kada reaguje s lužinom u talini, stvara se uobičajena srednja sol (kao što je prikazano u gornjem primjeru).
- Nakon reakcije s lužinom, u otopini nastaje složena sol.
Al 2 O 3 + 2NaOH + 3H 2 O → 2Na (U ovom slučaju nastaje natrijum tetrahidroksoaluminat)
Svaki amfoterni metal ima svoj koordinacijski broj. Za Be i Zn je 4; Za Al je 4 ili 6; Za Cr je ovo 6 ili (vrlo rijetko) 4;
Amfoterični oksidi se obično ne rastvaraju u vodi i ne reagiraju s njom.
Primjeri
vidi takođe
Fondacija Wikimedia. 2010.
Pogledajte što su "amfoterični oksidi" u drugim rječnicima:
Metalni oksidi su jedinjenja metala sa kiseonikom. Mnogi od njih mogu se kombinirati s jednim ili više molekula vode da bi stvorili hidrokside. Većina oksida su bazični, jer se njihovi hidroksidi ponašaju kao baze. Međutim, neki ... ... Službena terminologija
OKSIDI, anorganska jedinjenja u kojima je KISIK vezan za drugi element. Oksidi se često stvaraju kada element sagorijeva u zraku ili u prisustvu kisika. Dakle, magnezijum (Mg) tokom sagorevanja stvara magnezijum-oksid (MgO). Oksidi su ... ... Naučno-tehnički enciklopedijski rječnik
Oksid (oksid, oksid) binarni spoj hemijski element s kisikom u oksidacijskom stanju -2, u kojem je sam kisik vezan samo za manje elektronegativni element. Hemijski element kisik je drugi u elektronegativnosti ... ... Wikipedia
Amfoterični hidroksidi su anorganski spojevi, hidroksidi amfoternih elemenata, ovisno o uvjetima, koji pokazuju svojstva kiselih ili baznih hidroksida. Sadržaj 1 Opšta svojstva 2 Dobivanje ... Wikipedije
oksidi - Kombinacija hemijskog elementa sa kisikom. Prema svojim hemijskim svojstvima svi oksidi se dijele na soli koji tvore soli (na primjer, Na2O, MgO, Al2O3, SiO2, P2O5, SO3, Cl2O7) i ne-soli (na primjer CO, N2O, NO, H2O). Oksidi koji stvaraju sol podijeljeni su u ... ... Vodič za tehničkog prevodioca
OKSIDI - hem. spojevi elemenata sa kiseonikom (stari naziv su oksidi); jedna od najvažnijih klasa hemije. supstance. O. nastaju najčešće tokom direktne oksidacije jednostavnih i složenih supstanci. Pr. tokom oksidacije ugljovodonika nastaju O. ... ... Velika politehnička enciklopedija
Spojevi elemenata sa kiseonikom. U O. je stanje oksidacije atoma kiseonika H2. O. uključuje sve veze. elementi s kisikom, osim što sadrže O-atome, međusobno povezane (peroksidi, superoksidi, ozonidi) i komp. fluor sa kiseonikom ... ... Hemijska enciklopedija
Oksidi, oksidi, hemijska jedinjenja elementi sa kisikom. By chem. Svi O. dijele se na one koji stvaraju sol i one koji ne stvaraju sol. O. koji oblikuju sol dijele se na bazične, kisele i amfoterne (proizvodi njihove interakcije s vodom su ... ... Veliki enciklopedijski politehnički rječnik
Osnovni oksidi su oksidi 1, 2 i nekih 3 valentna metala. Tu spadaju: metalni oksidi glavne podskupine prve grupe (alkalni metali) Li Fr oksidi metala glavne podskupine druge grupe (zemnoalkalijski metali) ... ... Wikipedia
Oksidi koji ne stvaraju sol - oksidi koji ne pokazuju kisela, bazična ili amfoterna svojstva i ne tvore soli. Prije su se takvi oksidi nazivali ravnodušnim ili ravnodušnim, ali to nije istina, jer su po svojoj hemijskoj prirodi podaci ... Wikipedia
Ova jedinjenja mogu komunicirati s bazama i kiselinama. Takva svojstva imaju prijelazni metali i elementi bočnih skupina. Metali ove vrste i njihove legure odlikuju se nizom jedinstvenih svojstava, zbog kojih se široko koriste u mnogim industrijama.
Takvi metali lako stupaju u interakciju s lužinom i kiselinom, praktički se ne rastvaraju u vodi i lako se obrađuju. Ponašanje amfoternih jedinjenja tokom hemijske reakcije ovisi o svojstvima otapala i uvjetima za njegovu primjenu, prirodi reagensa i raznim drugim faktorima.
Najčešći metali sa hemijskom dualnošću su aluminijum, cink i hrom.
Amfoterične legure odlikuju se velikom čvrstoćom i dobrom duktilnošću. Također se odlikuju mekim magnetnim ponašanjem, malim zvučnim gubicima i visokim električnim otporom. Neki amfoterni metali su vrlo otporni na koroziju. Amfoterične legure se hladno valjaju u foliju čak i na sobnoj temperaturi.
Primjena amfoternih materijala
Metalne naočale na bazi Ni, Fe i Co spadaju u najtrajnije materijale. Amfoterične legure metala često se koriste za proizvodnju proizvoda koji dolaze u kontakt s agresivnim okolišem. Koriste se u proizvodnji kablova i za ojačanje cijevi visokog pritiska, u proizvodnji metalnih elemenata guma i raznih konstrukcija, čiji rad uključuje potapanje u morsku vodu.
Metali sa dvostrukim hemijskim svojstvima široko se koriste za proizvodnju opruga za pomicanje sata, seizmičkih senzora, vaga, senzora momenta i brzine i indikatora biranja.
Mnogi predmeti za domaćinstvo izrađeni su od amfoterne trake: mjere vrpce, pribor za jelo, razni sudovi, oštrice. Jedinstvene legure takođe su pronašle primenu u raznoj opremi za snimanje zvuka i videa.
Vremenom se pojavljuje sve više novih hemijskih spojeva s amfoternim svojstvima. Takvi se materijali s pravom smatraju materijalima budućnosti, ali njihovu široku distribuciju ometa niz određenih čimbenika: mala veličina nastalih proizvoda (trake i žice), visoka cijena jedinstvenih legura i niska zavarljivost nekih elemenata.
Amfoterični metali su jednostavne supstance koje su strukturno, kemijske i slične metalnoj skupini elemenata. Sami po sebi, metali ne mogu pokazivati \u200b\u200bamfoterna svojstva, za razliku od njihovih jedinjenja. Na primjer, oksidi i hidroksidi nekih metala imaju dvojaku hemijsku prirodu - u nekim se uvjetima ponašaju poput kiselina, dok u drugima imaju svojstva lužina.
Glavni amfoterni metali su aluminijum, cink, hrom, gvožđe. Berilij i stroncij mogu se odnositi na istu grupu elemenata.
amfoternost?
Ovo je svojstvo prvi put otkriveno prilično davno. A pojam "amfoterični elementi" uveli su u znanost 1814. godine poznati kemičari L. Thénard i J. Gay-Lussac. U ona vremena hemijska jedinjenja bio je običaj da se tijekom reakcija dijele u grupe koje su odgovarale njihovim osnovnim svojstvima.
Međutim, grupa oksida i baza imala je dvostruku moć. U nekim su se uvjetima takve supstance ponašale poput lužina, dok su se u drugim, naprotiv, ponašale poput kiselina. Tako je nastao pojam "amfoternost". Za to ponašanje tijekom kiselinsko-bazne reakcije ovisi o uvjetima njezine provedbe, prirodi reagensa koji su uključeni, a također i o svojstvima otapala.
Zanimljivo je da u prirodnim uvjetima amfoterni metali mogu komunicirati i s lužinom i kiselinom. Na primjer, tijekom reakcije aluminija s aluminijevim sulfatom nastaje. A kada isti metal reagira s koncentriranom lužinom, nastaje složena sol.
Amfoterijske baze i njihova glavna svojstva
U normalnim uslovima to su čvrste materije. Oni su praktično netopivi u vodi i smatraju se prilično slabim elektrolitima.
Glavna metoda za pripremu takvih baza je reakcija metalne soli s malom količinom lužine. Reakcija taloženja mora se provoditi polako i pažljivo. Na primjer, kada primate cinkov hidroksid u epruvetu s cinkovim kloridom, pažljivo dodajte kaustičnu soda u kapima. Svaki put lagano protresite posudu da vidite bijeli talog metala na dnu posude.
S kiselinama i amfoternim tvarima reagiraju kao baze. Na primjer, kada cinkov hidroksid reagira sa klorovodičnom kiselinom, nastaje cinkov klorid.
Ali tijekom reakcija s bazama, amfoterne baze ponašaju se poput kiselina.
Uz to, pri jakom zagrijavanju, oni se raspadaju stvarajući odgovarajući amfoterni oksid i vodu.
Najčešći amfoterični metali su: kratak opis
Cink pripada grupi amfoternih elemenata. I premda su se legure ove supstance široko koristile u drevnim civilizacijama, uspjele su je izolirati u čistom obliku tek 1746. godine.
Čisti metal je prilično krhka plavičasta supstanca. U zraku cink brzo oksidira - površina mu se potamni i pokrije tankim oksidnim filmom.
U prirodi cink postoji uglavnom u obliku minerala - cinkita, smitsonita, kalamita. Najpoznatija supstanca je cinkova mješavina koja se sastoji od cinkovog sulfida. Najveća nalazišta ovog minerala nalaze se u Boliviji i Australiji.
Aluminijum danas se smatra najrasprostranjenijim metalom na planeti. Njegove se legure koriste već stoljećima, a 1825. supstanca je izolirana u svom najčišćem obliku.
Čisti aluminij je lagan, srebrnast metal. Lako je obrađivati \u200b\u200bi lijevati. Ovaj element ima visoku električnu i toplotnu provodljivost. Osim toga, ovaj metal otporan na koroziju. Činjenica je da je njegova površina prekrivena tankim, ali vrlo otpornim oksidnim filmom.
Danas se aluminij široko koristi u industriji.
13.1. Definicije
Tradicionalno, najvažnije klase anorganskih supstanci uključuju jednostavne supstance (metali i nemetali), okside (kisele, bazične i amfoterne), hidrokside (dio kiselina, baza, amfoterni hidroksidi) i soli. Supstance koje pripadaju istoj klasi imaju slična hemijska svojstva. Ali već znate da se prilikom razlikovanja ovih klasa koriste različiti klasifikacijski znakovi.
U ovom ćemo paragrafu konačno formulirati definicije svih najvažnijih klasa hemijskih supstanci i vidjeti kako se te klase razlikuju.
Krenimo sa jednostavne supstance
(klasifikacija prema broju elemenata koji čine supstancu). Obično se dijele na metalii nemetali(sl. 13.1- a).
Već znate definiciju "metal".
Iz ove se definicije može vidjeti da je glavna karakteristika koja nam omogućava podijeliti jednostavne supstance na metale i nemetale vrsta hemijska veza.
U većini nemetala veza je kovalentna. Ali postoje i plemeniti gasovi (jednostavne supstance elemenata grupe VIIIA), čiji su atomi u čvrstom i tečnom stanju povezani samo intermolekularnim vezama. Otuda i definicija.
Prema njihovim hemijskim svojstvima, grupa tzv amfoterni metali.Ovo ime odražava sposobnost ovih metala da reagiraju i s kiselinama i s lužinama (kao amfoterni oksidi ili hidroksidi) (slika 13.1- b).
Pored toga, zbog hemijske inertnosti izolirani su metali plemeniti metali.Tu spadaju zlato, rutenij, rodijum, paladij, osmijum, iridijum, platina. Tradicionalno, malo reaktivnije srebro naziva se i plemenitim metalima, ali takvi inertni metali poput tantala, niobija i nekih drugih nisu uključeni. Postoje i druge klasifikacije metala, na primjer, u metalurgiji su svi metali podijeljeni na crno i obojeno,klasificiranje željeza i njegovih legura kao željeznih metala.
Of složene supstance
najvažnije su, prije svega, oksidi (vidi § 2.5), ali budući da njihova klasifikacija uzima u obzir kiselinsko-bazna svojstva ovih spojeva, prvo se prisjećamo čega kiselina i osnova.
Dakle, izolujemo kiseline i baze iz ukupne mase spojeva, koristeći dvije osobine: sastav i hemijska svojstva.
Po sastavu, kiseline se dijele na oksigenirano
(okso kiseline) i anoksičan(sl. 13.2).

Treba imati na umu da su kiseline koje sadrže kiseonik strukturno hidroksidi.
Bilješka. Tradicionalno, za anoksične kiseline, riječ "kiselina" koristi se kada dolazi o otopini odgovarajuće pojedinačne tvari, na primjer: tvar HCl naziva se hidrogen-klorid, a njena vodena otopina naziva se klorovodična ili klorovodična kiselina.
Vratimo se sada oksidima. Okside smo svrstali u grupu kiselaili majorekako reagiraju s vodom (ili time što su dobiveni iz kiselina ili baza). Ali ne reagiraju svi oksidi s vodom, ali većina njih reagira s kiselinama ili lužinama, pa je okside bolje klasificirati prema ovom svojstvu.
Postoji nekoliko oksida koji u normalnim uvjetima ne reagiraju s kiselinama ili lužinama. Takvi oksidi se nazivaju koji ne stvara sol... To su, na primjer, CO, SiO, N2O, NO, MnO2. Nasuprot tome, nazivaju se preostali oksidi oblikovanje soli(sl. 13.3).

Kao što znate, većini kiselina i baza pripada hidroksidi... Prema sposobnosti hidroksida da reagiraju sa kiselinama i lužinama, među njima (kao i među oksidima), amfoterni hidroksidi(sl. 13.4).

Sada ostaje da definiramo soli... Pojam "sol" koristi se već duže vrijeme. Kako se nauka razvijala, njeno značenje je više puta mijenjano, proširivano i dorađivano. U modernom smislu, sol je jonski spoj, ali tradicionalno soli ne uključuju jonske okside (jer se nazivaju osnovni oksidi), jonske hidrokside (baze), kao i jonske hidride, karbide, nitride itd. Stoga se može pojednostaviti reći da
Može se dati još jedna, preciznija definicija soli.
S obzirom na ovu definiciju, oksonijeve soli se obično nazivaju solima i kiselinama.
Soli se obično dele na kiselo,
prosjek i glavni (sl. 13.5).
Odnosno, sastav anjona kiselih soli uključuje atome vodonika povezane kovalentnim vezama sa ostalim atomima aniona i sposobni da se odvoje pod dejstvom baza.
Osnovne soli su obično vrlo složene i često su netopive u vodi. Tipičan primjer osnovne soli je malahitni mineral Cu 2 (OH) 2 CO 3.

Kao što vidite, najvažnije klase hemikalija razlikuju se prema različitim kriterijima klasifikacije. Ali na bilo kojoj osnovi da razlikujemo klasu supstanci, sve supstance ove klase imaju zajednička hemijska svojstva.
U ovom ćete poglavlju naučiti o najkarakterističnijim hemijskim svojstvima ovih klasa supstanci i najvažnijim metodama njihovog dobivanja.
METALI, NEMETALI, AMFOTERNI METALI, KISELINE, BAZE, OKSIDI, KISELINE BEZ ANCIDA, OSNOVNI OKSIDI, KISELINSKI OKSIDI, AMFOTERNI OKSIDI, AMFOTERNI HIDROKSIDI, OKSIDI
1. Gdje su u prirodnom sustavu elemenata elementi koji tvore metale, a gdje elementi koji tvore nemetale?
2. Napišite formule za pet metala i pet nemetala.
3. Sastavite strukturne formule sljedećih spojeva:
(H 3 O) Cl, (H 3 O) 2 SO 4, HCl, H 2 S, H 2 SO 4, H 3 PO 4, H 2 CO 3, Ba (OH) 2, RbOH.
4. Koji oksidi odgovaraju sljedećim hidroksidima:
H2SO4, Ca (OH) 2, H3PO4, Al (OH) 3, HNO3, LiOH?
Kakva je priroda (kisela ili bazična) svakog od ovih oksida?
5. Pronađite soli među sljedećim supstancama. Sastaviti njihove strukturne formule.
KNO 2, Al 2 O 3, Al 2 S 3, HCN, CS 2, H 2 S, K 2, SiCl 4, CaSO 4, AlPO 4
6. Napravite strukturne formule sljedećih kiselih soli:
NaHSO 4, KHSO 3, NaHCO 3, Ca (H 2 PO 4) 2, CaHPO 4.
13.2. Metali
U metalnim kristalima i njihovim rastopima atomska jezgra povezana su jednim elektronskim oblakom metalne veze. Poput jednog atoma elementa koji čini metal, kristal metala ima sposobnost doniranja elektrona. Tendencija metala da daruje elektrone ovisi o njegovoj strukturi i, prije svega, o veličini njegovih atoma: što su veća atomska jezgra (odnosno veći su jonski radijusi), to metal lakše donira elektrone.
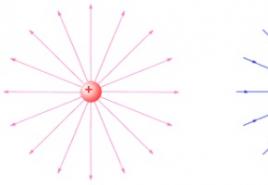
Metali su jednostavne supstance, pa je stanje oksidacije atoma u njima 0. Ulazeći u reakcije, metali gotovo uvijek mijenjaju stanje oksidacije svojih atoma. Atomi metala, koji nemaju tendenciju da prihvate elektrone, mogu ih samo donirati ili socijalizirati. Elektronegativnost ovih atoma je mala, pa čak i kada tvore kovalentne veze, atomi metala dobivaju pozitivno stanje oksidacije. Prema tome, svi metali, u jednom ili drugom stepenu, pokazuju restorativna svojstva... Oni reagiraju:
1) C nemetali (ali ne svi i ne svi):
4Li + O 2 \u003d 2Li 2 O,
3Mg + N2 \u003d Mg 3 N2 (kada se zagrije),
Fe + S \u003d FeS (kada se zagrijava).
Najaktivniji metali lako reagiraju s halogenima i kiseonikom, a samo litijum i magnezijum reagiraju s vrlo jakim molekulima dušika.
Reagujući sa kiseonikom, većina metala stvara okside, a najaktivniji - peroksidi (Na 2 O 2, BaO 2) i druga složenija jedinjenja.
2) C oksidi manje aktivni metali:
2Ca + MnO 2 \u003d 2CaO + Mn (kada se zagrije),
2Al + Fe 2 O 3 \u003d Al 2 O 3 + 2Fe (sa predgrevanjem).
Mogućnost odvijanja ovih reakcija određuje se općim pravilom (redoks reakcije odvijaju se u smjeru stvaranja slabijeg oksidansa i redukcijskog sredstva) i ovisi ne samo o aktivnosti metala (aktivniji, odnosno metal koji lakše predaje svoje elektrone, vraća manje aktivni metal), već i o energiji kristalne rešetke oksida ( reakcija se odvija u smjeru stvaranja "jačeg" oksida).
3) C kisele otopine (§ 12.2):
Mg + 2H 3 O \u003d Mg 2B + H 2 + 2H 2 O, Fe + 2H 3 O \u003d Fe 2 + H 2 + 2H 2 O,
Mg + H2SO4p \u003d MgSO4p + H2, Fe + 2HCl p \u003d FeCl 2p + H2.
U ovom slučaju, mogućnost reakcije lako se utvrđuje nizom naprezanja (reakcija se nastavlja ako je metal u nizu napona lijevo od vodika).
4) C rastvori soli (§ 12.2):
Fe + Cu 2 \u003d Fe 2 + Cu, Cu + 2Ag \u003d Cu 2 + 2Ag,
Fe + CuSO 4p \u003d Cu + FeSO 4p, Cu + 2AgNO 3p \u003d 2Ag + Cu (NO 3) 2p.
Brojni naponi se koriste i za određivanje mogućnosti reakcije.
5) Pored toga, najaktivniji metali (alkali i zemno alkalijska zemlja) reaguju s vodom (§ 11.4):
2Na + 2H 2 O \u003d 2Na + H 2 + 2OH, Ca + 2H 2 O \u003d Ca 2 + H 2 + 2OH,
2Na + 2H 2 O \u003d 2NaOH p + H 2, Ca + 2H 2 O \u003d Ca (OH) 2p + H 2.
U drugoj reakciji moguće je stvaranje taloga Ca (OH) 2.
Većina metala u industriji uzmi,redukcija njihovih oksida:
Fe 2 O 3 + 3CO \u003d 2Fe + 3CO 2 (na visokoj temperaturi),
MnO 2 + 2C \u003d Mn + 2CO (na visokoj temperaturi).
U laboratoriju se za to često koristi vodonik:

Najaktivniji metali, kako u industriji, tako i u laboratoriju, dobijaju se elektrolizom (§ 9.9).
U laboratoriji se manje aktivni metali mogu reducirati iz rastvora njihovih soli s aktivnijim metalima (vidi § 12.2 za ograničenja).
1. Zašto metali nisu skloni oksidaciji?
2. Šta u prvom redu određuje hemijsku aktivnost metala?
3. Napravite transformacije
a) Li Li 2 O LiOH LiCl; b) NaCl Na Na 2 O 2;
c) FeO Fe FeS Fe 2 O 3; d) CuCl 2 Cu (OH) 2 CuO Cu CuBr 2.
4. Vratite lijeve strane jednadžbi:
a) ... \u003d H2O + Cu;
b) ... \u003d 3CO + 2Fe;
c) ... \u003d 2Cr + Al 2 O 3
.
Hemijska svojstva metali.
13.3. Nemetali
Za razliku od metala, nemetali se međusobno vrlo razlikuju po svojim svojstvima - i fizičkim i hemijskim, pa čak i po tipu strukture. Ali, osim plemenitih plinova, u svim nemetalima veza između atoma je kovalentna.
Atomi koji čine nemetale imaju tendenciju da vežu elektrone, ali, stvarajući jednostavne supstance, ne mogu "zadovoljiti" tu tendenciju. Stoga nemetali (u jednom ili drugom stepenu) imaju tendenciju da vežu elektrone, odnosno mogu se pokazivati oksidaciona svojstva... Oksidativna aktivnost nemetala ovisi, s jedne strane, o veličini atoma (što su atomi manji, tvar je aktivnija), a o drugoj o snazi \u200b\u200bkovalentnih veza u jednostavnoj supstanci (što su jače veze, to je tvar manje aktivna). Pri stvaranju jonskih spojeva, atomi nemetala zaista dodaju "dodatne" elektrone, a pri stvaranju spojeva s kovalentnim vezama oni samo pomiču zajedničke elektronske parove u svom smjeru. U oba slučaja, stanje oksidacije se smanjuje.
Nemetali mogu oksidirati:
1) metali (supstance više ili manje sklone doniranju elektrona):
3F 2 + 2Al \u003d 2AlF 3,
O 2 + 2Mg \u003d 2MgO (sa predgrevanjem),
S + Fe \u003d FeS (kada se zagrijava),
2C + Ca \u003d CaC 2 (kada se zagrijava).
2) ostali nemetali (manje skloni prihvatanju elektrona):
2F 2 + C \u003d CF 4 (kada se zagrijava),
O 2 + S \u003d SO 2 (sa predgrevanjem),
S + H 2 \u003d H 2 S (kada se zagrijava),
3) mnogi kompleks
supstance:
4F 2 + CH 4 \u003d CF 4 + 4HF,
3O 2 + 4NH 3 \u003d 2N 2 + 6H 2 O (kada se zagreva),
Cl 2 + 2HBr \u003d Br 2 + 2HCl.
Ovdje se mogućnost reakcije prvenstveno određuje snagom veza u reaktantima i produktima reakcije, a može se utvrditi izračunavanjem G.
Najjače oksidirajuće sredstvo je fluor. Kisik i hlor nisu mu puno inferiorni (obratite pažnju na njihov položaj u sistemu elemenata).
Bor, grafit (i dijamant), silicijum i druge jednostavne supstance formirane od elemenata uz granicu između metala i nemetala pokazuju oksidaciona svojstva u mnogo manjoj mjeri. Atomi ovih elemenata imaju manje šanse da prikače elektrone. Te su tvari (posebno grafit i vodonik) sposobne za izlaganje restorativna svojstva:
2S + MnO 2 \u003d Mn + 2CO,
4H 2 + Fe 3 O 4 \u003d 3Fe + 4H 2 O.
Ostala hemijska svojstva nemetala proučit ćete u sljedećim odjeljcima kada se upoznate s hemijom pojedinih elemenata (kao što je bio slučaj s kisikom i vodonikom). Tamo ćete takođe naučiti kako nabaviti ove supstance.
1. Koje su od sljedećih supstanci nemetali: Be, C, Ne, Pt, Si, Sn, Se, Cs, Sc, Ar, Ra?
2. Navedite primjere nemetala, koji su u normalnim uvjetima a) gasovi, b) tečnosti, c) čvrste materije.
3. Navedite primjere a) molekularnih i b) nemolekularnih jednostavnih supstanci.
4. Navedite tri primjera hemijskih reakcija u kojima a) hlor i b) vodonik pokazuju oksidaciona svojstva.
5. Navedite tri primjera kemijskih reakcija kojih nema u tekstu stavka, u kojima vodik pokazuje reducirajuća svojstva.
6. Izvršite transformacije:
a) P 4 P 4 O 10 H 3 PO 4; b) H2 NaHH2; c) Cl 2 NaCl Cl 2.
Hemijska svojstva nemetala.
13.4. Osnovni oksidi
Već znate da su svi osnovni oksidi čvrste, nemolekularne, jonski vezane supstance.
Glavni oksidi su:
a) oksidi alkalnih i zemnoalkalnih elemenata,
b) oksidi nekih drugih elemenata koji formiraju metale, u nižim oksidacionim stanjima, na primjer: CrO, MnO, FeO, Ag 2 O, itd.
Uključuju jednonabijene, dvostruko nabijene (vrlo rijetko, trostruko nabijene katione) i oksidne jone. Najkarakterističniji Hemijska svojstvabazični oksidi su tačno povezani sa prisustvom dvostruko nabijenih oksidnih jona (vrlo jakih osnovnih čestica) u njima. Hemijska aktivnost osnovnih oksida prvenstveno ovisi o jačini jonske veze u njihovim kristalima.
1) Svi osnovni oksidi reagiraju s otopinama jakih kiselina (§ 12.5):
Li 2 O + 2H 3 O \u003d 2Li + 3H 2 O, NiO + 2H 3 O \u003d Ni 2 + 3H 2 O,
Li 2 O + 2HCl p \u003d 2LiCl p + H 2 O, NiO + H 2 SO 4p \u003d NiSO 4p + H 2 O.
U prvom slučaju, uz reakciju s oksonijevim ionima, postoji i reakcija s vodom, ali, budući da je njena brzina znatno niža, to se može zanemariti, pogotovo što se na kraju ipak dobivaju isti proizvodi.
Mogućnost reakcije sa slabom otopinom kiseline određuje se i snagom kiseline (što je kiselina jača, to je aktivnija) i snagom veze u oksidu (što je veza slabija, to je oksid aktivniji).
2) Oksidi alkalijskih i zemnoalkalnih metala reaguju s vodom (§ 11.4):
Li 2 O + H 2 O \u003d 2Li + 2OH BaO + H 2 O \u003d Ba 2 + 2OH
Li 2 O + H 2 O \u003d 2LiOH p, BaO + H 2 O \u003d Ba (OH) 2p.
3) Pored toga, osnovni oksidi reagiraju s kiselim oksidima:
BaO + CO 2 \u003d BaCO 3,
FeO + SO 3 \u003d FeSO 4,
Na 2 O + N 2 O 5 \u003d 2NaNO 3.
Ovisno o hemijskoj aktivnosti tih i drugih oksida, reakcije se mogu odvijati na uobičajenoj temperaturi ili zagrijavanjem.
Koji je razlog za ove reakcije? Razmotrimo reakciju stvaranja BaCO 3 iz BaO i CO 2. Reakcija se odvija spontano, a entropija u ovoj reakciji opada (od dvije supstance, čvrste i plinovite, nastaje jedna kristalna tvar), pa je reakcija egzotermna. U egzotermnim reakcijama energija nastalih veza veća je od energije prekinutih, pa je energija veza u BaCO 3 veća nego u početnim BaO i CO 2. I u početnim supstancama i u produktima reakcije postoje dvije vrste hemijskih veza: jonska i kovalentna. Energija jonske veze (energija rešetke) u BaO nešto je veća nego u BaCO 3 (veličina karbonatnog iona veća je od oksidnog iona), stoga je energija sistema O 2 + CO 2 veća od energije CO 3 2.
 + Q
+ Q
Drugim riječima, ion CO 3 2 stabilniji je od iona O 2 i molekula CO 2 uzetih odvojeno. A veća stabilnost karbonatnog iona (njegova niža unutrašnja energija) povezana je s raspodjelom naboja ovog iona (- 2 e) preko tri atoma kiseonika karbonatnog iona, umesto jednog u oksidnom jonu (vidi takođe § 13.11).
4) Mnogi osnovni oksidi mogu se reducirati u metal aktivnijim redukcionim sredstvom za metal ili nemetal:
MnO + Ca \u003d Mn + CaO (kada se zagrije),
FeO + H 2 \u003d Fe + H 2 O (kada se zagrijava).
Mogućnost nastavka takvih reakcija ne ovisi samo o aktivnosti redukcijskog sredstva, već i o jačini veza u početnom i nastalom oksidu.
Često način dobijanjagotovo svi osnovni oksidi su oksidacija odgovarajućeg metala kisikom. Na taj način se ne mogu dobiti oksidi natrijuma, kalijuma i nekih drugih vrlo aktivnih metala (u tim uslovima stvaraju perokside i složenija jedinjenja), kao ni zlato, srebro, platina i drugi vrlo slabo aktivni metali (ti metali ne reaguju sa kiseonikom). Osnovni oksidi mogu se dobiti termičkom razgradnjom odgovarajućih hidroksida, kao i nekih soli (na primer, karbonata). Dakle, magnezijum oksid se može dobiti na sva tri načina:
2Mg + O2 \u003d 2MgO,
Mg (OH) 2 \u003d MgO + H 2 O,
MgCO 3 \u003d MgO + CO 2.
1. Napravite jednadžbe reakcija:
a) Li 2 O + CO 2 b) Na 2 O + N 2 O 5 c) CaO + SO 3
d) Ag 2 O + HNO 3 e) MnO + HCl f) MgO + H 2 SO 4
2. Napravite jednadžbe reakcija koje se javljaju tijekom provođenja sljedećih transformacija:
a) Mg MgO MgSO 4 b) Na 2 O Na 2 SO 3 NaCl
c) CoO Co CoCl 2 d) Fe Fe 3 O 4 FeO
(3) Dio nikla težak 8,85 g kalciniran je u struji kiseonika da bi se dobio nikal (II) oksid, a zatim tretiran suviškom solne kiseline. Otopina natrijum-sulfida dodavana je u nastalu otopinu dok prestanu padavine. Odredite masu ovog sedimenta.
Hemijska svojstva osnovnih oksida.
13.5. Kiseli oksidi
Svi kiseli oksidi su supstance sa
kovalentna veza.
Kiseli oksidi uključuju:
a) oksidi elemenata koji tvore nemetale,
b) neki oksidi elemenata koji tvore metale, ako su metali u tim oksidima u višim oksidacionim stanjima, na primjer CrO 3, Mn 2 O 7.
Među kiselim oksidima postoje supstance koje su gasovi na sobnoj temperaturi (na primer: CO 2, N 2 O 3, SO 2, SeO 2), tečnosti (na primer, Mn 2 O 7) i čvrste supstance (na primer: B 2 O 3, SiO 2, N 2 O 5, P 4 O 6, P 4 O 10, SO 3, I 2 O 5, CrO 3). Većina kiselih oksida su molekularne supstance (izuzeci su B 2 O 3, SiO 2, čvrsti SO 3, CrO 3 i neki drugi; postoje i nemolekularne modifikacije P 2 O 5). Ali nemolekularni kiseli oksidi takođe postaju molekularni kada pređu u plinovito stanje.
Kiseli oksidi karakterizirani su sljedećim hemijska svojstva.
1) Svi kiseli oksidi reagiraju sa jakim bazama, kao i sa čvrstim:
CO 2 + Ca (OH) 2 \u003d CaCO 3 + H 2 O
SiO 2 + 2KOH \u003d K 2 SiO 3 + H 2 O (kada se zagreva),
i sa lužnim otopinama (§ 12.8):
SO 3 + 2OH \u003d SO 4 2 + H 2 O, N 2 O 5 + 2 OH \u003d 2NO 3 + H 2 O,
SO 3 + 2NaOH p \u003d Na 2 SO 4p + H 2 O, N 2 O 5 + 2KOH p \u003d 2KNO 3p + H 2 O.
Razlog reakcija s čvrstim hidroksidima isti je kao i s oksidima (vidi § 13.4).
Najaktivniji kiseli oksidi (SO 3, CrO 3, N 2 O 5, Cl 2 O 7) takođe mogu reagovati sa nerastvorljivim (slabim) bazama.
2) Kiseli oksidi reagiraju s osnovnim oksidima (§ 13.4):
CO 2 + CaO \u003d CaCO 3
P 4 O 10 + 6FeO \u003d 2Fe 3 (PO 4) 2 (kada se zagreva)
3) Mnogi kiseli oksidi reagiraju s vodom (§11.4).
N 2 O 3 + H 2 O \u003d 2HNO 2 SO 2 + H 2 O \u003d H 2 SO 3 (tačniji prikaz formule sumporne kiseline -SO 2. H 2 O
N 2 O 5 + H 2 O \u003d 2HNO 3 SO 3 + H 2 O \u003d H 2 SO 4
Mnogi kiseli oksidi mogu biti primljeno oksidacijom kiseonikom (izgaranjem u kiseoniku ili u zraku) odgovarajućih jednostavnih supstanci (C gr, S 8, P 4, P cr, B, Se, ali ne N 2 i ne halogeni):
C + O 2 \u003d CO 2,
S 8 + 8O 2 \u003d 8SO 2,
ili pri razgradnji odgovarajućih kiselina:
H 2 SO 4 \u003d SO 3 + H 2 O (s jakim grijanjem),
H 2 SiO 3 \u003d SiO 2 + H 2 O (kada se suši na zraku),
H 2 CO 3 \u003d CO 2 + H 2 O (na sobnoj temperaturi u rastvoru),
H 2 SO 3 \u003d SO 2 + H 2 O (na sobnoj temperaturi u rastvoru).
Nestabilnost karbonskih i sumpornih kiselina omogućava dobijanje CO 2 i SO 2 pod dejstvom jakih kiselina na karbonate Na 2 CO 3 + 2HCl p \u003d 2NaCl p + CO 2 + H 2 O
(reakcija se odvija i u otopini i sa čvrstim Na2CO3) i sulfitima
K 2 SO 3t + H 2 SO 4conc \u003d K 2 SO 4 + SO 2 + H 2 O (ako ima puno vode, sumpor-dioksid se ne emituje u obliku plina).