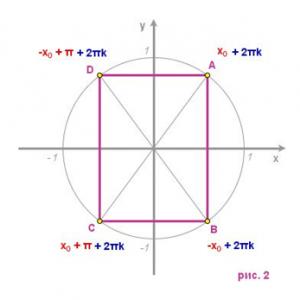
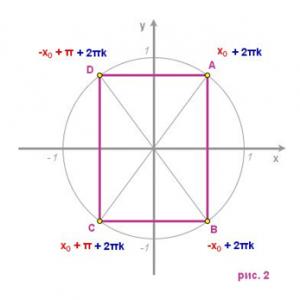
Vytvorte genetickú sériu lítia pomocou kovového diagramu. Vytvorte genetickú sériu lítia pomocou diagramu
Táto lekcia je venovaná zovšeobecneniu a systematizácii vedomostí na tému „Triedy anorganických látok“. Učiteľ vám povie, ako môžete získať látku inej triedy z látok jednej triedy. Získané vedomosti a zručnosti budú užitočné pri zostavovaní reakčných rovníc pozdĺž reťazcov transformácií.
Počas chemických reakcií chemický prvok nezmizne z jednej látky na druhú. Atómy chemického prvku sa akoby preniesli z jednoduchej látky na zložitejšiu a naopak. Vznikajú tak takzvané genetické série, počnúc jednoduchou látkou – kovom alebo nekovom – a končiac soľou.
Pripomínam, že soli obsahujú kovy a kyslé zvyšky. Takže genetická séria kovu môže vyzerať takto:
Z kovu je možné v dôsledku reakcie zlúčeniny s kyslíkom získať zásaditý oxid, zásaditý oxid pri interakcii s vodou poskytuje zásadu (iba ak je táto zásada alkalická) a soľ môže byť získaný zo zásady ako výsledok výmennej reakcie s kyselinou, soľou alebo kyslým oxidom.
Upozorňujeme, že táto genetická séria je vhodná len pre kovy, ktorých hydroxidy sú alkálie.
Zapíšme si reakčné rovnice zodpovedajúce premenám lítia v jeho genetickom rade:
Li → Li20 → LiOH → Li2S04
Ako viete, kovy pri interakcii s kyslíkom zvyčajne tvoria oxidy. Pri oxidácii vzdušným kyslíkom tvorí lítium oxid lítny:
4Li + 02 = 2Li20
Oxid lítny pri interakcii s vodou vytvára hydroxid lítny - vo vode rozpustnú zásadu (alkálie):
Li20 + H20 = 2 LiOH
Síran lítny je možné získať z lítia niekoľkými spôsobmi, napríklad v dôsledku neutralizačnej reakcie s kyselinou sírovou:
2. Chemická informačná sieť ().
Domáce úlohy
1. str. 130-131 č. 2.4 z Pracovného zošita z chémie: 8. ročník: k učebnici P.A. Orzhekovsky a ďalší. 8. trieda“ / O.V. Ushakova, P.I. Bespalov, P.A. Oržekovskij; vyd. Prednášal prof. P.A. Oržekovskij - M.: AST: Astrel: Profizdat, 2006.
2. str.204 č.2,4 z učebnice P.A. Oržekovskij, L.M. Meshcheryakova, M.M. Shalashova „Chémia: 8. ročník“, 2013
Dokončené práce
STUPEŇ FUNGUJE
Veľa už prešlo a teraz ste absolvent, ak, samozrejme, prácu napíšete načas. Ale život je taká vec, že až teraz je vám jasné, že keď prestanete byť študentom, stratíte všetky študentské radosti, z ktorých mnohé ste nikdy nevyskúšali, všetko odložíte a odložíte na neskôr. A teraz namiesto dobiehania pracuješ na diplomovej práci? Existuje vynikajúce riešenie: stiahnite si diplomovú prácu, ktorú potrebujete z našej webovej stránky - a okamžite budete mať veľa voľného času!
Práce boli úspešne obhájené na popredných univerzitách Kazašskej republiky.
Cena práce od 20 000 tenge
KURZ FUNGUJE
Projekt kurzu je prvou serióznou praktickou prácou. Práve písaním ročníkových prác začína príprava na vypracovanie diplomových projektov. Ak sa študent naučí správne prezentovať obsah témy v kurzovom projekte a kompetentne ho formátovať, nebude mať v budúcnosti problémy s písaním referátov, písaním diplomových prác, či vykonávaním iných praktických úloh. Na pomoc študentom pri písaní tohto typu študentskej práce a na objasnenie otázok, ktoré sa vynárajú pri jej príprave, vznikla táto informačná sekcia.
Cena práce od 2500 tenge
MAGISTERSKÉ DIZERÁTNE PRÁCE
V súčasnosti je na vysokých školách v Kazachstane a krajinách SNŠ úroveň vyššieho odborného vzdelávania, ktorá nasleduje po bakalárskom stupni, veľmi bežná - magisterský stupeň. V magisterskom programe študenti študujú s cieľom získať magisterský titul, ktorý je vo väčšine krajín sveta uznávaný viac ako bakalársky a uznávajú ho aj zahraniční zamestnávatelia. Výsledkom magisterského štúdia je obhajoba diplomovej práce.
Poskytneme vám aktuálny analytický a textový materiál v cene sú 2 vedecké články a abstrakt.
Náklady na prácu od 35 000 tenge
PRAXE
Po absolvovaní akéhokoľvek typu študentskej praxe (vzdelávacej, priemyselnej, predmaturitnej) je potrebná správa. Tento dokument bude potvrdením praktickej práce študenta a podkladom pre vypracovanie hodnotenia pre prax. Aby ste mohli vypracovať správu o stáži, musíte zvyčajne zhromaždiť a analyzovať informácie o podniku, zvážiť štruktúru a pracovnú rutinu organizácie, v ktorej stáž prebieha, zostaviť kalendárny plán a opísať svoje praktické skúsenosti. činnosti.
Pomôžeme vám napísať správu o vašej stáži, berúc do úvahy špecifiká činnosti konkrétneho podniku.
Opakovanie. Genetický vzťah tried anorganických zlúčenín
Úvod
Témou tejto lekcie je „Opakovanie. Genetický vzťah tried anorganických zlúčenín“. Zopakujete si, ako sa delia všetky anorganické látky, a dospejete k záveru, ako možno z jednej triedy získať ďalšiu triedu anorganických zlúčenín. Na základe prijatých informácií sa dozviete, aké je genetické spojenie takýchto tried, dva hlavné spôsoby takýchto spojení.
Téma: Úvod
Lekcia: Opakovanie. Genetický vzťah tried anorganických zlúčenín
Chémia je veda o látkach, ich vlastnostiach a vzájomných premenách.
Ryža. 1. Genetická príbuznosť tried anorganických zlúčenín
Všetky anorganické látky možno rozdeliť na:
Jednoduché látky
Komplexné látky.
Jednoduché látky sa delia na:
Kovy
Nekovy
Komplexné látky možno rozdeliť na:
Dôvody
Kyseliny
Soľ. Pozri obr.1.
Sú to binárne zlúčeniny pozostávajúce z dvoch prvkov, z ktorých jeden je kyslík v oxidačnom stave -2. Obr.2.
Napríklad oxid vápenatý: Ca +2 O -2, oxid fosforečný (V) P 2 O 5., oxid dusnatý (IV) -« líščí chvost"

Ryža. 2. Oxidy
Rozdelené na:
Základné
Kyslé
Zásadité oxidy korešpondovať dôvodov.
Kyslé oxidy korešpondovať kyseliny.
Soli pozostávať z katióny kovov A anióny zvyškov kyselín.

Ryža. 3. Dráhy genetických spojení medzi látkami
Teda: z jednej triedy anorganických zlúčenín možno získať inú triedu.
Preto všetko triedy anorganických látok sú vzájomne prepojené.
Triedny vzťah anorganické zlúčeniny sa často nazývajú genetické. Obr.3.
Genesis v gréčtine znamená „pôvod“. Tie. genetická súvislosť ukazuje vzťah medzi premenou látok a ich pôvodom z jedinej látky.
Existujú dva hlavné spôsoby genetického spojenia medzi látkami. Jeden z nich začína kovom, druhý nekovom.
Genetická séria kovov ukazuje:
Kov → Oxid bázy → Soľ → Báza → Nová soľ.
Genetický rad nekovov odráža nasledujúce transformácie:
Nekovy → Kyslý oxid → Kyselina → Soľ.
Pre akúkoľvek genetickú sériu možno napísať reakčné rovnice, ktoré ukazujú premena jednej látky na druhú.
Najprv musíte určiť, do ktorej triedy anorganických zlúčenín patrí každá látka genetického radu.
Zamyslite sa nad tým ako dostať látku po šípke z látky pred šípom.
Príklad č.1. Genetická séria kovov.

Séria začína jednoduchou kovovou látkou medi. Ak chcete urobiť prvý prechod, musíte spáliť meď v kyslíkovej atmosfére.
2Cu +02 →2CuO
Druhý prechod: potrebujete získať soľ CuCl 2. Tvorí ju kyselina chlorovodíková HCl, pretože soli kyseliny chlorovodíkovej sa nazývajú chloridy.
CuO +2 HCl → CuCl2 + H20
Tretí krok: na získanie nerozpustnej zásady je potrebné do rozpustnej soli pridať zásadu.
CuCl2 + 2NaOH → Cu(OH)2↓ + 2NaCl
Ak chcete premeniť hydroxid meďnatý na síran meďnatý, pridajte k nemu kyselinu sírovú H2SO4.
Cu(OH) 2 ↓ + H 2 SO 4 → CuSO 4 + 2H 2 O
Príklad č.2. Genetický rad nekovov.

Séria začína jednoduchou látkou, nekovovým uhlíkom. Na uskutočnenie prvého prechodu musí byť uhlík spálený v kyslíkovej atmosfére.
C + O2 → CO2
Ak do kyslého oxidu pridáte vodu, získate kyselinu nazývanú kyselina uhličitá.
C02 + H20 → H2CO3
Na získanie soli kyseliny uhličitej - uhličitanu vápenatého je potrebné do kyseliny pridať zlúčeninu vápnika, napríklad hydroxid vápenatý Ca(OH) 2.
H2C03 + Ca (OH)2 -> CaC03 + 2H20
Zloženie akejkoľvek genetickej série zahŕňa látky rôznych tried anorganických zlúčenín.
Ale tieto látky nevyhnutne obsahujú rovnaký prvok. Keď poznáme chemické vlastnosti tried zlúčenín, je možné vybrať reakčné rovnice, pomocou ktorých možno tieto transformácie uskutočniť. Tieto premeny sa využívajú aj vo výrobe na výber najracionálnejších metód získavania určitých látok.
Zopakovali ste, ako sa delia všetky anorganické látky, a dospeli ste k záveru, ako možno z jednej triedy získať ďalšiu triedu anorganických zlúčenín. Na základe získaných informácií sme sa dozvedeli, aké je genetické spojenie takýchto tried, dva hlavné spôsoby takýchto spojení .
1. Rudzitis G.E. Anorganická a organická chémia. 8. ročník: učebnica pre všeobecnovzdelávacie inštitúcie: základný stupeň / G. E. Rudzitis, F.G. Feldman.M.: Osvietenie. 2011, 176 s.: ill.
2. Popel P.P Chémia: 8. ročník: učebnica pre všeobecnovzdelávacie inštitúcie / P.P. Popel, L.S. -K.: IC “Academy”, 2008.-240 s.: chor.
3. Gabrielyan O.S. Chémia. 9. ročníka. Učebnica. Vydavateľ: Drop: 2001. 224s.
1. č. 10-a, 10z (s. 112) Rudzitis G.E. Anorganická a organická chémia. 8. ročník: učebnica pre všeobecnovzdelávacie inštitúcie: základný stupeň / G. E. Rudzitis, F.G. Feldman.M.: Osvietenie. 2011, 176 s.: ill.
2. Ako získať síran vápenatý z oxidu vápenatého dvoma spôsobmi?
3. Vytvorte genetický rad na výrobu síranu bárnatého zo síry. Napíšte reakčné rovnice.
Genetické spojenie medzi látkami je spojenie, ktoré je založené na ich vzájomných premenách, odráža jednotu pôvodu látok, inými slovami genézu.
Po znalostiach tried jednoduchých látok môžeme rozlíšiť dve genetické série:
1) Genetický rad kovov
2) Genetický rad nekovov.
Genetický rad kovov odhaľuje vzájomnú prepojenosť látok rôznych tried, ktorých základom je ten istý kov.
Genetická séria kovov sa vyskytuje v dvoch typoch.
1. Genetický rad kovov, ktorým alkália zodpovedá ako hydroxid. Takáto séria môže byť reprezentovaná podobným reťazcom transformácií:
kov → zásaditý oxid → zásada (alkálie) → soľ
Vezmite si napríklad genetickú sériu vápnika:
Ca → CaO → Ca(OH) 2 → Ca 3 (PO 4) 2.
2. Genetický rad kovov, ktoré zodpovedajú nerozpustným zásadám. V tejto sérii je viac genetických spojení, pretože plnšie odráža myšlienku priamych a spätných transformácií (vzájomných). Takáto séria môže byť reprezentovaná iným reťazcom transformácií:
kov → zásaditý oxid → soľ → zásada → zásaditý oxid → kov.
Vezmime si napríklad genetickú sériu medi:
Cu → CuO → CuCl2 → Cu (OH)2 → CuO → Cu.
Genetický rad nekovov odhaľuje vzťah medzi látkami rôznych tried, ktoré sú založené na rovnakom nekove.
Vyzdvihnime ešte dve odrody.
1. Genetický rad nekovov, ktorým rozpustná kyselina zodpovedá ako hydroxid, možno znázorniť vo forme nasledujúcej línie premien:
nekov → kyslý oxid → kyselina → soľ.
Zoberme si napríklad genetickú sériu fosforu:
P → P205 → H3PO4 → Ca3 (PO4) 2.
2. Genetický rad nekovov, ktoré zodpovedajú nerozpustnej kyseline, môže byť reprezentovaný nasledujúcim reťazcom transformácií:
nekov → kyslý oxid → soľ → kyselina → kyslý oxid → nekov.
Keďže z kyselín, ktoré sme uvažovali, je nerozpustná iba kyselina kremičitá, pozrime sa na genetický rad kremíka ako príklad:
Si → SiO 2 → Na 2 SiO 3 → H 2 SiO 3 → H 2 SiO 3 → SiO 2 → Si.
Poďme si teda zhrnúť a vyzdvihnúť najzákladnejšie informácie.
Celistvosť a rozmanitosť chemických látok je najjasnejšie znázornená v genetickom spojení látok, ktoré sa prejavuje v genetických radoch. Pozrime sa na najdôležitejšie vlastnosti genetických sérií:

Genetické série sú skupinou organických zlúčenín, ktoré majú rovnaký počet atómov uhlíka v molekule, líšia sa funkčnými skupinami.
Genetická súvislosť je všeobecnejší pojem, na rozdiel od genetickej série, ktorá je síce dosť nápadná, no zároveň je osobitným prejavom tohto spojenia, ku ktorému môže dôjsť pri akýchkoľvek obojstranných premenách látok.
blog.site, pri kopírovaní celého materiálu alebo jeho časti sa vyžaduje odkaz na pôvodný zdroj.
Každý takýto rad pozostáva z kovu, jeho hlavného oxidu, zásady a akejkoľvek soli toho istého kovu:
Na prechod od kovov k zásaditým oxidom vo všetkých týchto sériách sa používajú reakcie kombinácie s kyslíkom, napríklad:
2Ca + 02 = 2CaO; 2Mg + 02 = 2MgO;
Prechod zo zásaditých oxidov na zásady v prvých dvoch radoch sa uskutočňuje prostredníctvom vám známej hydratačnej reakcie, napríklad:
СaO + H20 = Сa(OH) 2.
Pokiaľ ide o posledné dva rady, oxidy MgO a FeO v nich obsiahnuté nereagujú s vodou. V takýchto prípadoch sa na získanie zásad tieto oxidy najskôr premenia na soli a potom sa premenia na zásady. Preto sa napríklad na uskutočnenie prechodu z oxidu MgO na hydroxid Mg(OH)2 používajú nasledujúce reakcie:
MgO + H2S04 = MgS04 + H20; MgS04 + 2NaOH = Mg(OH)2↓ + Na2S04.
Prechody zo zásad na soli sa uskutočňujú reakciami, ktoré sú vám už známe. Rozpustné zásady (alkálie) nachádzajúce sa v prvých dvoch radoch sa teda pôsobením kyselín, kyslých oxidov alebo solí premenia na soli. Nerozpustné zásady z posledných dvoch radov tvoria pôsobením kyselín soli.
Genetický rad nekovov a ich zlúčenín.
Každá takáto séria pozostáva z nekovu, kyslého oxidu, zodpovedajúcej kyseliny a soli obsahujúcej anióny tejto kyseliny:
Na prechod od nekovov ku kyslým oxidom vo všetkých týchto sériách sa používajú reakcie kombinácie s kyslíkom, napríklad:
4P + 502 = 2P205; Si + 02 = Si02;
Prechod z kyslých oxidov na kyseliny v prvých troch radoch sa uskutočňuje prostredníctvom vám známej hydratačnej reakcie, napríklad:
P205 + 3H20 = 2H3P04.
Viete však, že oxid SiO 2 obsiahnutý v poslednom rade nereaguje s vodou. V tomto prípade sa najskôr premení na zodpovedajúcu soľ, z ktorej sa potom získa požadovaná kyselina:
Si02 + 2KOH = K2Si03 + H20; K2Si03 + 2HCl = 2KCl + H2Si03↓.
Prechody z kyselín na soli sa môžu uskutočňovať vám známymi reakciami so zásaditými oxidmi, zásadami alebo soľami.
Dôležité informácie:
· Látky rovnakého genetického radu navzájom nereagujú.
· Látky rôznych typov genetických sérií medzi sebou reagujú. Produktom takýchto reakcií sú vždy soli (obr. 5):
Ryža. 5. Schéma vzťahu medzi látkami rôznych genetických sérií.
Tento diagram ukazuje vzťahy medzi rôznymi triedami anorganických zlúčenín a vysvetľuje rozmanitosť chemických reakcií medzi nimi.
Zadanie k téme:
Napíšte reakčné rovnice, ktoré možno použiť na vykonanie nasledujúcich transformácií:
1. Na → Na20 → NaOH → Na2C03 → Na2S04 → NaOH;
2. P → P205 → H3PO4 → K3P04 → Ca3 (P04)2 → CaS04;
3. Ca → CaO → Ca(OH)2 → CaCl2 → CaC03 → CaO;
4. S → SO2 → H2S03 → K2S03 → H2S03 → BaSO3;
5. Zn → ZnO → ZnCl2 → Zn(OH)2 → ZnSO4 → Zn(OH)2;
6. C → CO2 → H2C03 → K2C03 → H2C03 → CaC03;
7. Al -> Al2(S04)3 -> Al(OH)3 -> Al203 -> AlCl3;
8. Fe → FeCl2 → FeSO4 → Fe(OH)2 → FeO → Fe3 (P04)2;
9. Si → Si02 → H2Si03 → Na2Si03 → H2Si03 → Si02;
10. Mg -> MgCl2 -> Mg(OH)2 -> MgS04 -> MgC03 -> MgO;
11. K → KOH → K2C03 → KCl → K2S04 → KOH;
12. S → SO 2 → CaSO 3 → H 2 SO 3 → SO 2 → Na 2 SO 3;
13. S → H2S → Na2S → H2S → SO2 → K2S03;
14. Cl2 → HCl → AlCl3 → KCl → HCl → H2C03 → CaC03;
15. FeO → Fe(OH)2 → FeSO4 → FeCl2 → Fe(OH)2 → FeO;
16. CO2 → K2C03 → CaC03 → CO2 → BaC03 → H2C03;
17. K20 → K2S04 → KOH → KCl → K2S04 → KNO 3;
18. P205 → H3PO4 → Na3P04 → Ca3 (P04)2 → H3PO4 → H2S03;
19. Al203 → AlCl3 → Al(OH)3 → Al(N03)3 → Al2(S04)3 → AlCl3;
20. SO3 → H2SO4 → FeSO4 → Na2S04 → NaCl → HCl;
21. KOH → KCl → K2S04 → KOH → Zn(OH)2 → ZnO;
22. Fe(OH)2 → FeCl2 → Fe(OH)2 → FeSO4 → Fe(N03)2 → Fe;
23. Mg(OH)2 -> MgO -> Mg(N03)2 -> MgS04 -> Mg(OH)2 -> MgCl2;
24. Al(OH)3 -> Al203 -> Al(N03)3 -> AI2(S04)3 -> AlCl3 -> Al(OH)3;
25. H 2 SO 4 → MgSO 4 → Na 2 SO 4 → NaOH → NaNO 3 → HNO 3;
26. HN03 → Ca(N03)2 → CaC03 → CaCl2 → HCl → AlCl3;
27. CuC03 → Cu(NO 3) 2 → Cu(OH) 2 → CuO → CuSO4 → Cu;
28. MgS04 -> MgCl2 -> Mg(OH)2 -> MgO -> Mg(N03)2 -> MgC03;
29. K2S → H2S → Na2S → H2S → SO2 → K2S03;
30. ZnS04 -> Zn(OH)2 -> ZnCl2 -> HCl -> AlCl3 -> Al(OH)3;
31. Na 2 CO 3 → Na 2 SO 4 → NaOH → Cu(OH) 2 → H 2 O → HNO 3;