Vrste hemijskih veza. Glavne vrste hemijskih veza Nh3 vrsta hemikalije
|
Kao rezultat proučavanja ove teme naučit ćete:
Kao rezultat proučavanja ove teme naučit ćete:
Studijska pitanja: |
5.1. Kovalentna veza
Hemijska veza nastaje kada se dva ili više atoma približe jedan drugom, ako se kao rezultat njihove interakcije ukupna energija sistema smanji. Najstabilnije elektroničke konfiguracije vanjskih elektronskih ovojnica atoma su konfiguracije atoma plemenitog plina, koje se sastoje od dva ili osam elektrona. Vanjske elektronske ljuske atoma ostalih elemenata sadrže od jednog do sedam elektrona, tj. su nepotpuni. Kada se molekula formira, atomi teže steći stabilnu dvoelektronsku ili osmoelektronsku ljusku. Valentni elektroni atoma učestvuju u stvaranju hemijske veze.
Kovalentna je hemijska veza između dva atoma koja nastaje uslijed elektronskih parova koji istovremeno pripadaju ova dva atoma.
Postoje dva mehanizma za stvaranje kovalentne veze: razmjena i donor - akceptor.
5.1.1. Mehanizam razmene za stvaranje kovalentne veze
Mehanizam razmjene formiranje kovalentne veze ostvaruje se preklapanjem elektronskih oblaka elektrona koji pripadaju različitim atomima. Na primjer, kada se dva atoma vodonika približe jedan drugom, 1s elektronske orbitale se preklapaju. Kao rezultat, nastaje zajednički par elektrona, koji istovremeno pripadaju oba atoma. U ovom slučaju hemijsku vezu stvaraju elektroni s antiparalelnim spinovima, Sl. 5.1.
Slika: 5.1. Stvaranje molekula vodonika iz dva atoma H
5.1.2. Donor - akceptorski mehanizam stvaranja kovalentne veze
Sa donorsko-akceptorskim mehanizmom stvaranja kovalentne veze, veza se formira i uz pomoć elektronskih parova. Međutim, u ovom slučaju jedan atom (donor) daje svoj elektronski par, a drugi atom (akceptor) učestvuje u stvaranju veze sa svojom slobodnom orbitalom. Primjer implementacije donor-akceptorske veze je stvaranje amonijum-jona NH 4 + tokom interakcije amonijaka NH 3 sa kationom vodonika H +.
U molekulu NH 3 tri elektronska para tvore tri N - H veze, četvrti elektronski par koji pripada atomu azota usamljen je. Ovaj elektronski par može se vezati za jon vodonika koji ima slobodnu orbitalu. Rezultat je amonijev ion NH 4 +, sl. 5.2.

Slika: 5.2. Stvaranje donor-akceptorske veze tokom stvaranja amonijum-jona
Treba napomenuti da su četiri kovalentne N - H veze koje postoje u ionu NH 4 + ekvivalentne. U amonijevom jonu je nemoguće izolirati vezu nastalu mehanizmom donor-akceptor.
5.1.3. Polarna i nepolarna kovalentna veza
Ako kovalentnu vezu čine identični atomi, tada se elektronski par nalazi na istoj udaljenosti između jezgara tih atoma. Takva kovalentna veza naziva se nepolarnom. Primjer molekula s nepolarnom kovalentnom vezom su H2, Cl2, O2, N2, itd.
U slučaju polarne kovalentne veze, ukupni elektronski par pomaknut je prema atomu s većom elektronegativnošću. Ova vrsta veze ostvaruje se u molekulima formiranim od različitih atoma. Kovalentna polarna veza odvija se u molekulama HCl, HBr, CO, NO itd. Na primjer, stvaranje polarne kovalentne veze u molekuli HCl može se predstaviti shemom, slika. 5.3:

Slika: 5.3. Stvaranje kovalentne polarne veze u molekuli HC1
U razmatranoj molekuli, elektronski par je pomaknut prema atomu klora, jer je njegova elektronegativnost (2,83) veća od elektronegativnosti atoma vodonika (2,1).
5.1.4. Dipolni moment i molekularna struktura
Mjera polariteta veze je njen dipolni moment μ:
μ \u003d e l,
gde e - naboj elektrona, l - udaljenost između centara pozitivnih i negativnih naboja.
Dipolni moment je vektorska veličina. Koncepti "dipolnog momenta veze" i "dipolnog momenta molekule" podudaraju se samo za dvoatomske molekule. Dipolni moment molekule jednak je vektorskom zbiru dipolnih momenata svih veza. Dakle, dipolni moment polihatomske molekule ovisi o njenoj strukturi.
Na primjer, u linearnom molekulu CO 2, svaka od veza C - O je polarna. Međutim, molekula CO 2 uglavnom je nepolarna, jer se dipolni momenti veza međusobno poništavaju (slika 5.4). Dipolni moment molekule ugljen-dioksida je m \u003d 0.
U kutnoj molekuli N 2 O, polarne N - O veze nalaze se pod uglom od 104,5 o. Vektorski zbroj dipolnih momenata dviju N - O veza izražava se dijagonalom paralelograma (slika 5.4). Kao rezultat, dipolni moment molekule vode m nije jednak nuli.

Slika: 5.4. Dipolni momenti molekula CO 2 i H 2 O
5.1.5. Valencija elemenata u jedinjenjima sa kovalentnom vezom
Valensija atoma određena je brojem nesparenih elektrona koji učestvuju u stvaranju zajedničkih elektronskih parova sa elektronima drugih atoma. Atomi halogena u molekulima F 2, HCl, PBr 3 i CCl 4, koji imaju jedan nespareni elektron na vanjskom elektronskom sloju, monovalentni su. Elementi podskupine kisika sadrže dva nesparena elektrona na vanjskom sloju, pa su u spojevima kao što su O2, H2O, H2S i SCl2 dvovalentni.
Budući da se, pored uobičajenih kovalentnih veza, u molekulima može stvoriti i veza mehanizmom donor-akceptor, valencija atoma ovisi i o prisutnosti usamljenih elektronskih parova i slobodnih elektronskih orbitala u njima. Kvantitativna mjera valencije je broj hemijskih veza kojima je dati atom povezan s drugim atomima.
Maksimalna valencija elemenata u pravilu ne može premašiti broj grupe u kojoj se nalaze. Izuzetak su elementi bočne podskupine prve skupine Cu, Ag, Au, čija je valencija u spojevima veća od jedne. Elektroni vanjskih slojeva su prvenstveno valentni, međutim, za elemente bočnih podskupina, elektroni pretposljednjih (pred-vanjskih) slojeva također sudjeluju u stvaranju kemijske veze.
5.1.6. Valencija elemenata u normalnom i pobuđenom stanju
Većina valencija hemijski elementi ovisi o tome jesu li ovi elementi u normalnom ili pobuđenom stanju. Elektronska konfiguracija Li atoma je 1s 2 2s 1. Atom litijuma na vanjskom nivou ima jedan nespareni elektron, tj. litij je monovalentan. Potrebna je vrlo velika potrošnja energije, povezana sa prelaskom 1s-elektrona u 2p-orbitalu, da bi se dobio trovalentni litijum. Ovaj trošak energije je toliko velik da se ne nadoknađuje energijom koja se oslobađa tokom stvaranja hemijskih veza. S tim u vezi, ne postoje trovalentni spojevi litija.
Konfiguracija vanjskog elektronskog sloja elemenata podskupine berilija ns 2. To znači da se na vanjskom elektronskom sloju ovih elemenata u orbitalnoj ns ćeliji nalaze dva elektrona sa suprotnim spinovima. Elementi podskupine berilija ne sadrže nesparene elektrone, pa je njihova valencija u normalnom stanju jednaka nuli. U uzbuđenom stanju, elektronička konfiguracija elemenata podskupine berilija je ns 1 nr 1, tj. elementi tvore spojeve u kojima su dvovalentni.
Valencija bora
Razmotrimo elektroničku konfiguraciju atoma bora u osnovnom stanju: 1s 2 2s 2 2p 1. Atom bora u osnovnom stanju sadrži jedan nespareni elektron (slika 5.5), tj. to je monovalentno. Međutim, bor nije karakteriziran stvaranjem spojeva u kojima je monovalentan. Kada se pobudi atom bora, jedan 2s-elektron prelazi u 2p-orbitalu (slika 5.5). Atom bora u pobuđenom stanju ima 3 nesparena elektrona i može stvoriti spojeve u kojima je njegova valencija tri.

Slika: 5.5. Valentna stanja bora u normalnom i pobuđenom stanju
Energija potrošena na prijelaz atoma u pobuđeno stanje unutar jednog energetskog nivoa, u pravilu je više nego kompenzirana energijom koja se oslobađa tokom stvaranja dodatnih veza.
Zbog prisustva jedne slobodne 2p-orbitale u atomu bora, bor u jedinjenjima može stvoriti četvrtu kovalentnu vezu, djelujući kao akceptor elektronskog para. Na slici 5.6 prikazano je kako dolazi do interakcije molekule BF sa ionom F -, uslijed čega nastaje - ion, u kojem bor tvori četiri kovalentne veze.

Slika: 5.6. Mehanizam donor-akceptor za stvaranje četvrte kovalentne veze u atomu bora
Valencija atoma dušika
Razmotrimo elektroničku strukturu atoma dušika (slika 5.7).

Slika: 5.7. Raspodela elektrona u orbitalama atoma azota
Iz prikazane sheme vidi se da azot ima tri nesparena elektrona, može stvoriti tri hemijske veze i njegova valencija je tri. Prelazak atoma azota u pobuđeno stanje je nemoguć, jer drugi nivo energije ne sadrži d-orbitale. Istovremeno, atom dušika može pružiti usamljeni elektronski par spoljnih elektrona 2s 2 atomu koji ima slobodnu orbitalu (akceptor). Kao rezultat, pojavljuje se četvrta hemijska veza atoma dušika, kao što je to slučaj, na primjer, u amonijevom ionu (slika 5.2). Dakle, maksimalna kovalentnost (broj formiranih kovalentnih veza) atoma azota je četiri. U svojim spojevima, azot, za razliku od ostalih elemenata pete grupe, ne može biti petovalentan.
Valentne sposobnosti atoma fosfora, sumpora i halogena
Za razliku od atoma azota, kiseonika i fluora, atomi fosfora, sumpora i hlora u trećem periodu imaju slobodne 3d ćelije u koje se elektroni mogu prenijeti. Kada se pobudi atom fosfora (slika 5.8), on ima 5 nesparenih elektrona na svom spoljnom elektronskom sloju. Kao rezultat, atom fosfora u jedinjenjima može biti ne samo tro-, već i petovalentan.

Slika: 5.8. Raspodela valentnih elektrona u orbitalama za atom fosfora u pobuđenom stanju
U pobuđenom stanju sumpor, osim valencije dva, pokazuje i valenciju četiri i šest. U ovom slučaju, elektroni 3p i 3s upareni su uzastopno (slika 5.9).


Slika: 5.9. Mogućnosti valencije atoma sumpora u pobuđenom stanju
U pobuđenom stanju, za sve elemente glavne podskupine grupe V, osim za fluor, moguće je uzastopno uklanjanje para najprije p-, a zatim s-elektronskih parova. Kao rezultat, ti elementi postaju tro-, pet- i sedmovalentni (slika 5.10).



Slika: 5.10. Mogućnosti valencije atoma hlora, broma i joda u pobuđenom stanju
5.1.7. Dužina, energija i pravac kovalentne veze
Kovalentna veza se obično stvara između atoma nemetala. Glavne karakteristike kovalentne veze su dužina, energija i usmjerenost.
Dužina kovalentne veze
Dužina veze je udaljenost između atomskih jezgara koja čine tu vezu. Određuje se eksperimentalnim fizikalnim metodama. Dužina veze može se procijeniti pravilom aditivnosti, prema kojem je dužina veze u molekuli AB približno jednaka polovičnom zbroju dužina veza u molekulama A2 i B2:
 .
.
Odozgo prema dolje po podgrupama periodični sistem elemenata, dužina kemijske veze se povećava, jer se u tom smjeru povećavaju polumjeri atoma (Tabela 5.1). S povećanjem multipliciranosti veze, njena dužina se smanjuje.
Tabela 5.1.
Dužina nekih hemijskih veza
Hemijska veza |
Dužina veze, pm |
Hemijska veza |
Dužina veze, pm |
C - C |
|||
Komunikacijska energija
Mjera čvrstoće veze je energija veze. Komunikacijska energija određuje se energijom potrebnom za razbijanje veze i uklanjanje atoma koji čine tu vezu na beskrajno velikoj udaljenosti jedan od drugog. Kovalentna veza je vrlo jaka. Njegova energija se kreće od nekoliko desetina do nekoliko stotina kJ / mol. Na primjer, za molekulu ICl 3, Ebond ≈40, a za molekule N 2 i CO, Ebond ≈ 1000 kJ / mol.
Odozgo prema dolje, duž podskupina periodnog sustava elemenata, energija kemijske veze se smanjuje, jer se dužina veze povećava u ovom smjeru (tablica 5.1). S povećanjem multipliciranosti veze, povećava se i njena energija (Tabela 5.2).
Tabela 5.2.
Energije nekih hemijskih veza
Hemijska veza |
Komunikacijska energija, |
Hemijska veza |
Komunikacijska energija, |
C - C |
|||
Zasićenost i usmjerenost kovalentne veze
Najvažnija svojstva kovalentne veze su njena zasićenost i usmjerenost. Zasićenje se može definirati kao sposobnost atoma da tvore ograničen broj kovalentnih veza. Dakle, atom ugljenika može stvoriti samo četiri kovalentne veze, a atom kiseonika - dvije. Maksimalan broj običnih kovalentnih veza koje atom može stvoriti (isključujući veze nastale mehanizmom donor-akceptor) jednak je broju nesparenih elektrona.
Kovalentne veze imaju prostornu orijentaciju, jer se preklapanje orbitala tokom stvaranja jednostruke veze javlja duž linije koja povezuje atomska jezgra. Prostorni raspored elektronskih orbitala molekule određuje njegovu geometriju. Kutovi između hemijskih veza nazivaju se uglovima veza.
Zasićenje i usmerenost kovalentne veze razlikuju ovu vezu od jonske veze koja je, za razliku od kovalentne veze, nezasićena i usmerena.
Prostorna struktura molekula N 2 O i NH 3
Razmotrimo usmjerenost kovalentne veze na primjeru molekula H 2 O i NH 3.
Molekula H 2 O nastaje od atoma kiseonika i dva atoma vodonika. Atom kiseonika ima dva nesparena p-elektrona, koji zauzimaju dvije orbitale koje su međusobno pod pravim kutom. Atomi vodonika imaju 1s nesparenih elektrona. Ugao između veza koje tvore p-elektroni treba da bude blizu ugla između orbitala p-elektrona. Eksperimentalno je, međutim, utvrđeno da je kut između O - H veza u molekuli vode 104,50. Porast ugla u odnosu na kut od 90 o može se objasniti odbojnim silama koje djeluju između atoma vodonika, Sl. 5.11. Dakle, molekula H 2 O ima kutni oblik.
Formiranje molekule NH 3 uključuje tri nesparena p-elektrona atoma dušika, čije su orbitale smještene u tri međusobno okomita pravca. Prema tome, tri veze N - H trebale bi biti smještene pod uglovima jedna prema drugoj, blizu 90 ° (slika 5.11). Eksperimentalna vrijednost ugla između veza u molekuli NH 3 je 107,3 \u200b\u200b°. Razlika u vrijednostima uglova između veza od teoretskih veza nastala je, kao u slučaju molekula vode, uzajamnim odbijanjem atoma vodonika. Pored toga, predstavljene šeme ne uzimaju u obzir mogućnost učešća dva elektrona u 2s orbitalama u stvaranju hemijskih veza.

Slika: 5.11. Preklapanje elektronskih orbitala tokom stvaranja hemijskih veza u molekulama H 2 O (a) i NH 3 (b)
Razmotrimo stvaranje molekula BeCl 2. Atom berilija u pobuđenom stanju ima dva nesparena elektrona: 2s i 2p. Može se pretpostaviti da atom berilija treba da tvori dvije veze: jednu vezu koju tvori s-elektron i jednu vezu koju stvara p-elektron. Te veze moraju imati različite energije i različite dužine. U ovom slučaju, molekula BeCl 2 ne bi trebala biti linearna, već uglata. Iskustvo, međutim, pokazuje da molekula BeCl 2 ima linearnu strukturu i da su obje hemijske veze u njoj ekvivalentne. Slična situacija uočava se i kada se razmatra struktura molekula BCl 3 i CCl 4 - sve veze u tim molekulima su ekvivalentne. Molekul BC1 3 ima planarnu strukturu, CC1 4 - tetraedar.
Da bi objasnili strukturu molekula kao što su BeCl 2, BCl 3 i CCl 4, Pauling i Slater (SAD) predstavio koncept hibridizacije atomskih orbitala. Predložili su da se nekoliko atomskih orbitala, ne previše različitih po svojim energijama, zamijene istim brojem ekvivalentnih orbitala, nazvanih hibridnim. Ove hibridne orbitale sastoje se od atomskih kao rezultat njihove linearne kombinacije.
Prema L. Paulingu, kada kemijske veze tvori atom koji u jednom sloju ima elektrone različitih vrsta i, prema tome, ne previše različite u svojoj energiji (na primjer, s i p), moguće je promijeniti konfiguraciju različitih vrsta orbitala, na kojima dolazi do njihovog poravnanja u obliku i energiji ... Kao rezultat, nastaju hibridne orbitale, koje su asimetrične i snažno izdužene na jednoj strani jezgre. Važno je naglasiti da se model hibridizacije koristi u slučaju kada elektroni različitih vrsta, na primjer, s i p, sudjeluju u stvaranju veza.
5.1.8.2. Različiti tipovi hibridizacije atomskih orbitala
sp-hibridizacija
Hibridizacija jednog s- i jedan r- orbitale ( sp- hibridizacija) realizovano, na primer, u stvaranju berilijum hlorida. Kao što je gore prikazano, u pobuđenom stanju atom Be ima dva nesparena elektrona, od kojih jedan zauzima 2s orbitalu, a drugi zauzima 2p orbitalu. Kada se formira hemijska veza, ove dvije različite orbitale transformiraju se u dvije identične hibridne orbitale, usmjerene pod uglom od 180 ° jedna prema drugoj (slika 5.12). Linearni raspored dviju hibridnih orbitala odgovara njihovoj minimalnoj odbojnosti jedna od druge. Kao rezultat, molekula BeCl 2 ima linearnu strukturu - sva tri atoma nalaze se na istoj liniji.

Slika: 5.12. Šema preklapanja elektronskih orbitala tokom formiranja molekule BeCl 2
Struktura molekule acetilena; sigma i pi veze
Razmotrimo shemu preklapanja elektronskih orbitala tokom stvaranja molekule acetilena. U molekuli acetilena, svaki atom ugljenika je u sp-hibridnom stanju. Dvije sp-hibridne orbitale nalaze se pod uglom 1800 jedna prema drugoj; čine jednu σ-vezu između atoma ugljenika i dve σ-veze sa atomima vodonika (slika 5.13).

Slika: 5.13. Shema stvaranja s-veza u molekuli acetilena
Σ-veza je veza nastala kao rezultat preklapanja elektronskih orbitala duž linije koja povezuje atomska jezgra.
Svaki atom ugljenika u molekuli acetilena sadrži još dva p-elektrona, koji ne učestvuju u stvaranju σ-veza. Oblaci elektrona ovih elektrona nalaze se u međusobno okomitim ravninama i međusobno se preklapajući, formiraju još dvije π-veze između atoma ugljenika uslijed bočnog preklapanja nehibridnih r–Oblak (slika 5.14).
Π-veza je kovalentna hemijska veza koja nastaje kao rezultat povećanja gustine elektrona s obje strane linije koja povezuje jezgre atoma.

Slika: 5.14. Shema stvaranja σ - i π - veza u molekuli acetilena.
Dakle, u molekuli acetilena stvara se trostruka veza između atoma ugljenika, koja se sastoji od jedne σ-veze i dvije π-veze; σ - obveznice su jače od π - obveznica.
sp2- hibridizacija
Struktura molekula BC13 može se objasniti sa stanovišta sp 2- hibridizacija... Atom bora u pobuđenom stanju na vanjskom elektronskom sloju sadrži jedan s-elektron i dva p-elektrona, tj. tri nesparena elektrona. Ova tri elektronska oblaka mogu se transformirati u tri ekvivalentne hibridne orbitale. Minimalna odbojnost tri hibridne orbitale jedna od druge odgovara njihovom položaju u istoj ravni pod uglom od 120 o jedna prema drugoj (slika 5.15). Dakle, molekul BC13 je ravan.

Slika: 5.15. Ravna struktura molekula BC13
sp 3 - hibridizacija
Valentne orbitale atoma ugljenika (s, p x, p y, p z) mogu se pretvoriti u četiri ekvivalentne hibridne orbitale, koje su smještene u prostoru pod uglom od 109,5 o jedna prema drugoj i usmjerene prema temenima tetraedra, u čijem je središtu jezgra atoma ugljika (Sl. 5.16).
Slika: 5.16. Tetraedarska struktura molekula metana
5.1.8.3. Hibridizacija koja uključuje elektronske usamljene parove
Model hibridizacije može se koristiti za objašnjenje strukture molekula u kojima, osim veznih, postoje i usamljeni elektronski parovi. U molekulima vode i amonijaka ukupan broj elektronskih parova centralnog atoma (O i N) je četiri. U ovom slučaju, molekula vode sadrži dva, a molekula amonijaka jedan usamljeni elektronski par. Stvaranje hemijskih veza u ovim molekulima može se objasniti pretpostavkom da usamljeni elektronski parovi mogu ispuniti i hibridne orbitale. Nepodijeljeni elektronski parovi zauzimaju mnogo više prostora u svemiru od vezanih. Kao rezultat odbijanja koje se javlja između usamljenog i vezujućeg elektronskog para, uglovi veze u molekulama vode i amonijaka se smanjuju, a ispada da su manji od 109,5 o.

Slika: 5.17. sp 3 - hibridizacija uz učešće usamljenih elektronskih parova u molekulama H 2 O (A) i NH 3 (B)
5.1.8.4. Utvrđivanje tipa hibridizacije i određivanje strukture molekula
Da bi se utvrdila vrsta hibridizacije, a time i struktura molekula, potrebno je koristiti sljedeća pravila.
1. Tip hibridizacije centralnog atoma, koji ne sadrži usamljene elektronske parove, određuje se brojem sigma veza. Ako postoje dvije takve veze, odvija se sp-hibridizacija, tri - sp 2-hibridizacija, četiri - sp 3-hibridizacija. Nepodijeljeni elektronski parovi (u odsustvu veza nastalih mehanizmom donor-akceptor) odsutni su u molekulama formiranim od atoma berilija, bora, ugljenika, silicija, tj. elementi glavnih podskupina II - IV grupe.
2. Ako središnji atom sadrži usamljene elektronske parove, tada se broj hibridnih orbitala i vrsta hibridizacije određuju zbrojem broja sigma veza i broja usamljenih elektronskih parova. Hibridizacija uz učešće usamljenih elektronskih parova odvija se u molekulama formiranim od atoma azota, fosfora, kiseonika, sumpora, tj. elementi glavnih podskupina V i VI grupa.
3. Geometrijski oblik molekula određen je tipom hibridizacije središnjeg atoma (Tabela 5.3).
Tabela 5.3.
Uglovi veze, geometrijski oblik molekula u zavisnosti od broja hibridnih orbitala i vrste hibridizacije centralnog atoma
5.2. Jonska veza
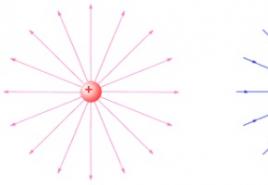
Jonska veza se vrši elektrostatičkim privlačenjem između suprotno nabijenih jona. Ovi joni nastaju kao rezultat prenosa elektrona s jednog atoma na drugi. Jonska veza nastaje između atoma s velikim razlikama u elektronegativnostima (obično veće od 1,7 na Paulingovoj skali), na primjer, između atoma alkalnog metala i halogena.
Razmotrimo stvaranje jonske veze na primjeru formiranja NaCl. Iz elektroničkih formula atoma Na 1s 2 2s 2 2p 6 3s 1 i Cl 1s 2 2s 2 2p 6 3s 2 3p 5 može se vidjeti da je za dovršetak eksternog nivoa atomu natrijuma lakše donirati jedan elektron nego pričvrstiti sedam, a atomu klora lakše ga je povezati, nego dati sedam. IN hemijske reakcije atom natrijuma daruje jedan elektron, a atom klora ga prihvata. Kao rezultat toga, elektronske ljuske atoma natrijuma i hlora transformišu se u stabilne elektronske ljuske plemenitih gasova (elektronska konfiguracija natrijumovog kationa Na + 1s 2 2s 2 2p 6, i elektronska konfiguracija anjora klora Cl - - 1s 2 2s 2 2p 6 3s 2 3p 6). Elektrostatička interakcija jona dovodi do stvaranja molekula NaCl.
Glavne karakteristike jonske veze i svojstva jonskih spojeva
1. Jonska veza je jaka hemijska veza. Energija ove veze je reda veličine 300 - 700 kJ / mol.
2. Za razliku od kovalentne veze, jonska veza je neusmjereno, budući da jon može privući jone suprotnog predznaka k sebi u bilo kojem smjeru.
3. Za razliku od kovalentne veze, jonska veza jeste nezasićen, jer interakcija jona suprotnog predznaka ne dovodi do potpune međusobne kompenzacije njihovih polja sila.
4. U procesu stvaranja molekula s jonskom vezom ne dolazi do potpunog prijenosa elektrona, stoga stopostotna jonska veza u prirodi ne postoji. U molekulu NaCl hemijska veza je samo 80% jonska.
5. Spojevi sa jonskim vezama su čvrste kristalne supstance sa visokim tačkama topljenja i ključanja.
6. Većina jonskih spojeva se rastvara u vodi. Otopine i otopine jonskih spojeva provode električnu struju.
5.3. Metalna veza
Atomi metala na vanjskom energetskom nivou sadrže mali broj valentnih elektrona. Budući da je energija jonizacije atoma metala mala, valentni elektroni se slabo zadržavaju u tim atomima. Kao rezultat, pozitivno nabijeni joni i slobodni elektroni pojavljuju se u kristalnoj rešetki metala. U ovom slučaju, metalni kationi nalaze se u čvorovima njihove kristalne rešetke, a elektroni se slobodno kreću u polju pozitivnih centara, tvoreći takozvani "elektronski gas". Prisustvo negativno nabijenog elektrona između dva kationa dovodi do činjenice da svaki kation djeluje s tim elektronom. Dakle, metalna veza je veza između pozitivnih jona u metalnim kristalima, koja se provodi privlačenjem elektrona koji se slobodno kreću kroz kristal.
Budući da su valentni elektroni u metalu ravnomjerno raspoređeni kroz kristal, metalna veza, poput jonske veze, je neusmjerena. Za razliku od kovalentne veze, metalna veza je nezasićena veza. Iz kovalentne veze metalna veza takođe se razlikuje po snazi. Energija metalne veze je otprilike tri do četiri puta manja od energije kovalentne veze.
Zbog velike pokretljivosti elektronskog gasa, metali se odlikuju velikom električnom i toplotnom provodljivošću.
5.4. Vodikova veza
U molekulama spojeva HF, H2O, NH3 postoje vodonične veze sa snažno elektronegativnim elementom (H - F, H - O, H - N). Između molekula takvih spojeva, međumolekularne vodonične veze... U nekim organskim molekulima koji sadrže veze N - O, N - N, intramolekularne vodonične veze.
Mehanizam stvaranja vodonične veze djelomično je elektrostatički, a dijelom donor-akceptorski. U ovom slučaju, donor elektronskog para je atom jako elektronegativnog elementa (F, O, N), a akceptor su atomi vodika povezani s tim atomima. Što se tiče kovalentne veze, vodoničnu vezu karakterišu fokus u svemiru i zasićenost.
Vodonična veza obično se označava tačkama: N ··· F. Vodonična veza se očituje što je jača, što je veća elektronegativnost partnerskog atoma i što je manja njegova veličina. Karakteristična je prvenstveno za spojeve fluora, kao i za kiseonik, u manjoj meri za azot, a još manje za klor i sumpor. U skladu s tim mijenja se i energija vodoničnih veza (Tabela 5.4).
Tabela 5.4.
Prosječne vrijednosti energija vodoničnih veza
Intermolekularna i intramolekularna vodonična veza
Zahvaljujući vodoničnim vezama, molekuli se kombiniraju u dimere i složenije asocijacije. Na primjer, stvaranje dimera mravlje kiseline može se predstaviti sljedećom shemom (slika 5.18).

Slika: 5.18. Stvaranje intermolekularnih vodikovih veza u mravlju kiselinu
Dugi lanci asocijacija (N 2 O) n mogu se pojaviti u vodi (slika 5.19).

Slika: 5.19. Stvaranje lanca asocijacija u tečnoj vodi usled međumolekularnih vodoničnih veza
Svaka molekula H 2 O može stvoriti četiri vodikove veze, a molekula HF samo dvije.
Vodikove veze mogu nastati i između različitih molekula (intermolekularna vodonična veza) i unutar molekula (intramolekularna vodonična veza). Primjeri stvaranja intramolekularne veze za neke organska materija prikazani su na sl. 5.20.

Slika: 5.20. Stvaranje intramolekularnih vodoničnih veza u molekulama različitih organskih jedinjenja
Uticaj vodonične veze na svojstva supstanci
Najprikladniji pokazatelj postojanja intermolekularne vodonične veze je tačka ključanja supstance. Viša tačka ključanja vode (100 o C u poređenju sa vodikovim spojevima elemenata podskupine kiseonika (H 2 S, H 2 Se, H 2 Te) objašnjava se prisustvom vodikovih veza: dodatna energija mora se potrošiti na uništavanje međumolekularnih vodikovih veza u vodi.
Vodonična veza može značajno uticati na strukturu i svojstva supstanci. Postojanje međumolekularnih vodoničnih veza povećava tačke topljenja i ključanja supstanci. Prisustvo intramolekularne vodonične veze dovodi do činjenice da se pokazalo da je molekul deoksiribonukleinske kiseline (DNA) namotan u vodi dvostruke zavojnice.
Vodonična veza takođe igra važnu ulogu u procesima rastvaranja, jer rastvorljivost takođe zavisi od sposobnosti spoja da formira vodonične veze sa rastvaračem. Kao rezultat toga, supstance koje sadrže OH skupine kao što su šećer, glukoza, alkoholi, karboksilne kiseline uglavnom su visoko topljive u vodi.
5.5. Vrste kristalnih rešetki
Čvrste materije su obično kristalne. Čestice koje čine kristale (atomi, ioni ili molekuli) nalaze se na strogo određenim točkama u prostoru, čineći kristalnu rešetku. Kristalna rešetka sastoji se od jediničnih ćelija koje zadržavaju strukturne karakteristike karakteristične za ovu rešetku. Pozvane su točke u kojima se nalaze čestice rešetkasti čvorovi... Ovisno o vrsti čestica koje se nalaze na mjestima rešetke i o prirodi veze između njih, razlikuju se 4 vrste kristalnih rešetki.
5.5.1. Atomska kristalna rešetka
Na čvorovima atomskih kristalnih rešetki nalaze se atomi povezani kovalentnim vezama. Supstance sa atomskom rešetkom uključuju dijamant, silicijum, karbide, silicide itd. Nemoguće je izolirati pojedinačne molekule u strukturi atomskog kristala; čitav kristal se smatra jednim gigantskim molekulom. Struktura dijamanta prikazana je na sl. 5.21. Dijamant se sastoji od atoma ugljenika, svaki povezan sa četiri susjedna atoma. Zbog činjenice da su kovalentne veze jake, sve supstance sa atomskim rešetkama su vatrostalne, čvrste i slabo isparljive. Slabo su rastvorljivi u vodi.

Slika: 5.21. Kristalna rešetka dijamanta
5.5.2. Molekularna kristalna rešetka
Na mjestima molekularnih kristalnih rešetki nalaze se molekuli povezani slabim intermolekularnim silama. Stoga supstance s molekularnom rešetkom imaju malu tvrdoću, topljive su, odlikuju se značajnom hlapljivošću, slabo su topive u vodi i njihove otopine u pravilu ne provode električnu struju. Poznato je puno supstanci s molekularnom kristalnom rešetkom. To su čvrsti vodonik, hlor, ugljen monoksid (IV) i druge supstance koje su u plinovitom stanju na uobičajenim temperaturama. Većina kristalnih organskih jedinjenja ima molekularnu rešetku.
5.5.3. Jonska kristalna rešetka
Nazvane su kristalne rešetke, na mjestima na kojima postoje joni jonski... Tvore ih supstance s jonskim vezama, na primjer halogenidi alkalnih metala. U jonskim kristalima pojedinačni molekuli se ne mogu razlikovati; cijeli kristal se može smatrati jednom makromolekulom. Veze između jona su jake, pa materije sa jonskom rešetkom imaju malu hlapljivost, visoku tačku topljenja i ključanja. Kristalna rešetka natrijum klorida prikazana je na sl. 5.22.

Slika: 5.22. Kristalna rešetka natrijum klorida
Na ovoj slici svjetlosne kuglice su joni Na +, a tamne Sl - joni. Lijevo na sl. 5.22 prikazuje jediničnu ćeliju NaCI.
5.5.4. Metalna kristalna rešetka
Metali u čvrstom stanju čine metalne kristalne rešetke. Mjesta takvih rešetki su pozitivni joni metala, a valentni elektroni se slobodno kreću između njih. Elektroni elektrostatički privlače katione, čime daju stabilnost metalna rešetka... Takva struktura rešetke određuje visoku toplotnu provodljivost, električnu provodljivost i plastičnost metala - tokom mehaničke deformacije nema prekida veza i uništenja kristala, jer joni zbog kojih izgleda kao da plutaju u oblaku elektronskog gasa. Na sl. 5.23 prikazuje kristalnu rešetku natrijuma.

Slika: 5.23. Kristalna rešetka natrijuma
Pomozite u rješavanju hemije, molim vas. Navedite vrstu veze u molekulima NH3, CaCl2, Al2O3, BaS ... i dobili najbolji odgovor
Odgovor Olge Ljabine [guru]
1) NH3 vrsta obveznice cov. polarni. tri nesparena elektrona dušika i jedan vodonika učestvuju u stvaranju veze. ne postoje pi veze. sp3 hibridizacija. Oblik molekule je piramidalan (jedna orbitala ne učestvuje u hibridizaciji, tetraedar se pretvara u piramidu)
Tip veze CaCl2 je jonski. formiranje veze uključuje dva elektrona kalcijuma u s-orbitalama, koji uzimaju dva atoma hlora, završavajući svoj treći nivo. Ne postoje pi veze, tip hibridizacije je sp. nalaze se u svemiru pod uglom od 180 stepeni
Tip veze Al2O3 je jonski. tri elektrona iz s i p orbitale aluminijuma učestvuju u stvaranju veze koju uzima kiseonik, završavajući svoj drugi nivo. O \u003d Al-O-Al \u003d O. postoje pi veze između kisika i aluminijuma. tip hibridizacije je sp najverovatnije.
Tip veze BaS je jonski. dva elektrona barijuma uzima sumpor. Ba \u003d S je jedna pi veza. hybridization sp. Ravan molekul.
2) AgNO3
srebro se smanjuje na katodi
K Ag + + e \u003d Ag
voda se na anodi oksidira
I 2H2O - 4e \u003d O2 + 4H +
prema Faradayevom zakonu (kako je ...) masa (zapremina) supstance koja se oslobađa na katodi proporcionalna je količini električne energije koja je prošla kroz rastvor
m (Ag) \u003d Me / zF * I * t \u003d 32,23 g
V (O2) \u003d Ve / F * I * t \u003d 1,67 l
Odgovor od 2 odgovora[guru]
Zdravo! Evo izbora tema s odgovorima na vaše pitanje: Molim vas, pomozite riješiti kemiju. Navedite vrstu veze u NH3, CaCl2, Al2O3, BaS ...
E. N. FRENKEL
Vodič iz hemije
Vodič za one koji ne znaju, ali žele znati i razumjeti kemiju
Dio I. Elementi opšte hemije
(prvi nivo težine)
Nastavak. Cm. u br. 13, 18, 23/2007;
6/2008
Poglavlje 4. Pojam hemijske veze
U prethodnim poglavljima ovog priručnika raspravljalo se o tome da se materija sastoji od molekula, a molekuli od atoma. Jeste li se ikad zapitali zašto atomi koji čine molekulu ne lete u različitim smjerovima? Šta zadržava atome u molekulu?
Oni su zadržani hemijska veza .
Da bismo razumjeli prirodu hemijske veze, dovoljno je podsjetiti se na jednostavan fizički eksperiment. Dvije kuglice obješene jedna o drugu na žicama ne reagiraju jedna na drugu ni na koji način. Ali ako jednoj kuglici date pozitivan naboj, a drugoj negativni, privući će ih jedno drugo. Nije li ta sila ta koja privlači atome jedni drugima? Zaista, istraživanja su to pokazala hemijska veza je električne prirode.
Odakle dolaze naboji u neutralnim atomima?
Članak je objavljen uz podršku internetskog kursa za pripremu ispita. Na web mjestu ćete pronaći sve potrebne materijale za samopripravu za ispit - izradu jedinstvenog plana pripreme za svakog korisnika, praćenje napretka po svakom predmetu predmeta, teoriji i zadacima. Svi zadaci odgovaraju najnovijim izmjenama i dopunama. Takođe postoji mogućnost da se zadaci iz pismenog dijela ispita pošalju na ispit stručnjacima kako bi se dobili bodovi i rad analizirao prema kriterijumima ocjenjivanja. Zadaci u obliku misija sa skupljanjem iskustva, položenim nivoima, primanjem bonusa i nagrada, takmičenjima sa prijateljima u Unified State Exam Areni. Da biste započeli pripremu, slijedite vezu: https://examer.ru.
Opisujući strukturu atoma, pokazalo se da svi atomi, osim atoma plemenitih plinova, teže da vežu ili doniraju elektrone. Razlog je formiranje stabilnog vanjskog nivoa od osam elektrona (kao u plemenitim plinovima). Kada se elektroni prime ili odustanu, nastaju električni naboji i, kao rezultat toga, elektrostatička interakcija čestica. Evo kako jonska veza , tj. veza između jona.
Joni su stabilne nabijene čestice koje nastaju kao rezultat prijema ili oslobađanja elektrona.
Na primjer, atom aktivnog metala i aktivni nemetal sudjeluje u reakciji:
U ovom procesu atom metala (natrijuma) donira elektrone:
![]()
a) Da li je takva čestica stabilna?
b) Koliko je elektrona ostalo u atomu natrijuma?
c) Hoće li ova čestica imati naboj?
Tako je u ovom procesu nastala stabilna čestica (8 elektrona na vanjskom nivou) koja od tada ima naboj natrijumova jezgra još uvijek ima naboj od +11, a preostali elektroni imaju ukupan naboj od -10. Stoga je naboj natrijumovog jona +1. Kratki sažetak ovog postupka izgleda ovako:
![]()
Šta se događa sa atomom sumpora? Ovaj atom prihvata elektrone dok se vanjski nivo ne završi:
![]()
Jednostavan proračun pokazuje da ova čestica ima naboj:
![]()
Privlače se suprotno nabijeni joni, što rezultira jonskom vezom i "jonskim molekulom":
Postoje i drugi načini stvaranja jona, o kojima će biti riječi u 6. poglavlju.
Formalno, ovo je sastav molekule koji se pripisuje natrijum sulfidu, iako supstanca koja se sastoji od jona ima približno sljedeću strukturu (slika 1):
Na ovaj način, supstance koje se sastoje od jona ne sadrže pojedinačne molekule! U ovom slučaju možemo govoriti samo o uslovnom "jonskom molekulu".
Zadatak 4.1. Pokažite kako dolazi do tranzicije elektrona kada dođe do jonske veze između atoma:
a) kalcijum i hlor;
b) aluminijum i kiseonik.
ZAPAMTITE! Atom metala donira vanjske elektrone; atom nemetala preuzima elektrone koji nedostaju.
Zaključak. Jonska veza prema gore opisanom mehanizmu nastaje između atoma aktivnih metala i aktivnih nemetala.
Studije, međutim, pokazuju da se ne dogodi uvijek potpuni prijelaz elektrona s jednog atoma na drugi. Vrlo često, hemijska veza ne nastaje davanjem-primanjem elektrona, već kao rezultat stvaranja zajedničkih elektronskih parova *. Ova veza se zove kovalentni .
Kovalentna veza nastaje uslijed stvaranja zajedničkih elektronskih parova... Ova vrsta veze nastaje, na primjer, između atoma nemetala. Dakle, poznato je da se molekul azota sastoji od dva atoma - N 2. Kako nastaje kovalentna veza između ovih atoma? Da bismo odgovorili na ovo pitanje, potrebno je razmotriti strukturu atoma azota:
Pitanje o sa. Koliko elektrona nedostaje da bi se završio spoljni nivo?
Odgovor: Nedostaju tri elektrona. Stoga, označivši tačkom svaki elektron vanjskog nivoa, dobivamo:
Pitanje o sa. Zašto su tri elektrona označena pojedinačnim tačkama?
Odgovor: Poanta je u tome da želimo pokazati stvaranje zajedničkih parova elektrona. Par su dva elektrona. Takav par nastaje, posebno ako svaki atom osigura jedan elektron za formiranje para. Atomu azota nedostaju tri elektrona da bi dovršio spoljni nivo. To znači da mora "pripremiti" tri pojedinačna elektrona za stvaranje budućih parova (slika 2).
Primljeno elektronska formula molekula azot, što pokazuje da svaki atom dušika sada ima osam elektrona (šest ih je zaokruženo u ovalni plus 2 svoja); tri zajednička para elektrona pojavila su se između atoma (mjesto presijecanja krugova).
Svaki par elektrona odgovara jednoj kovalentnoj vezi. Koliko kovalentnih veza postoji? Tri. Svaka veza (svaki zajednički par elektrona) prikazat će se crticom (valentni udar):
![]()
Sve ove formule, međutim, ne daju odgovor na pitanje: šta veže atome tokom stvaranja kovalentne veze? Elektronska formula pokazuje da se ukupan par elektrona nalazi između atoma. Prekomjerni negativni naboj nastaje u ovom području prostora. A jezgra atoma, kao što znate, imaju pozitivan naboj. Dakle, jezgre oba atoma privlači zajednički negativni naboj koji je nastao zbog zajedničkih elektronskih parova (tačnije, presjeka elektronskih oblaka) (slika 3).
Može li postojati takva veza između različitih atoma? Može. Neka atom dušika komunicira s atomima vodika:
Struktura atoma vodonika pokazuje da atom ima jedan elektron. Koliko takvih atoma trebate uzeti da bi atom azota „dobio ono što želi“ - tri elektrona? Očigledno tri atoma vodonika
(sl. 4):
Krst na sl. 4 označava elektrone atoma vodonika. Elektronska formula molekule amonijaka pokazuje da atom dušika ima osam elektrona, a svaki atom vodonika ima dva elektrona (i ne može ih biti više na prvom nivou energije).
Grafička formula pokazuje da atom dušika ima valenciju tri (tri crtice ili tri valentne trake), a svaki atom vodika ima valenciju jednu (po jedna crtica).
Iako i molekuli N 2 i NH 3 sadrže isti atom dušika, hemijske veze između atoma međusobno se razlikuju. U molekulu azota N 2 nastaju hemijske veze identični atomiStoga su zajednički parovi elektrona u sredini između atoma. Atomi ostaju neutralni. Ova hemijska veza se naziva nepolarni .
U molekulu amonijaka NH 3 nastaje hemijska veza različiti atomi... Stoga jedan od atoma (u ovom slučaju atom dušika) snažnije privlači zajednički par elektrona. Uobičajeni parovi elektrona pomaknuti su prema atomu dušika i na njemu nastaje mali negativni naboj, a na atomu vodonika pozitivan naboj, polovi električne struje - veza polarni (sl. 5).
Većina supstanci izgrađenih kovalentnim vezama sastoji se od pojedinačnih molekula (slika 6).
Sl. 6 pokazuje da postoje hemijske veze između atoma, ali između molekula one odsutne ili su beznačajne.
Tip hemijske veze utiče na svojstva supstance i njeno ponašanje u otopinama. Dakle, što je više, što je značajnija privlačnost između čestica, teže ih je razdvojiti jedna od druge i teže je pretvoriti čvrstu supstancu u plinovito ili tečno stanje. Pokušajte na donjem dijagramu odrediti između kojih čestica je sila interakcije veća i koja se hemijska veza stvara u ovom slučaju (slika 7).
Ako pažljivo pročitate poglavlje, vaš odgovor će biti sljedeći: maksimalna interakcija između čestica javlja se u slučaju I (jonska veza). Stoga su sve takve supstance čvrste. Najmanja interakcija između nenabijenih čestica (slučaj III - nepolarna kovalentna veza). Takve supstance su najčešće gasovi.
Zadatak 4.2. Utvrdite kakva se hemijska veza vrši između atoma u supstancama: NaCl, HCl, Cl 2, AlCl 3, H 2 O. Dajte objašnjenja.
Zadatak 4.3. Napravite elektroničke i grafičke formule za te supstance iz zadatka 4.2, u kojem ste utvrdili prisustvo kovalentne veze. Za jonsko vezivanje izradite šeme prenosa elektrona.
Poglavlje 5. Rješenja
Ne postoji osoba na Zemlji koja ne bi vidjela rješenja. A šta je to?
Otopina je homogena smjesa dviju ili više komponenata (sastojaka ili supstanci).
Šta je homogena smeša? Homogenost smjese sugerira ono između sastojaka nema interfejsa... U ovom slučaju, nemoguće je, barem vizuelno, utvrditi koliko je tvari tvorilo datu smjesu. Na primjer, gledajući vodu iz slavine u čaši, teško je pretpostaviti da, osim molekula vode, sadrži još desetak jona i molekula (O 2, CO 2, Ca 2+ itd.). I nijedan mikroskop vam ne može pomoći da vidite ove čestice.
Ali odsustvo interfejsa nije jedini znak ujednačenosti. U homogenoj smjesi sastav smjese je isti u bilo kojem trenutku... Zbog toga je za dobivanje otopine potrebno temeljito pomiješati komponente (tvari) koje ga čine.
Rješenja mogu imati različito agregirano stanje:
Plinovite otopine (na primjer, zrak je mješavina plinova O 2, N 2, CO 2, Ar);
Tečne otopine (na primjer, kolonjska voda, sirup, salamura);
Čvrste otopine (npr. Legure).
Jedna od supstanci koje tvore otopinu je tzv rastvarač... Rastvarač ima isto agregatno stanje kao i rastvor. Dakle, za tečne otopine to je tečnost: voda, ulje, benzin itd. Najčešće se u praksi koriste vodeni rastvori. O njima će se dalje razgovarati (osim ako se ne izvrši odgovarajuća rezervacija).
Šta se događa kada se razne supstance rastvore u vodi? Zašto se neke supstance dobro rastvaraju u vodi, dok se druge ne rastvaraju? Šta određuje topljivost - sposobnost supstance da se otopi u vodi?
Zamislimo da se kocka šećera stavi u čašu tople vode. Legao je, smanjio se i ... nestao. Kuda? Da li je prekršen zakon očuvanja materije (njene mase, energije)? Ne. Otpijte gutljaj rezultirajuće otopine i uvjerit ćete se da je voda slatka, da šećer nije nestao. Ali zašto to ne vidiš?
Činjenica je da se tokom otapanja događa drobljenje (mlevenje) supstance. U ovom slučaju, kocka šećera se raspala na molekule i mi ih ne možemo vidjeti. Da, ali zašto se šećer na stolu ne raspada na molekule? Zašto komad margarina, umočen u vodu, takođe ne nestane? Ali zato što se drobljenje otopljene tvari događa pod dejstvom rastvarača, kao što je voda. Ali otapalo će moći "odvojiti" kristal, čvrstu supstancu u molekule ako bude u stanju da "uhvati" ove čestice. Drugim riječima, kada se supstanca otopi, mora postojati interakcija između supstance i rastvarača.
Kada je moguća ova interakcija? Samo u slučaju kada je struktura supstanci (otopljenih i rastvarača) slična, slična. Pravilo alhemičara je odavno poznato: "slično se rastvara u slično." U našim primjerima molekuli šećera su polarni i postoje određene sile interakcije između njih i polarnih molekula vode. Ne postoje takve sile između nepolarnih molekula masti i polarnih molekula vode. Stoga se masti ne rastvaraju u vodi. Na ovaj način, rastvorljivost ovisi o prirodi otopljene otopine i rastvarača.
Kao rezultat interakcije supstance i vode nastaju spojevi - hidratizira... To mogu biti vrlo jake veze:

Takvi spojevi postoje kao pojedinačne supstance: baze, kiseline koje sadrže kiseonik. Prirodno, tijekom stvaranja ovih spojeva nastaju jake kemijske veze i oslobađa se toplina. Dakle, kada se CaO (živi kreč) otopi u vodi, oslobađa se toliko toplote da smjesa proključa.
Ali zašto se rezultirajuća otopina ne zagrije kada se šećer ili sol otope u vodi? Prvo, nisu svi hidrati tako jaki kao sumporna kiselina ili kalcijum hidroksid. Postoje hidrati soli (kristalni hidrati)koji se lako razgrađuju zagrijavanjem:

Drugo, tokom otapanja, kao što je već spomenuto, odvija se proces drobljenja. A za to se troši energija, apsorbira toplota.
Budući da se oba procesa odvijaju istovremeno, otopina se može zagrijati ili hladiti, ovisno o tome koji proces prevladava.
Zadatak 5.1. Utvrdite koji postupak - drobljenje ili hidratacija - prevladava u svakom slučaju:
a) pri rastvaranju sumporne kiseline u vodi, ako se rastvor zagreva;
b) pri rastvaranju amonijum nitrata u vodi, ako se rastvor ohladi;
c) kada se natrijum hlorid otopi u vodi, ako se temperatura otopine praktično nije promijenila.
Budući da se temperatura otopine tijekom otapanja mijenja, prirodno je to pretpostaviti rastvorljivost ovisi o temperaturi... Zapravo, topljivost većine čvrstih supstanci povećava se zagrijavanjem. Topljivost plinova se smanjuje zagrijavanjem. Stoga se čvrste supstance obično rastvaraju u toplim ili vruća vodaa gazirana pića čuvaju se na hladnom.
Topljivost (sposobnost rastvaranja) supstance ne ovisi o mljevenju supstance ili intenzitetu miješanja... Ali povećanjem temperature, mljevenjem supstance, miješanjem gotove otopine možete ubrzati postupak otapanja. Promjenom uslova za dobijanje rješenja možete dobiti rješenja različitog sastava. Prirodno, postoji granica do koje je lako doći da se supstanca više ne rastvara u vodi. Ovo rješenje se zove zasićen... Za visoko rastvorljive supstance zasićena otopina sadržavat će puno otopljene tvari. Dakle, zasićena otopina KNO 3 na 100 ° C sadrži 245 g soli na 100 g vode (u 345 g otopine), to je koncentrirano rješenje. Zasićene otopine slabo topljivih supstanci sadrže zanemarive mase rastvorenih jedinjenja. Dakle, zasićena otopina srebrnog klorida sadrži 0,15 mg AgCl u 100 g vode. Ovo je vrlo razblažen rješenje.
Prema tome, ako otopina sadrži puno otopljene otopine u odnosu na otapalo, ona se naziva koncentriranom, ako je tvar malo razrijeđena. Svojstva otopine vrlo često ovise o sastavu otopine, a time i o primjeni.
Dakle, razblaženi rastvor sirćetna kiselina (stolni ocat) koristi se kao aroma, a koncentrirana otopina ove kiseline (esencija octa kada se uzima oralno) može prouzročiti smrtne opekline.
Da biste odrazili kvantitativni sastav otopina, koristite vrijednost tzv maseni udio otopljene supstance :
gde m(in-va) - masa rastvorene supstance u rastvoru; m(rastvor) - ukupna masa otopine koja sadrži otopljenu supstancu i rastvarač.
Dakle, ako 100 g octa sadrži 6 g octene kiseline, onda dolazi oko 6% rastvora sirćetne kiseline (ovo je stolni ocat). Metode za rješavanje problema pomoću koncepta masenog udjela otopljene tvari bit će razmotrene u poglavlju 8.
Zaključci za poglavlje 5. Otopine su homogene smjese koje se sastoje od najmanje dvije supstance, od kojih se jedna naziva rastvarač, a druga je otopljena tvar. Kada se otopi, ova supstanca stupa u interakciju s rastvaračem, zbog čega se otopljena supstanca drobi. Sastav otopine izražava se masenim udjelom otopljene tvari u otopini.
* Ovi elektronski parovi potječu od presjeka elektronskih oblaka.
Nastavlja se
3.3.1 Kovalentna veza - Ovo je dvocentrična dvoelektronska veza nastala uslijed preklapanja oblaka elektrona koji nose nesparene elektrone sa antiparalelnim spinovanjima. U pravilu nastaje između atoma istog hemijskog elementa.
Kvantitativno ga karakteriše valenca. Valensija elementa - to je njegova sposobnost stvaranja određenog broja hemijskih veza zbog slobodnih elektrona smještenih u atomskoj valentnoj traci.
Kovalentnu vezu formira samo par elektrona smještenih između atoma. Zove se podijeljeni par. Preostali parovi elektrona nazivaju se usamljeni parovi. Pune ljuske i ne sudjeluju u vezivanju. Vezu između atoma može provesti ne samo jedan, već i dva ili čak tri podijeljena para. Takve veze se nazivaju dvostruko i t roj - višestruke veze.
3.3.1.1 Kovalentna nepolarna veza. Poziva se veza izvedena stvaranjem elektronskih parova, koji podjednako pripadaju oba atoma kovalentni nepolarni. Nastaje između atoma s praktički jednakom elektronegativnošću (0,4\u003e ΔEO\u003e 0) i, prema tome, ravnomjernom raspodjelom elektronske gustine između atomskih jezgara homonuklearnih molekula. Na primjer, H2, O2, N2, Cl2, itd. Dipolni moment takvih veza je nula. CH veza u zasićenim ugljikovodicima (na primjer, u CH 4) smatra se praktički nepolarnom, jer Δ EO \u003d 2,5 (C) - 2,1 (H) \u003d 0,4.
3.3.1.2 Kovalentna polarna veza. Ako molekulu tvore dva različita atoma, tada se preklapajuća zona elektronskih oblaka (orbitala) pomiče prema jednom od atoma, a takva veza se naziva polarni ... S takvom vezom veća je vjerovatnoća pronalaska elektrona u blizini jezgra jednog od atoma. Na primjer, HCl, H2S, PH3.
Polarna (asimetrična) kovalentna veza - veza između atoma sa različitom elektronegativnošću (2\u003e ΔEO\u003e 0,4) i asimetričnom raspodjelom ukupnog elektronskog para. Tipično se formira između dva nemetala.
Gustina elektrona takve veze pomaknuta je prema elektronegativnijem atomu, što dovodi do pojave djelomičnog negativnog naboja (delta minus), a djelomičnog pozitivnog naboja (delta plus) na manje elektronegativnom atomu
C Cl C O C N O H C Mg .
Smjer pomaka elektrona također je označen strelicom:
CCl, CO, CN, ON, CMg.
Što je veća razlika u elektronegativnosti vezanih atoma, to je veći polaritet veze i veći je njen dipolni moment. Dodatne sile privlačenja djeluju između djelomičnih naboja suprotnog predznaka. Stoga, što je polarnija veza, to je jača.
Osim toga polariziranost kovalentna veza ima svojstvo zasićenje - sposobnost atoma da formira onoliko kovalentnih veza koliko ima energetski dostupnih atomskih orbitala. Treće svojstvo kovalentne veze je njeno fokus.
3.3.2 Jonska veza. Pokretačka snaga njegovog nastanka je ista težnja atoma ka oktet ljusci. Ali u brojnim slučajevima, takva oktetna ljuska može nastati samo kada se elektroni prebace s jednog atoma na drugi. Stoga se u pravilu između metala i nemetala stvara jonska veza.
Razmotrimo kao primjer reakciju između atoma natrijuma (3s 1) i fluora (2s 2 3s 5). Razlika u elektronegativnosti u spoju NaF
OEO \u003d 4,0 - 0,93 \u003d 3,07
Natrijum, dajući svoj 3s 1 -elektron fluoru, postaje jon Na + i ostaje sa ljuskom ispunjenom 2s 2 2p 6, što odgovara elektronskoj konfiguraciji neonskog atoma. Fluor dobiva potpuno istu elektroničku konfiguraciju prihvatanjem jednog elektrona doniranog natrijumom. Kao rezultat, postoje sile elektro-statičkog privlačenja između suprotno nabijenih jona.
Jonska veza - ekstremni slučaj polarne kovalentne veze zasnovan na elektrostatičkoj privlačnosti jona. Takva veza nastaje kada postoji velika razlika u elektronegativnosti vezanih atoma (EO\u003e 2), kada se manje elektronegativni atom gotovo u potpunosti odriče svojih valentnih elektrona i pretvara u kation, a drugi, elektronegativniji atom, veže te elektrone i postaje anion. Interakcija jona suprotnog predznaka ne ovisi o smjeru, a Kulonove sile ne posjeduju svojstvo zasićenja. Zbog ovoga jonska veza nema prostorni fokus i zasićenje , budući da je svaki ion povezan s određenim brojem protioiona (koordinacijski broj jona). Stoga jonski spojeni spojevi nemaju molekularnu strukturu i čvrste su tvari koje tvore ionske kristalne rešetke, s visokim tačkama topljenja i ključanja, vrlo su polarne, često slane i u vodenim otopinama elektroprovodljive. Na primjer, MgS, NaCl, A 2 O 3. Spojevi sa čisto jonskim vezama praktično ne postoje, jer određeni udio kovalentnosti uvijek ostaje zbog činjenice da se ne uočava potpuni prijelaz jednog elektrona u drugi atom; u većini "jonskih" supstanci udio ionske veze ne prelazi 90%. Na primjer, u NaF, polarizacija veze je oko 80%.
U organskim spojevima, jonske veze su prilično rijetke, jer atom ugljenika nije sklon gubljenju ili dobijanju elektrona da bi stvorio ione.
Valence elementi u spojevima sa jonskim vezama vrlo često karakteriziraju oksidaciono stanje , što, pak, odgovara veličini naboja jona elementa u datom spoju.
Stanje oksidacije je uvjetni naboj koji atom stječe kao rezultat preraspodjele gustine elektrona. Kvantitativno je karakteriziran brojem raseljenih elektrona iz manje elektronegativnog elementa u elektronegativni. Pozitivno nabijeni ion nastaje od elementa koji je donirao svoje elektrone, a negativni ion od elementa koji je primio te elektrone.
Element smješten u najviše oksidaciono stanje (maksimalno pozitivan), već se odrekao svih svojih valentnih elektrona koji se nalaze u AVZ. A budući da je njihov broj određen brojem grupe u kojoj se nalazi element, onda najviše oksidaciono stanje za većinu elemenata i biće jednako broj grupe ... Što se tiče najniže oksidaciono stanje (maksimalno negativan), tada se pojavljuje tokom formiranja osmoelektronske ljuske, odnosno u slučaju kada je AVZ potpuno napunjen. Za nemetali izračunava se po formuli Broj grupe - 8 ... Za metali jednako nula , jer ne mogu prihvatiti elektrone.
Na primjer, AVZ sumpora ima oblik: 3s 2 3p 4. Ako atom pokloni sve elektrone (šest), steći će najviše oksidaciono stanje +6 jednak broju grupe VI , ako su potrebna dva, da bi se postigla stabilna ljuska, tada se postiže najniže oksidaciono stanje –2 jednak Broj grupe - 8 \u003d 6 - 8 \u003d –2.
3.3.3 Metalna veza. Većina metala ima niz svojstava koja su općenite prirode i razlikuju se od svojstava ostalih supstanci. Ova svojstva su relativno visoke tačke topljenja, sposobnost odbijanja svjetlosti, velika toplina i električna provodljivost. Te se osobine objašnjavaju postojanjem posebne vrste interakcije u metalima – metalni priključak.
U skladu s položajem u periodnom sustavu, atomi metala imaju mali broj valentnih elektrona, koji su prilično slabo vezani za njihove jezgre i lako se mogu odvojiti od njih. Kao rezultat, u kristalnoj rešetki metala pojavljuju se pozitivno nabijeni ioni, lokalizirani u određenim položajima kristalne rešetke, i veliki broj delokaliziranih (slobodnih) elektrona, koji se relativno slobodno kreću u polju pozitivnih centara i izvode vezu između svih atoma metala zbog elektrostatičke privlačnosti.
Ovo je važna razlika između metalnih veza i kovalentnih veza koje imaju strogu orijentaciju u prostoru. Sile vezivanja u metalima nisu lokalizirane i nisu usmjerene, a slobodni elektroni, formirajući "elektronski plin", uzrokuju visoku toplotnu i električnu provodljivost. Stoga je u ovom slučaju nemoguće govoriti o pravcu veza, jer su valentni elektroni raspoređeni gotovo ravnomjerno po kristalu. To je ono što objašnjava, na primjer, plastičnost metala, tj. Mogućnost pomicanja iona i atoma u bilo kojem smjeru
3.3.4 Obveznica donatora-akceptora. Pored mehanizma za stvaranje kovalentne veze, prema kojem zajednički elektronski par nastaje kada dva elektrona međusobno djeluju, postoji i posebna mehanizam donor-akceptor ... Sastoji se u činjenici da se kovalentna veza formira kao rezultat prijelaza već postojećeg (nepodijeljenog) elektronskog para donator (dobavljač elektrona) za opštu upotrebu davaoca i akceptor (dobavljač slobodne atomske orbitale).
Jednom formiran, ne razlikuje se od kovalentnog. Mehanizam donor-akceptor dobro ilustrira šema za formiranje amonijum-jona (slika 9) (zvjezdice označavaju elektrone vanjskog nivoa atoma dušika):

Slika 9 - Dijagram stvaranja amonijum-jona
Elektronska formula ABZ atoma dušika je 2s 2 2p 3, odnosno ima tri nesparena elektrona, koji ulaze u kovalentnu vezu sa tri atoma vodonika (1s 1), od kojih svaki ima jedan valentni elektron. U tom slučaju nastaje molekul amonijaka NH 3 u kojem se zadržava usamljeni elektronski par dušika. Ako se ovoj molekuli približi protok vodonika (1s 0), koji nema elektrone, tada će dušik prenijeti svoj par elektrona (donor) na ovu atomsku vodoničnu orbitalu (akceptor), što će rezultirati stvaranjem amonijevog iona. U njemu je svaki atom vodonika vezan za atom dušika zajedničkim elektronskim parom, od kojih se jedan realizuje prema mehanizmu donor-akceptor. Važno je to napomenuti komunikacija H-Nnastali raznim mehanizmima nemaju razlike u svojstvima. Ovaj fenomen je posljedica činjenice da u trenutku stvaranja veze orbitale 2s– i 2p– elektrona atoma dušika mijenjaju svoj oblik. Kao rezultat, pojavljuju se četiri orbitale potpuno istog oblika.
Donatori su obično atomi sa velikim brojem elektrona, ali koji imaju mali broj nesparenih elektrona. Za elemente iz perioda II takva mogućnost je, pored atoma dušika, dostupna i za kisik (dva usamljena para) i za fluor (tri usamljena para). Na primjer, jon vodonika H + u vodenim rastvorima nikada nije u slobodnom stanju, jer se jon hidronija H 3 O + uvijek formira iz molekula vode H 2 O i jona H + Hion hidronija je prisutan u svim vodenim rastvorima, iako je zbog jednostavnosti u pisanju sačuvan simbol H +.
3.3.5 Vodikova veza. Atom vodonika vezan za jako elektronegativni element (azot, kiseonik, fluor, itd.), Koji na sebe "navlači" zajednički elektronski par, nema elektrone i dobija efektivan pozitivan naboj. Stoga je u mogućnosti da stupi u interakciju sa usamljenim parom elektrona drugog elektronegativnog atoma (koji dobija efektivni negativni naboj) istog (intramolekularna veza) ili drugog molekula (intermolekularna veza). Rezultat je vodonična veza , što je grafički označeno tačkama:

Ova veza je mnogo slabija od ostalih hemijskih veza (energija njenog stvaranja je 10 – 40 kJ / mol) i uglavnom ima djelomično elektrostatički, a dijelom donor-akceptorski karakter.
Vodikova veza igra izuzetno važnu ulogu u biološkim makromolekulama, poput anorganskih spojeva kao što su H20, H2F2, NH3. Na primjer, veze O - N u N 2 O imaju primjetan polarni karakter s viškom negativnog naboja – na atomu kiseonika. Atom vodonika, naprotiv, stječe mali pozitivni naboj + i može komunicirati s usamljenim parovima elektrona atoma kiseonika susjednog molekula vode.
Pokazalo se da je interakcija između molekula vode dovoljno jaka da čak i u vodenoj pari postoje dimeri i trimeri sastava (H 2 O) 2, (H 2 O) 3 itd. U otopinama se mogu pojaviti dugi lanci saradnika sljedeće vrste:
jer atom kisika ima dva usamljena para elektrona.
Prisustvo vodoničnih veza objašnjava visoke tačke ključanja vode, alkohola, karboksilnih kiselina. Zbog vodoničnih veza vodu karakteriziraju tako visoke tačke topljenja i ključanja u odnosu na H 2 E (E \u003d S, Se, Te). Da nije bilo vodoničnih veza, tada bi se voda topila na –100 ° S, a ključala na –80 ° S. Tipični slučajevi povezivanja uočavaju se za alkohole i organske kiseline.
Vodikove veze mogu nastati kako između različitih molekula, tako i unutar molekula ako ovaj molekul sadrži grupe sa sposobnostima donora i akceptora. Na primjer, intramolekularne vodikove veze igraju glavnu ulogu u stvaranju peptidnih lanaca koji određuju strukturu proteina. H-veze utiču na fizička i hemijska svojstva supstance.
Vodikove veze ne tvore atome drugih elemenata , budući da su sile elektrostatičkog privlačenja suprotnih krajeva dipola polarne veze (O-H, N-H, itd.) prilično slabe i djeluju samo na malim udaljenostima. Vodik, koji ima najmanji atomski radijus, omogućava da se takvi dipoli približe do te mjere da sile privlačenja postanu primjetne. Nijedan drugi element sa velikim atomskim radijusom nije sposoban stvoriti takve veze.
3.3.6 Sile intermolekularne interakcije (Van der Waalsove snage). 1873. holandski naučnik I. Van der Waals sugerirao je da postoje sile koje uzrokuju privlačenje između molekula. Te snage su kasnije nazvane van der Waalsove snage. – najsvestraniji tip intermolekularne veze. Energija van der Waalsove veze manja je od vodonične veze i iznosi 2–20 kJ / ∙ mol.
Ovisno o načinu nastanka sile se dijele na:
1) orijentacijski (dipol-dipol ili ion-dipol) - javljaju se između polarnih molekula ili između iona i polarnih molekula. Kada se polarni molekuli približe jedni drugima, oni su orijentirani tako da je pozitivna strana jednog dipola orijentirana prema negativnoj strani drugog dipola (slika 10).
|
Slika 10 - Orijentacijska interakcija |
||||
2) induktivni (dipol izazvan dipolom ili dipol izazvan jonima) - nastaju između polarnih molekula ili jona i nepolarnih molekula, ali sposobni za polarizaciju. Dipoli mogu djelovati na nepolarne molekule, pretvarajući ih u naznačene (usmjerene) dipole. (Slika 11).
|
Slika 11 - Induktivna interakcija |
||||
3) disperzivni (inducirani dipol - inducirani dipol) - nastaju između nepolarnih molekula sposobnih za polarizaciju. U bilo kojoj molekuli ili atomu plemenitog plina javljaju se fluktuacije električne gustine, uslijed čega se pojavljuju trenutni dipoli, koji zauzvrat indukuju trenutne dipole u susjednim molekulama. Kretanje trenutnih dipola postaje koordinirano, njihov izgled i raspad se javljaju sinhrono. Kao rezultat interakcije trenutnih dipola, energija sistema opada (slika 12).
|
Slika 12 - Interakcija disperzije |
|||||||
7.11. Struktura supstanci sa kovalentnom vezom
Supstance u kojima je od svih vrsta hemijskih veza prisutna samo kovalentna podijeljene su u dvije nejednake skupine: molekularne (jako puno) i nemolekularne (mnogo manje).
Kristali čvrstih molekularnih supstanci sastoje se od slabo međusobno povezanih sila međumolekularne interakcije molekula. Takvi kristali nemaju visoku čvrstoću i tvrdoću (sjetite se leda ili šećera). Takođe imaju niske tačke topljenja i ključanja (vidi tabelu 22).
Tabela 22. Tačke topljenja i ključanja nekih molekularnih supstanci
Supstanca |
Supstanca |
||||
| H 2 | – 259 | – 253 | Br 2 | – 7 | 58 |
| N 2 | – 210 | – 196 | H 2 O | 0 | 100 |
| HCl | – 112 | – 85 | P 4 | 44 | 257 |
| NH 3 | – 78 | – 33 | C 10 H 8 (naftalen) | 80 | 218 |
| SO 2 | – 75 | – 10 | S 8 | 119 |
Za razliku od njihovih molekularnih kolega, nemolekularne supstance sa kovalentnom vezom formiraju vrlo tvrde kristale. Dijamantski kristali (najtvrđa tvar) su ove vrste.
U dijamantskom kristalu (slika 7.5), svaki atom ugljenika vezan je za četiri druga atoma ugljenika jednostavnim kovalentnim vezama (sp 3-hibridizacija). Atomi ugljenika čine trodimenzionalni okvir. U osnovi, cijeli dijamantski kristal je jedan ogroman i vrlo jak molekul.
Kristali silicijuma, koji se široko koriste u radio-elektronici i elektroničkom inženjerstvu, imaju istu strukturu.
Ako polovinu atoma ugljenika u dijamantu zamijenite atomima silicija bez narušavanja strukture kostura kristala, dobit ćete kristal silicijevog karbida SiC - također vrlo tvrdu tvar koja se koristi kao abrazivni materijal. Obični kvarcni pijesak (silicijum dioksid) također pripada ovoj vrsti kristalne supstance. Kvarc je vrlo čvrsta supstanca; pod nazivom "šmirgl" koristi se i kao abraziv. Kvarcnu strukturu je lako dobiti ako su atomi kiseonika umetnuti između svaka dva atoma silicijuma u kristalu silicijuma. U tom će slučaju svaki atom silicija biti povezan s četiri atoma kisika, a svaki atom kisika - s dva atoma silicija.
Kristali dijamanta, silicija, kvarca i sličnih struktura nazivaju se atomski kristali.
Atomski kristal - kristal koji se sastoji od atoma jednog ili više elemenata povezanih hemijskim vezama.
Hemijska veza u atomskom kristalu može biti kovalentna ili metalna.
Kao što već znate, bilo koji atomski kristal, poput jonskog, ogromna je "supermolekula". Nemoguće je zapisati strukturnu formulu takve "supermolekule" - možete prikazati samo njen fragment, na primjer:

Za razliku od molekularnih supstanci, supstance koje tvore atomske kristale su među najneotpornijim (vidjeti tabelu 23.).
Tabela 23. Tačke topljenja i ključanja nekih nemolekularnih supstanciod kovalentne veze
Tako visoke temperature topljenja sasvim su razumljive ako se sjetimo da se, kada se te supstance tope, ne prekidaju slabe intermolekularne veze, već jake hemijske veze. Iz istog razloga, mnoge supstance koje tvore atomske kristale ne tope se zagrijavanjem, već se raspadaju ili odmah prelaze u parno stanje (sublimacija), na primjer, grafit sublimira na 3700 o S.
| Silicij - Si. Vrlo tvrdi, krhki kristali silicija izgledom su slični metalu, ali on je nemetalan. Po vrsti električne provodljivosti ova supstanca pripada poluvodičima, što određuje njenu ogromnu važnost u savremenom svijetu. Silicij je najvažniji poluprovodnički materijal. Radio, televizori, računari, moderni telefoni, elektronski satovi, solarne baterije i mnogi drugi kućanski i industrijski uređaji sadrže tranzistore, mikrovezje i fotoćelije izrađene od silicijumovih monokristala visoke čistoće kao najvažnije strukturne elemente. Tehnički silicijum se koristi u proizvodnji čelika i obojenoj metalurgiji. Prema svojim kemijskim svojstvima silicij je prilično inertna tvar, reagira samo na visokim temperaturama Silicijum dioksid - SiO 2. Drugo ime ove supstance je silicijum dioksid. Silicijum dioksid se prirodno javlja u dva oblika: kristalnom i amorfnom. Mnogo poludragog i poludragog kamenja su sorte kristalnog silicijum dioksida (kvarc): kameni kristal, jaspis, kalcedon, ahat. a opal je amorfni oblik silicijevog dioksida. Kvarc je u prirodi vrlo raširen, jer su dine u pustinjama i na obalama rijeka i mora kvarcni pijesak. Kvarc je bezbojna kristalna, vrlo tvrda i vatrostalna tvar. U pogledu tvrdoće inferiorna je od dijamanta i korunda, ali se unatoč tome široko koristi kao abrazivni materijal. Kvarcni pijesak se široko koristi u građevinarstvu i industriji građevinskih materijala. Kvarcno staklo koristi se za proizvodnju laboratorijskog staklenog posuđa i naučnih instrumenata, jer ne puca kada se temperatura naglo promijeni. Prema njihovim hemijska svojstva silicijum dioksid je kiseli oksid, ali reagira s lužinama samo kada se fuzija. Na visokim temperaturama silicijum karbid - karborundum se dobija iz silicijum dioksida i grafita. Karborundum je druga najtvrđa tvar nakon dijamanta, a koristi se i za proizvodnju brusnih ploča i "brusnog" papira. |
7.12. Polaritet kovalentne veze. Elektronegativnost
Prisjetimo se da izolirani atomi različitih elemenata imaju različite tendencije da daju i primaju elektrone. Te razlike traju i nakon stvaranja kovalentne veze. Odnosno, atomi nekih elemenata teže privlačenju elektronskog para kovalentne veze jačeg od atoma drugih elemenata.
Razmotrimo molekul HCl.
Koristeći ovaj primjer, pogledajmo kako možete procijeniti pomicanje oblaka elektronske veze koristeći molarne energije jonizacije i sredstva za elektron. 1312 kJ / mol i 1251 kJ / mol - razlika je neznatna, oko 5%. 73 kJ / mol i 349 kJ / mol - ovdje je razlika mnogo veća: energija afiniteta elektrona atoma hlora gotovo je pet puta veća od atoma vodonika. Stoga možemo zaključiti da je elektronski par kovalentne veze u molekuli hlorovodonika u velikoj mjeri pomaknut prema atomu hlora. Drugim riječima, vezani elektroni provode više vremena u blizini atoma hlora nego u blizini atoma vodonika. Takva neravnomjerna raspodjela elektronske gustine dovodi do preraspodjele električnih naboja unutar molekule, a na atomima se pojavljuju djelomični (višak) naboja; na atomu vodonika - pozitivan, a na atomu klora - negativan.
U ovom slučaju se kaže da je veza polarizirana, a sama veza naziva se polarna kovalentna veza.
Ako se elektronski par kovalentne veze ne pomakne ni na jedan od vezanih atoma, to jest, elektroni veze jednako pripadaju vezanim atomima, tada se takva veza naziva nepolarnom kovalentnom vezom.
Koncept "formalnog naboja" u slučaju kovalentne veze takođe je primenljiv. Samo u definiciji ne bismo trebali govoriti o ionima, već o atomima. Općenito, može se dati sljedeća definicija.
U molekulama, u kojima su kovalentne veze nastale samo mehanizmom razmjene, formalni naboji atoma jednaki su nuli. Dakle, u molekuli HCl, formalni naboji na atomima klora i vodonika jednaki su nuli. Zbog toga su u ovom molekulu stvarni (efektivni) naboji na atomima klora i vodonika jednaki parcijalnim (suvišnim) nabojima.
Nije uvijek lako odrediti znak djelomičnog naboja na atomu jednog ili drugog elementa u molekuli iz energije molarne jonizacije i afiniteta prema elektrodi, odnosno procijeniti u kojem su smjeru pomaknuti parovi elektronske veze. Obično se u ove svrhe koristi još jedna energetska karakteristika atoma - elektronegativnost.
Trenutno ne postoji jedinstvena, općeprihvaćena oznaka za elektronegativnost. Možete ga označiti slovima E / O. Takođe, još uvijek ne postoji jedinstvena, općeprihvaćena metoda za izračunavanje elektronegativnosti. Pojednostavljeno, može se predstaviti kao poluzbir molarnih energija jonizacije i afiniteta elektrona - ovo je bila jedna od prvih metoda njegovog izračunavanja.
Apsolutne vrijednosti elektronegativnosti atoma različitih elemenata koriste se vrlo rijetko. Češće se koristi relativna elektronegativnost, označena slovom c. U početku je ova vrijednost definirana kao odnos elektronegativnosti atoma datog elementa i elektronegativnosti atoma litijuma. Naknadno su se metode za njegovo izračunavanje donekle promijenile.
Relativna elektronegativnost je bezdimenzionalna veličina. Njegove vrijednosti su date u Dodatku 10.
Budući da relativna elektronegativnost prvenstveno ovisi o energiji jonizacije atoma (energija afiniteta prema elektronu uvijek je mnogo manja), tada se u sustavu hemijskih elemenata mijenja otprilike na isti način kao i energija jonizacije, odnosno dijagonalno se povećava od cezija (0,86) do fluora (4.10). Vrijednosti relativne elektronegativnosti helija i neona dane u tablici nisu od praktične važnosti, jer ti elementi ne tvore spojeve.
Koristeći tablicu elektronegativnosti, lako se može odrediti u kojem smjeru se pomiču elektroni koji povezuju ove atome, i, prema tome, znakovi djelomičnih naboja koji nastaju na tim atomima.
| H 2 O | Veza je polarna | |||
| H 2 | Atomi su isti | H - H | Nepolarna komunikacija | |
| CO 2 | Veza je polarna | |||
| Cl 2 | Atomi su isti | Cl - Cl | Nepolarna komunikacija | |
| H 2 S | Veza je polarna |
Dakle, u slučaju stvaranja kovalentne veze između atoma različitih elemenata, takva će veza uvijek biti polarna, a u slučaju stvaranja kovalentne veze između atoma jednog elementa (u jednostavnim supstancama), veza je u većini slučajeva nepolarna.
Što je veća razlika u elektronegativnosti vezanih atoma, to je kovalentnija veza između ovih atoma polarnija.
| Vodikov sulfid H 2 S - bezbojni plin sa karakterističnim mirisom po trulim jajima; otrovno. Termički je nestabilan i raspada se zagrijavanjem. Vodikov sulfid je slabo rastvorljiv u vodi, a njegova vodena otopina naziva se sumporovodična kiselina. Vodikov sulfid izaziva (katalizira) koroziju metala, upravo je taj plin "kriv" za potamnjenje srebra. U prirodi se nalazi u nekim mineralnim vodama. U procesu života neke bakterije ga formiraju. Vodikov sulfid je štetan za sva živa bića. Sloj vodonik-sulfida pronađen je u dubinama Crnog mora i izaziva strah kod naučnika: život morskog života tamo je pod stalnom prijetnjom. |
POLARNA KOVALENTNA OBVEZNICA, NONPOLARNA KOVALENTNA OBVEZNICA, APSOLUTNA ELEKTRIČNA NEGATIVNOST, RELATIVNA ELEKTRIČNA NEGATIVNOST.
1. Eksperimenti i naknadni proračuni pokazali su da je efektivni naboj silicija u silicijum tetrafluoridu +1,64 e, a ksenona u ksenonskom heksafluoridu +2,3 e. Odrediti vrijednosti djelomičnih naboja na atomima fluora u tim spojevima. 2. Napravite strukturne formule sljedećih supstanci i, koristeći oznake "" i "", okarakterizirajte polaritet kovalentnih veza u molekulama ovih spojeva: a) CH 4, CCl 4, SiCl 4; b) H20, H2S, H2Se, H2Te; c) NH 3, NF 3, NCl 3; d) SO2, Cl20, OF2.
3. Koristeći tablicu elektronegativnosti, naznačite u kojem je od jedinjenja veza polarnija: a) CCl 4 ili SiCl 4; b) H2S ili H20; c) NF 3 ili NCl 3; d) Cl20 ili OF2.
7.13. Donatorsko-akceptorski mehanizam stvaranja veza
U prethodnim paragrafima detaljno ste se upoznali sa dvije vrste veza: jonskom i kovalentnom. Podsjetimo da se jonska veza stvara kada se elektron u potpunosti prenese s jednog atoma na drugi. Kovalentni - kada se dijele nespareni elektroni vezanih atoma.
Pored toga, postoji još jedan mehanizam za stvaranje veze. Razmotrimo to na primjeru interakcije molekule amonijaka s molekulom bor trifluorida:


Kao rezultat, između atoma dušika i bora nastaju i kovalentna i jonska veza. U ovom slučaju, atom dušika je donatorelektronski par ("daje" ga za stvaranje veze), a atom bora - akceptor("prihvata" ga prilikom formiranja veze). Otuda i naziv mehanizma za stvaranje takve veze - " donor-akceptor ".
Kada vezu formira mehanizam donor-akceptor, formiraju se i kovalentna i jonska veza.
Naravno, nakon stvaranja veze zbog razlike u elektronegativnosti vezanih atoma dolazi do polarizacije veze i pojavljuju se djelomični naboji koji smanjuju efektivne (stvarne) naboje atoma.

Pogledajmo druge primjere.
Ako se pored molekule amonijaka nalazi jako polarna molekula hidrogen-hlorida, u kojoj na atomu vodonika postoji značajan djelomični naboj, tada će atom vodika igrati ulogu akceptora elektronskog para. Njegova 1 s-AO, iako ne sasvim prazan, kao u atomu bora u prethodnom primjeru, ali gustina elektrona u oblaku ove orbitale je značajno smanjena.

Prostorna struktura rezultirajućeg kationa, amonijum jon NH 4 je sličan strukturi molekula metana, odnosno sve su četiri N-H veze potpuno iste.
Stvaranje jonskih kristala amonijum-klorida NH 4 Cl može se primijetiti miješanjem plinovitog amonijaka i plinovitog hidrogen-klorida:
NH 3 (g) + HCl (g) \u003d NH 4 Cl (cr)
Donor elektronskog para može biti ne samo atom azota. To može biti, na primjer, atom kisika u molekuli vode. Molekula vode će stupiti u interakciju s istim hlorovodonikom na sljedeći način:
Dobiveni kation H3O se naziva oksonijum joni, kao što ćete uskoro saznati, od velike je važnosti u hemiji.
U zaključku razmotrimo elektroničku strukturu molekula ugljen monoksida (ugljen monoksida) CO:

U njemu se, pored tri kovalentne veze (trostruke), nalazi i jonska veza.
Uslovi za stvaranje veza mehanizmom donatora-akceptora:
1) prisustvo usamljenog para valentnih elektrona u jednom od atoma;
2) prisustvo slobodne orbitale na valentnom podnivu drugog atoma.
Donatorsko-akceptorski mehanizam stvaranja veza je široko rasprostranjen. Naročito je čest kod stvaranja spojeva d-elementi. Atomi gotovo svih d-elementi imaju mnogo slobodnih valentnih orbitala. Stoga su aktivni akceptori elektronskih parova.
MEHANIZAM OBLIKOVANJA OBVEZA DONATORA-PRIHVAĆAČA, IONA AMONIJA, IONA OKSONIJA, USLOVI OBLIKOVANJA OBVEZA OD MEHANIZMA DONATORA-PRIHVAĆAČA
1. Napravite jednadžbe reakcija i obrazovne šeme
a) amonijev bromid NH 4 Br iz amonijaka i vodonik-bromida;
b) amonijum sulfat (NH 4) 2 SO 4 iz amonijaka i sumporne kiseline.
2. Sastaviti jednadžbe reakcija i šeme interakcije a) vode sa vodonik-bromidom; b) voda sa sumpornom kiselinom.
3. Koji su atomi u četiri prethodne reakcije donatori elektronskog para, a koji akceptori? Zašto? Objasnite odgovor dijagramima valentnih podnivoa.
4. Strukturna formula azotne kiseline Uglovi između O - N - O veza su blizu 120 o. Definišite:
a) tip hibridizacije atoma azota;
b) koji AO atoma dušika učestvuje u stvaranju -veze;
c) koji AO atoma dušika učestvuje u stvaranju β-veze mehanizmom donor-akceptor.
Šta mislite, koji je približno ugao između H - O - N veza u ovom molekulu? 5. Napravite strukturnu formulu cijanidnog iona CN (negativni naboj - na atomu ugljenika). Poznato je da su cijanidi (spojevi koji sadrže takav jon) i ugljen monoksid CO snažni otrovi i njihov je biološki učinak vrlo blizu. Ponudite svoje objašnjenje bliskosti njihovog biološkog djelovanja.
7.14. Metalna veza. Metali
Kovalentna veza nastaje između atoma koji su bliski sklonosti da daju i vežu elektrone, samo kada su veličine povezanih atoma male. U ovom slučaju, gustina elektrona u području preklapanja oblaka elektrona je značajna, a atomi su čvrsto povezani, kao, na primjer, u molekuli HF. Ako barem jedan od vezanih atoma ima veliki radijus, stvaranje kovalentne veze postaje manje povoljno, jer je gustina elektrona u preklapajućem oblaku elektronskih oblaka mnogo manja za velike atome nego za male. Primjer takve molekule s manje jakom vezom je molekul HI (pomoću tablice 21, usporedite energije atomizacije molekula HF i HI).
Pa ipak, između velikih atoma ( r o\u003e 1.1) nastaje hemijska veza, ali u ovom slučaju nastaje uslijed socijalizacije svih (ili dijela) valentnih elektrona svih vezanih atoma. Na primjer, u slučaju atoma natrija, sva 3 s-elektroni ovih atoma, dok se formira jedan elektronski oblak:

Atomi tvore kristal sa metal komunikacija.
Dakle, i atomi jednog elementa i atomi različitih elemenata mogu međusobno komunicirati. U prvom slučaju nastaju jednostavne tvari, tzv metali, a u drugom - složene tvari tzv intermetalna jedinjenja.
Od svih supstanci s metalnom vezom između atoma u školi objavit ćete samo metale. Kakva je prostorna struktura metala? Metalni kristal se sastoji od atomska jezgralijevo nakon socijalizacije valentnih elektrona i elektronski oblak socijaliziranih elektrona. Atomske jezgre obično čine najbliže pakovanje, a elektronski oblak zauzima čitav preostali slobodni volumen kristala.
Glavne vrste najgušćih paketa su kubično najbliže pakovanje (KPU) i heksagonalno čvrsto pakiranje(GPU). Imena ovih paketa povezana su sa simetrijom kristala u kojima su ostvareni. Neki metali formiraju kristale u labavom pakovanju - kubično usredotočeno na tijelo(BCC). Volumetrijski i loptasti modeli ovih paketa prikazani su na slici 7.6.
Kubično najbliže pakiranje čine atomi Cu, Al, Pb, Au i neki drugi elementi. Heksagonalno najbliže pakovanje - atomi Be, Zn, Cd, Sc i niz drugih. Kubično pakiranje atoma usredotočeno na tijelo prisutno je u kristalima alkalnih metala, elementima VB i VIB grupa. Neki metali mogu imati različitu strukturu na različitim temperaturama. Razlozi za takve razlike i strukturne karakteristike metala još uvijek nisu u potpunosti razumljivi.
Kada se rastope, metalni kristali se pretvaraju u metalne tečnosti... U ovom slučaju, vrsta hemijske veze između atoma se ne mijenja.
Metalna veza nema usmjerenost i zasićenost. U tom pogledu slična je jonskoj vezi.
U slučaju intermetalnih jedinjenja, možemo govoriti o polariziranosti metalne veze.
Tipična fizička svojstva metala:
1) visoka električna provodljivost;
2) visoka toplotna provodljivost;
3) visoka plastičnost.

Tačke topljenja različitih metala međusobno se vrlo razlikuju: najniža tačka topljenja je kod žive (-39 o C), a najviša kod volframa (3410 o C).
| Beryllium Be - svijetlosiva svjetlost, prilično tvrd, ali obično lomljiv metal. Tačka topljenja 1287 o C. Na zraku je prekrivena oksidnim filmom. Berilij je prilično rijedak metal, živi organizmi u procesu njegove evolucije praktički nisu stupili u kontakt s njim, stoga ne čudi da je otrovan za životinjski svijet. Koristi se u nuklearnoj tehnologiji. Cink Zn je mekani metal, bijele boje s plavkastim nijansom. Tačka topljenja 420 o C. Na zraku i u vodi prekriven je tankim gustim filmom cinkovog oksida koji sprečava dalju oksidaciju. U proizvodnji se koristi za pocinčavanje limova, cijevi, žice, zaštitu željeza od korozije. Volfram W. Vatrostalniji je od svih metala: talište volframa je 3387 o C. Obično je volfram prilično lomljiv, ali nakon pažljivog čišćenja postaje duktan, što vam omogućuje da iz njega izvučete tanku žicu od koje se izrađuju niti električnih žarulja. Međutim, većina proizvedenog volframa odlazi na proizvodnju tvrdih i otpornih na habanje legura koje mogu zadržati ta svojstva zagrijavanjem čak i do 1000 o C. |
METAL, INTERMETALNI ZGLOB, METALNA VEZA, TAKO PAKIRANJE.
1. Za karakterizaciju različitih ambalaža koristi se koncept "faktora popunjavanja prostora", odnosno odnos zapremine atoma i zapremine kristala
gde V a -zapremina atoma
Z je broj atoma u jediničnoj ćeliji,
V i- zapremina jedinične ćelije.
Atomi su u ovom slučaju predstavljeni krutim kuglicama polumjera Rdodirujući jedno drugo. Zapremina lopte V w \u003d (4/3) R 3 .
Odredite faktor popunjenosti prostora za KPU i BCC ambalažu.
2. Koristeći vrijednosti metalnih radijusa (Dodatak 9), izračunajte veličinu jedinične ćelije a) bakra (KPU), b) aluminijuma (KPU) i c) cezija (BCC).