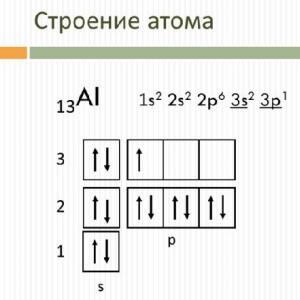
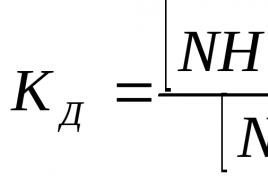Kako se ravnoteža i smjer reakcije mogu promijeniti? Pomak kemijske ravnoteže
Kemijska ravnoteža koja odgovara jednakosti brzina reakcija naprijed i natrag (\u003d) i minimalnoj vrijednosti Gibbsove energije (∆ G p, m \u003d 0) je najstabilnije stanje sistema u datim uvjetima i ostaje nepromijenjena sve dok parametri ostaju konstantni pri kojima uspostavljena je ravnoteža.
Kada se uslovi promijene, ravnoteža se narušava i pomiče u smjeru direktne ili reverzne reakcije. Pomeranje ravnoteže nastalo je zbog činjenice da spoljni uticaj u različitom stepenu menja brzinu dva međusobno suprotna procesa. Nakon nekog vremena sistem ponovo postaje u ravnoteži, tj. prelazi iz jednog ravnotežnog stanja u drugo. Nova ravnoteža karakterizira nova jednakost brzina reakcija naprijed i natrag i nove ravnotežne koncentracije svih supstanci u sustavu.
Smjer pomaka ravnoteže općenito je određen Le Chatelierovim principom: ako se na sustav vrši vanjski utjecaj u stanju stabilne ravnoteže, tada se pomicanje ravnoteže događa u smjeru procesa koji slabi učinak vanjskog utjecaja.
Promjena ravnoteže može biti uzrokovana promjenom temperature, koncentracije (tlaka) jednog od reagensa.
Temperatura je parametar o kojem ovisi vrijednost konstante ravnoteže hemijske reakcije. Pitanje pomaka ravnoteže s promjenom temperature, ovisno o uvjetima korištenja reakcije, rješava se upotrebom izobarske jednadžbe (1,90) - \u003d
1. Za izotermički postupak ∆ r H 0 (t)< 0, в правой части выражения (1.90) R > 0, T\u003e 0, stoga je prvi izvod logaritma konstante ravnoteže s obzirom na temperaturu negativan< 0, т.е. ln Kp (и сама константа Кр) являются убывающими функциями температуры. При увеличении температуры константа химического равновесия (Кр) уменьшается и что согласно закону действующих масс (2.27), (2.28)соответствует смещению химического равновесия в сторону обратной (эндотермической) реакции. Именно в этом проявляется противодействие системы оказанному воздействию.
2. Za endotermni proces ∆ r N 0 (t)\u003e 0, derivat logaritma konstante ravnoteže s obzirom na temperaturu je pozitivan (\u003e 0), slika predmeta ln Kp i Kr povećavaju funkcije temperature, tj. u skladu sa zakonom masovnog djelovanja, s porastom temperature, ravnoteža se pomiče prema pravoj liniji (endotermna reakcija). Međutim, mora se imati na umu da se brzina izotermnih i endotermnih procesa povećava s porastom temperature, a smanjuje se smanjenjem, ali promjena brzina nije ista s promjenom temperature, pa je, promjenom temperature, moguće pomicanje ravnoteže u zadanom smjeru. Pomak u ravnoteži može biti uzrokovan promjenom koncentracije jedne od komponenata: dodavanjem supstance u ravnotežni sistem ili uklanjanjem iz sistema.
Prema principu Le Chateliera, kada se koncentracija jednog od sudionika reakcije promijeni, ravnoteža se pomiče prema kompenzacijskoj promjeni, tj. s porastom koncentracije jedne od početnih supstanci - udesno, a s porastom koncentracije, jednog od produkata reakcije - ulijevo. Ako plinovite tvari sudjeluju u reverzibilnoj reakciji, tada se pri promjeni tlaka sve njihove koncentracije mijenjaju jednako i istovremeno. Brzine procesa se također mijenjaju i, prema tome, može doći do pomaka u hemijskoj ravnoteži. Tako, na primjer, s porastom pritiska (u odnosu na ravnotežu) na sistemu CaCO 3 (K) CO (k) + CO 2 (g), povećava se brzina obrnute reakcije \u003d što će dovesti do pomaka ravnoteže ulijevo. Kada se pritisak na isti sistem smanji, brzina obrnute reakcije opada, a ravnoteža se pomiče na desnu stranu. Kada se poveća pritisak u sistemu ravnoteže 2HCl H 2 + Cl 2, ravnoteža se neće pomicati, jer obje brzine će se podjednako povećavati.
Za sistem 4HCl + O2 2Cl 2 + 2H 2 O (g), porast pritiska će dovesti do povećanja brzine direktne reakcije i pomeranja ravnoteže udesno.
I tako, u skladu s Le Chatelierovim principom, s porastom pritiska, ravnoteža se pomiče prema stvaranju manjeg broja molova plinovitih supstanci u smjesi plinova i, prema tome, prema smanjenju tlaka u sustavu.
Suprotno tome, vanjskim djelovanjem koje uzrokuje smanjenje pritiska, ravnoteža se pomiče prema stvaranju većeg broja molova plinovitih tvari, što će uzrokovati porast tlaka u sustavu i suzbiti učinjeni učinak.
Princip Le Chateliera je od velike praktične važnosti. Na njegovoj osnovi moguće je odabrati takve uvjete za provođenje kemijske interakcije koji će osigurati maksimalan prinos reakcijskih proizvoda.
Stanje u kojem su brzine naprijed i natrag reakcije jednake jedna drugoj naziva se hemijska ravnoteža. Općenita jednadžba reverzibilne reakcije:
Brzina reakcije naprijed v 1 =k 1 [A] m [B] n, brzina obrnute reakcije v 2 =k 2 [S] p [D] q, gdje su ravnotežne koncentracije u uglastim zagradama. Po definiciji, u hemijskoj ravnoteži v 1 \u003d v 2, odakle
K c \u003d k 1 / k 2 \u003d [C] p [D] q / [A] m [B] n,
gdje je K c konstanta hemijske ravnoteže, izražena u molarnim koncentracijama. Dati matematički izraz često se naziva zakonom masenog djelovanja za reverzibilnu hemijsku reakciju: odnos proizvoda ravnotežnih koncentracija produkata reakcije i proizvoda ravnotežnih koncentracija početnih supstanci.
Položaj kemijske ravnoteže ovisi o sljedećim reakcijskim parametrima: temperaturi, tlaku i koncentraciji. Uticaj koji ovi faktori imaju na hemijsku reakciju poštuje obrazac koji je općenito izrazio 1884. francuski naučnik Le Chatelier. Moderna formulacija principa Le Chateliera je sljedeća:
Ako se izvrši vanjski utjecaj na sistem koji je u stanju ravnoteže, tada će sistem prijeći u drugo stanje kako bi se smanjio učinak vanjskog utjecaja.
Faktori koji utječu na hemijsku ravnotežu.
1. Uticaj temperature. U svakoj reverzibilnoj reakciji jedan od smjerova odgovara egzotermnom procesu, a drugi endotermnom.
Kako temperatura raste, hemijska ravnoteža se pomiče u smjeru endotermne reakcije, a kako temperatura opada, u smjeru egzotermne reakcije.
2. Uticaj pritiska.
U svim reakcijama koje uključuju plinovite tvari, popraćene promjenom volumena uslijed promjene količine tvari tijekom prijelaza iz početnih tvari u proizvode, tlak u sustavu utječe na položaj ravnoteže.
Učinak pritiska na položaj ravnoteže reguliran je sljedećim pravilima:
Kako se pritisak povećava, ravnoteža se pomiče u smjeru stvaranja tvari (početne ili produkte) manjeg volumena.
3. Uticaj koncentracije. Učinak koncentracije na ravnotežu reguliraju sljedeća pravila:
Povećanjem koncentracije jedne od početnih supstanci, ravnoteža se pomiče u smjeru stvaranja produkata reakcije;
s porastom koncentracije jednog od produkata reakcije, ravnoteža se pomiče u smjeru stvaranja početnih tvari.
Pitanja za samokontrolu:
1. Kolika je brzina hemijske reakcije i od kojih faktora ona ovisi? O kojim faktorima ovisi konstanta brzine?
2. Napravite jednadžbu brzine reakcije stvaranja vode iz vodika i kisika i pokažite kako se brzina mijenja ako se koncentracija vodika poveća tri puta.
3. Kako se brzina reakcije mijenja s vremenom? Koje se reakcije nazivaju reverzibilnim? Šta karakteriše stanje hemijske ravnoteže? Što se naziva konstanta ravnoteže, od kojih faktora ona ovisi?
4. Koji spoljni uticaji mogu poremetiti hemijsku ravnotežu? U kojem će se smjeru ravnoteža miješati kada se temperatura promijeni? Pritisak?
5. Kako možete preokrenuti reverzibilnu reakciju u određenom smjeru i dovesti je do kraja?
Predavanje broj 12 (problematično)
Rješenja
Cilj:Dati kvalitativne zaključke o topljivosti supstanci i kvantitativnu procjenu topljivosti.
Ključne riječi:Rješenja - homogena i heterogena, istinita i koloidna; topljivost supstanci; koncentracija otopina; neelektrična rješenja; Raoulovi i vano Hoffovi zakoni.
Plan.
1. Klasifikacija rješenja.
2. Koncentracija otopina.
3. Rastvor neelektrolita. Raoulovi zakoni.
Klasifikacija rješenja
Otopine su homogeni (jednofazni) sistemi promjenjivog sastava, koji se sastoje od dvije ili više supstanci (komponenata).
Po prirodi agregatnog stanja, otopine mogu biti plinovite, tečne i čvrste. Obično se komponenta koja se pod tim uvjetima nalazi u istom agregatnom stanju kao i rezultirajuća otopina smatra otapalom, a ostale komponente otopine su otopljene tvari. U slučaju istog agregatnog stanja komponenata, komponenta koja prevladava u otopini smatra se otapalom.
Ovisno o veličini čestica, otopine se dijele na prave i koloidne. U istinskim rastvorima (često se nazivaju jednostavno rastvorima), otopljena supstanca je raspršena do atomskog ili molekularnog nivoa, čestice otopljene supstance nisu vidljive ni vizuelno ni pod mikroskopom, oni se slobodno kreću u mediju rastvarača. Istinska rješenja su termodinamički stabilni sustavi koji su vremenom beskrajno stabilni.
Pokretačke sile za stvaranje rješenja su faktori entropije i entalpije. Kada se plinovi otope u tečnosti, entropija uvijek smanjuje ΔS< 0, а при растворении кристаллов возрастает (ΔS > 0). Što je jača interakcija otopljene tvari i otapala, to je veća uloga entalpijskog faktora u stvaranju otopina. Znak promjene entalpije otapanja određuje se predznakom zbroja svih toplotnih efekata procesa koji prate rastvaranje, čemu glavni doprinos daje uništavanje kristalna rešetka u slobodne ione (ΔH\u003e 0) i interakciju nastalih iona sa molekulima rastvarača (solvatacija, ΔH< 0). При этом независимо от знака энтальпии при растворении (абсолютно нерастворимых веществ нет) всегда ΔG = ΔH – T·ΔS < 0, т. к. переход вещества в раствор сопровождается значительным возрастанием энтропии вследствие стремления системы к разупорядочиванию. Для жидких растворов (расплавов) процесс растворения идет самопроизвольно (ΔG < 0) до установления динамического равновесия между раствором и твердой фазой.
Koncentracija zasićene otopine određuje se topljivošću supstance na određenoj temperaturi. Otopine s nižom koncentracijom nazivaju se nezasićenima.
Rastvorljivost različitih supstanci znatno varira i ovisi o njihovoj prirodi, interakciji čestica otopljene supstance i molekulama rastvarača, kao i o vanjskim uvjetima (pritisak, temperatura itd.)
U hemijskoj praksi najvažniji su rastvori pripremljeni na bazi tečnog rastvarača. Upravo tečne smjese u hemiji se jednostavno nazivaju rješenjima. Najčešće korišteno anorgansko otapalo je voda. Otopine s drugim rastvaračima nazivaju se nevodene.
Otopine su od izuzetno velike praktične važnosti; u njima se odvijaju mnoge hemijske reakcije, uključujući one u osnovi metabolizma u živim organizmima.
Koncentracija otopina
Važna karakteristika otopina je njihova koncentracija, koja izražava relativnu količinu komponenata u otopini. Razlikujte masene i zapreminske koncentracije, dimenzionalne i bezdimenzionalne.
TO bez dimenzija koncentracije (frakcije) uključuju sljedeće koncentracije:
Masni udio otopljene supstance W(B) izražava se kao udio jedinice ili u procentima:
gdje su m (B) i m (A) masa otopljene tvari B i masa otapala A.
Zapreminski udeo rastvorene supstance σ (B) izražava se u udelima jedinice ili zapreminskih procenata:
gdje je V i zapremina komponente otopine, V (B) je zapremina otopljene supstance B. Procenti zapremine nazivaju se stepeni *).
*) Ponekad se zapreminska koncentracija izražava u hiljaditim dijelovima (ppm, ‰) ili u dijelovima na milion (ppm), ppm.
Molarni udio otopljene tvari χ (B) izražava se omjerom

Zbir molarnih udjela k komponenata otopine χ i jednak je jedinici
TO dimenzionalnikoncentracije uključuju sljedeće koncentracije:
Molalnost otopljene tvari C m (B) određuje se količinom supstance n (B) u 1 kg (1000 g) otapala, dimenzija je mol / kg.

Molarna koncentracija supstance B u otopini C(B) - sadržaj količine otopljene tvari B u jedinici zapremine rastvora, mol / m 3, ili češće mol / l:

gdje je μ (B) molarna masa B, V je zapremina rastvora.
Molarna koncentracija ekvivalenta supstance B C E (B) (normalnost - zastarjelo) određuje se brojem ekvivalenata rastvorene supstance u jedinici zapremine rastvora, mol / l:

gdje je n E (B) količina ekvivalenata supstance, μ E je molarna masa ekvivalenta.
Titar otopine supstance B ( T B) određuje se masom rastvorene supstance u g koja se nalazi u 1 ml rastvora:
G / ml ili  g / ml.
g / ml.
Masene koncentracije (maseni udio, procenat, molar) ne ovise o temperaturi; volumetrijske koncentracije odnose se na određenu temperaturu.
Sve supstance u jednom ili drugom stepenu su sposobne da se otope i odlikuju se topljivošću. Neke supstance su beskrajno topljive jedna u drugoj (voda-aceton, benzen-toluen, tečni natrijum-kalijum). Većina spojeva je slabo topljiva (voda-benzen, voda-butil alkohol, kuhinjska sol), a mnogi su slabo rastvorljivi ili praktično netopivi (voda-BaSO 4, voda-benzin).
Topljivost supstance u tim uvjetima naziva se njenom koncentracijom u zasićenoj otopini. U takvom rastvoru postiže se ravnoteža između otopljene supstance i rastvora. U nedostatku ravnoteže, otopina ostaje stabilna ako je koncentracija otopljenog sredstva manja od njegove rastvorljivosti (nezasićena otopina) ili nestabilna ako otopina sadrži supstancu veću od svoje topljivosti (prezasićena otopina).
Ako se vanjski uvjeti kemijskog procesa ne promijene, tada se stanje kemijske ravnoteže može održavati proizvoljno dugo. Promjenom reakcijskih uvjeta (temperatura, tlak, koncentracija) može se postići pomicanje ili pomicanje hemijske ravnoteže u potrebnom smjeru.
Pomak ravnoteže udesno dovodi do povećanja koncentracije supstanci čije su formule na desnoj strani jednadžbe. Pomeranje ravnoteže ulijevo dovest će do povećanja koncentracije supstanci čije su formule slijeva. U ovom slučaju, sistem će preći u novo stanje ravnoteže koje karakterišu ostale vrijednosti ravnotežnih koncentracija sudionika reakcije.
Promena u hemijskoj ravnoteži izazvana promenom uslova pokorava se pravilu koje je 1884. godine formulisao francuski fizičar A. Le Chatelier (Le Chatelier-ov princip).
Le Chatelierov princip: ako se na sustav izvrši učinak u stanju kemijske ravnoteže, na primjer, na promjenu temperature, tlaka ili koncentracije reagensa, tada će se ravnoteža pomaknuti u smjeru reakcije koja slabi učinak .
Učinak promjena koncentracije na pomak hemijske ravnoteže.
Prema principu Le Chateliera povećanje koncentracije bilo kojeg od učesnika u reakciji uzrokuje pomak ravnoteže prema reakciji što dovodi do smanjenja koncentracije ove supstance.
Učinak koncentracije na ravnotežu reguliraju sljedeća pravila:
Povećanjem koncentracije jedne od početnih supstanci povećava se brzina izravne reakcije i ravnoteža se pomiče u smjeru stvaranja produkata reakcije i obrnuto;
Povećanjem koncentracije jednog od produkata reakcije povećava se brzina obrnute reakcije, što dovodi do pomaka ravnoteže u smjeru stvaranja početnih tvari i obrnuto.
Na primjer, ako je u sistemu ravnoteže:
SO 2 (g) + NO 2 (g) SO 3 (g) + NO (g)
povećati koncentraciju SO2 ili NO2, tada će se, u skladu sa zakonom masovnog djelovanja, povećati brzina direktne reakcije. To će dovesti do pomaka ravnoteže udesno, što će dovesti do potrošnje polaznih materijala i povećanja koncentracije produkata reakcije. Uspostavit će se novo stanje ravnoteže s novim ravnotežnim koncentracijama početnih supstanci i produkata reakcije. Kada se koncentracija, na primjer, jednog od produkata reakcije smanji, sistem će reagirati na takav način da poveća koncentraciju proizvoda. Izravna reakcija će biti korisna, što će dovesti do povećanja koncentracije produkata reakcije.
Učinak promjene pritiska na pomak kemijske ravnoteže.
Prema principu Le Chateliera porast pritiska dovodi do pomaka ravnoteže prema stvaranju manje količine plinovitih čestica, tj. prema manjoj zapremini.
Na primjer, u reverzibilnoj reakciji:
2NO 2 (g) 2NO (g) + O 2 (g)
od 2 mola NO 2 nastaju 2 mola NO i 1 mol O2. Stehiometrijski koeficijenti ispred formula plinovitih tvari ukazuju na to da tok izravne reakcije dovodi do povećanja broja molova plinova, a tok reverzne reakcije, naprotiv, smanjuje broj molova plinovite supstance. Ako se na takav sistem izvrši vanjski utjecaj, na primjer, povećanjem pritiska, tada će sustav reagirati na takav način da taj utjecaj oslabi. Pritisak se može smanjiti ako se ravnoteža ove reakcije pomakne prema manjem broju molova plinovite supstance, a time i manjem volumenu.
Suprotno tome, porast pritiska u ovom sistemu povezan je sa pomicanjem ravnoteže udesno - prema razgradnji NO 2, što povećava količinu plinovite materije.
Ako broj molova plinovitih tvari prije i nakon reakcije ostane konstantan, tj. volumen sistema se ne mijenja tokom reakcije, tada promjena tlaka podjednako mijenja brzine reakcija unaprijed i unatrag i ne utječe na stanje kemijske ravnoteže.
Na primjer, u reakciji:
H2 (g) + Cl2 (g) 2HCl (g),
ukupan broj molova plinovitih tvari prije i nakon reakcije ostaje konstantan, a tlak u sustavu se ne mijenja. Ravnoteža u ovom sistemu se ne mijenja kada se pritisak mijenja.
Učinak promjene temperature na pomak u hemijskoj ravnoteži.
U svakoj reverzibilnoj reakciji jedan od smjerova odgovara egzotermnom procesu, a drugi endotermnom. Dakle, u reakciji sinteze amonijaka direktna reakcija je egzotermna, a reverzna endotermna.
N 2 (g) + 3H 2 (g) 2NH 3 (g) + Q (-ΔH).
Kada se temperatura promijeni, mijenjaju se brzine i direktne i reverzne reakcije, međutim, promjena brzine se ne događa u istoj mjeri. U skladu s Arrhenius-ovom jednadžbom, endotermna reakcija koju karakterizira velika vrijednost energije aktivacije u većoj mjeri reagira na promjenu temperature.
Slijedom toga, da bi se procijenio utjecaj temperature na smjer pomaka kemijske ravnoteže, potrebno je znati toplinski učinak procesa. Može se odrediti eksperimentalno, na primjer, pomoću kalorimetra, ili izračunati na osnovu Hess-ovog zakona. Treba napomenuti da promjena temperature dovodi do promjene vrijednosti konstante hemijske ravnoteže (K p).
Prema principu Le Chateliera povećanje temperature pomiče ravnotežu ka endotermnoj reakciji. Kako se temperatura smanjuje, ravnoteža se pomiče u smjeru egzotermne reakcije.
Na ovaj način, porast temperature u reakciji sinteze amonijaka dovesti će do promjene ravnoteže prema endotermnim reakcije, tj. nalijevo. Obrnuta reakcija nastavlja se apsorpcijom toplote.
Stanje hemijske ravnoteže ovisi o nizu čimbenika: temperaturi, tlaku, koncentraciji reaktanata. Razmotrimo detaljnije uticaj ovih faktora.
Promjena koncentracije komponenata ravnotežnog sistema pri konstantnoj temperaturi pomiče ravnotežu, međutim, vrijednost konstante ravnoteže se u ovom slučaju ne mijenja. Ako se koncentracija supstance A (ili B) poveća za reakciju, tada će se povećati brzina neposredne reakcije, a brzina obrnute reakcije u početnom trenutku se neće promijeniti. Ravnoteža će biti poremećena. Tada će koncentracija početnih tvari početi opadati, a koncentracija produkata reakcije - rasti, i to će se nastaviti sve dok se ne uspostavi nova ravnoteža. U takvim se slučajevima kaže da se ravnoteža pomiče prema stvaranju proizvoda reakcije ili se pomiče udesno.
Obrazlažući na isti način, sami odredite gdje će se pomaknuti ravnoteža ako povećate koncentraciju supstance C; smanjiti koncentraciju supstance D.
Promjenom koncentracije komponenata moguće je pomaknuti ravnotežu u željenom smjeru, povećavajući ili smanjujući prinos reakcijskih proizvoda; tražeći potpuniju upotrebu polaznih materijala ili, naprotiv
Da bismo dovršili drugi zadatak, podsjetimo da će se izravna reakcija nastaviti sve dok jedna od komponenata A ili B. ne završi. Iz jednadžbe reakcije može se vidjeti da reagensi reagiraju u ekvimolarnim * količinama, osim toga, njihove koncentracije jednake su prema stanju problema. Stoga će supstance A i B, ulazeći u reakciju, istjecati istovremeno. Iz jednadžbe reakcije također se vidi da se transformacijom jednog mola supstance A formiraju dva mola supstance C i jedan mol supstance D. Stoga će se još neki od njih dodati količini supstanci C i D koja se već nalazi u sistemu. Nakon jednostavne kalkulacije dobivamo željeni rezultat:
[A] \u003d [B] \u003d 0 mol / L; [C] \u003d 2 +2 \u003d 4 mol / L; [D] \u003d 2 +1 \u003d 3 mol / L.
Izvršite slično obrazloženje za treći zadatak, imajući u vidu da supstance C i D reagiraju u omjeru 2: 1, a proračun se mora izvršiti prema količini supstance kojoj nedostaje (odredite tu supstancu). Napravite proračune i dobijte rezultat:
[A] \u003d [B] \u003d 1 + 2/2 \u003d 2 mol / l; [C] \u003d 0 mol / l; [D] \u003d 2-2 / 2 \u003d 1 mol / L.
Konstanta ravnoteže reakcije A + B C + D jednaka je jedinici. Početna koncentracija [A] o \u003d 0,02 mol / l. Koliko procenata supstance A će se pretvoriti ako je početna koncentracija [B] o jednaka 0,02; 0,1; 0,2?
Označimo ravnotežnu koncentraciju supstance A s x i napišimo izraz za konstantu ravnoteže. Ravnotežna koncentracija supstance B također će biti jednaka x. Koncentracije produkata reakcije (C i D) međusobno će biti jednake i jednake 0,02-x. (Pokažite ovo koristeći jednadžbu reakcije.)
Napišimo izraz za konstantu ravnoteže.
Krawn. \u003d (0,02 - x) (0,02 - x) / x2 \u003d 1
Rješavajući jednadžbu za x, dobivamo rezultat: x \u003d 0,01. Slijedom toga, u prvom slučaju pretvorena je polovina supstance A (ili 50%).
U drugom slučaju, konstanta ravnoteže bit će jednaka
Krawn. \u003d (0,02 - x) (0,02 - x) / (0,1- (0,02 - x)) \u003d 1
Nabavite ovaj izraz sami i, nakon što ste riješili jednadžbu, provjerite dobiveni rezultat (x \u003d 0,003). Stoga je u reakciju ušlo (0,02 - 0,003) mola supstance A, što je 83,5%.
Riješite problem za treći slučaj sami, a također riješite isti problem, označavajući za x količinu tvari koja je reagirala.
Iz dobivenih rezultata može se izvući važan zaključak. Da bi se povećao udio supstance koja reagira konstantnom konstantom ravnoteže, potrebno je povećati količinu drugog reagensa u sistemu. Sličan problem nastaje, na primjer, u odlaganju kemijskog otpada.
Kako temperatura raste, povećavat će se brzina i naprijed i natrag, ali ako je naprijed reakcija endotermna (ΔH\u003e 0), tada će se brzina naprijed povećati snažnije od brzine obrnute, a ravnoteža se pomiče prema stvaranju proizvoda ili udesno. S negativnim termičkim učinkom direktne reakcije (egzotermna reakcija), brzina reverzne reakcije će se snažnije povećati, a ravnoteža će se pomaknuti ulijevo.
Razmotrite sami sve moguće slučajeve pomaka ravnoteže sa smanjenjem temperature.
Slika 5 pokazuje da je razlika E "a - E" a jednaka? H reakcije, što znači da vrijednost konstante ravnoteže ovisi o veličini toplotnog efekta reakcije, tj. da li je reakcija endo- ili egzotermna.
Konstanta ravnoteže neke reakcije na 293 ° K je 5 10-3, a na 1000 ° K 2 10-6. Koji je znak toplotnog efekta ove reakcije?
Iz stava problema proizlazi da se konstanta ravnoteže smanjuje s porastom temperature. Koristimo izraz (22) i vidimo kakav bi znak DH reakcije trebao biti da bi se konstanta smanjila.
Ekv. predstavljen je eksponencijalnom funkcijom, čija se vrijednost smanjuje s opadajućim argumentom, u našem slučaju - vrijednošću izraza DH / RT. Da bi se vrijednost argumenta smanjila, vrijednost HH mora biti negativna. Stoga je reakcija u pitanju egzotermna.
Promjene pritiska primjetno utječu na stanje sistema koji uključuju plinovite komponente. U ovom slučaju, u skladu sa zakonima o plinovima, dolazi do promjene zapremine sustava, što dovodi do promjene koncentracije plinovitih tvari (ili njihovih parcijalnih pritisaka). Dakle, s porastom pritiska, volumen će se smanjivati, a koncentracija plinovitih tvari će se povećavati. Povećanje koncentracije dovodi, kao što već znamo, do pomaka ravnoteže prema potrošnji reagensa, što je povećalo njegovu koncentraciju. U ovom slučaju, može se formulisati nešto drugačije. Sa povećanjem pritiska, ravnoteža se pomiče prema manjoj količini plinovitih tvari ili, jednostavnije, prema smanjenju broja molekula plinovitih tvari. Koncentracija čvrstih i tečnih supstanci se ne menja od pritiska.
Razmislite klasični primjer sinteza amonijaka iz azota i vodonika
3H2 + N2 - 2NH3, (DH< 0).
Budući da se sustav sastoji samo od plinovitih supstanci, a kada se formira amonijak, broj molekula se smanjuje, tada će se s porastom pritiska ravnoteža pomaknuti udesno, prema većem prinosu amonijaka. Stoga se industrijska sinteza amonijaka provodi pod povišenim pritiskom.
Predložite temperaturne uvjete za sintezu amonijaka sami, znajući toplotni učinak reakcije i podložan maksimalnom prinosu proizvoda. Kako su ovi uvjeti povezani s kinetičkim faktorima procesa?
Kako će porast pritiska utjecati na ravnotežu sljedećih reakcija?
inhibitor hemijske kinetike katalizatora
CaCO3 (c.) - CaO (c.) + CO2 (g.);
4Fe (c.) + 3O2 (g.) - 2Fe2O3 (c.).
U prvoj reakciji plinovit je samo ugljični dioksid CO2, pa će se s porastom tlaka ravnoteža pomaknuti ulijevo, prema smanjenju količine plinovite supstance.
Drugi slučaj razmotrite sami.
Kako treba mijenjati tlak u tim reakcijama da bi se postigao veći prinos proizvoda?
Svi slučajevi promjene stanja ravnotežnog sistema pod vanjskim utjecajima mogu se generalizirati formuliranjem Le Chatelierovog principa:
Ako se na sistem vrši vanjski utjecaj u stanju ravnoteže, tada se ravnoteža pomiče u smjeru koji slabi efekat vanjskog utjecaja.
Provjerite vrijedi li princip Le Chateliera u svim gore razmatranim slučajevima.
Navedite sami primjere pomjeranja ravnoteže kada se vanjski uvjeti promijene i objasnite ih na temelju Le Chatelierovog principa.
Dakle, razmotrili smo glavna pitanja vezana za obrasce protoka hemijske reakcije... Poznavanje ovih obrazaca omogućit će znatan utjecaj na uvjete za izvođenje određenih procesa kako bi se dobio optimalan rezultat.
Pitanja za samokontrolu
- 1. Koje se reakcije nazivaju reverzibilnim?
- 2. Kako i zašto se stope reakcija naprijed i natrag mijenjaju s vremenom?
- 3. Šta se naziva hemijska ravnoteža?
- 4. Koja vrijednost kvantitativno karakteriše hemijsku ravnotežu?
- 5. Šta određuje vrijednost konstante ravnoteže: koncentracija supstanci koje reaguju; priroda reaktanata; ukupni pritisak; temperatura; prisustvo katalizatora?
- 6. Koje su karakteristike istinske hemijske ravnoteže?
- 7. Koja je razlika između lažne hemijske ravnoteže i istinske ravnoteže?
- 8. Dajte formulaciju Le Chatelierovog principa.
- 9. Formulirajte posljedice Le Chatelierovog principa.
9.5. Reverzibilnost hemijskih reakcija. Hemijska ravnoteža
Razmotrimo endotermnu reakciju
H 2 (g) + I 2 (g) \u003d 2HI (g) - Q . (1)
U reaktor miješamo (u ovom slučaju u nekoj zatvorenoj posudi) vodik i jodnu paru zagrijanu, na primjer, na 450 ° C. Radi jednostavnosti izračuna, pretpostavimo da su koncentracije polaznih supstanci bile jednake i jednake jednom molu po litri, tj. od(H2) \u003d 1 mol / L i od(I 2) \u003d 1 mol / L.
Uprkos negativnom toplotnom efektu, vodonik i jod počet će međusobno reagirati, stvarajući jodovodid. Posljedično, u ovoj reakciji faktor entropije "vuče". Zapravo, u smjesi tri plina (H2, I2 i HI) redoslijed je manji nego u mješavini dva plina (H2 i I2). Eksperimentalno se ova reakcija može otkriti mjerenjem koncentracija uključenih supstanci. Neposredno nakon miješanja koncentracije joda i vodonika počet će se smanjivati, a u reaktoru će se pojaviti jodovododid čija će koncentracija postupno rasti.
Može li ova reakcija ići do kraja? To jest, može sve reaguju li molekuli joda i vodonika jedni s drugima da bi stvorili molekule jodododida?
Vjerovatno ne. Zapravo, kako reakcija bude tekla, molekule jodododida će se akumulirati u reaktoru, a molekule joda i vodonika će nestati. Na kraju reakcije plin je trebao biti čisti jodovododid. Ali u sistemu koji se sastoji samo od molekula jednog plina, poredak je mnogo veći (a entropija manja) nego u mješavini plinova. Faktor entropije će se "povući" u suprotnom smjeru. A energetski faktor ovdje neće pomoći - toplotni učinak početne reakcije je negativan.
Zapravo, nakon otprilike 1,5 sata, otkrivamo da su se koncentracije sva tri plina u reaktoru prestale mijenjati i poprimiti sljedeće vrijednosti: od(H2) \u003d 0,22 mol / l; od(I 2) \u003d 0,22 mol / L i od(HI) \u003d 1,56 mol / L (vidi sliku 9.2 i).
Ako sada u isti reaktor na istoj temperaturi stavimo toliko čistog jodovodododa tako da je njegova koncentracija jednaka 2 mol / l, reakcija koja je započela
2HI (g) \u003d H2 (g) + I2 (g) + Q (2)
takođe neće doći do kraja (zašto?). Nakon čekanja da zaustavi promjenu koncentracije, vidjet ćemo da se pokazalo da su koncentracije plina u reaktoru iste kao u prethodnom slučaju (vidi sliku 9.2. b).
Dvije reakcije koje smo razmatrali (1 i 2) mogu se predstaviti kao jedan proces u kojem se reakcije odvijaju u različitim smjerovima. Uobičajeno se jedan od njih naziva smjerom naprijed (s lijeva na desno prema reakcijskoj jednadžbi), a drugi obrnutim smjerom (s desna na lijevo prema reakcijskoj jednadžbi). Pozvane su odgovarajuće reakcije ravnoi obrnutoreakcije, a cijeli proces je reverzibilan proces ili reverzibilna reakcija.
Dakle, reakcija vodonika i joda je reverzibilna.
U jednadžbe reverzibilnih reakcija, umjesto znaka jednakosti, stavlja se znak reverzibilnosti - "B", na primjer:
Stanje u kojem u reverzibilnoj reakciji koncentracije tvari koje sudjeluju u ovoj reakciji ostaju konstantne naziva se stanje hemijska ravnoteža.
U stanju ravnoteže, molekuli ne prestaju doživljavati sudare i interakcija između njih ne prestaje, ali koncentracije supstanci ostaju konstantne. Te se koncentracije nazivaju ravnoteža.
| Koncentracija ravnoteže - koncentracija supstance koja učestvuje u reverzibilnoj hemijskoj reakciji koja je dostigla stanje ravnoteže. |
Ravnotežna koncentracija označena je formulom supstance uzete u uglate zagrade, na primjer:
sa ravnotežom (N 2) \u003d ili od ravnoteža (HI) \u003d.
Kao i svaka druga koncentracija, ravnotežna koncentracija mjeri se u molovima po litri.
Ako bismo u primjerima koje smo razmatrali uzeli druge koncentracije polaznih tvari, tada bismo nakon postizanja ravnoteže dobili druge vrijednosti ravnotežnih koncentracija. Te nove vrijednosti (označiti ih zvjezdicama) bit će povezane sa starim na sljedeći način:
 .
.
U općenitom slučaju, za reverzibilnu reakciju
aA + bB dD + fF
u stanju ravnoteže pri konstantnoj temperaturi, odnos
![]()
Taj se omjer naziva zakon masovne akcije, koji je formuliran na sljedeći način:
pri konstantnoj temperaturi, odnos umnoška ravnotežnih koncentracija produkata reakcije, uzetih u snage jednake njihovim koeficijentima, i umnoška ravnotežnih koncentracija polaznih supstanci, uzetih u snagama jednakim njihovim koeficijentima, stalna je vrijednost.
Konstantna vrijednost ( K C) se zove konstanta ravnoteže ova reakcija. "C" u ovoj količini označava da su koncentracije korištene za izračunavanje konstanti.
Ako je konstanta ravnoteže velika, tada se ravnoteža pomiče prema produktima izravne reakcije, ako je mala, onda prema početnim supstancama. Ako je konstanta ravnoteže vrlo velika, onda kažu da će reakcija " praktično nepovratno ", ako je konstanta ravnoteže vrlo mala, tada će reakcija " praktično ne ide ".
Konstanta ravnoteže - za svaku reverzibilnu reakciju vrijednost je konstantna samo pri konstantnoj temperaturi. Za istu reakciju pri različitim temperaturama, konstanta ravnoteže poprima različite vrijednosti.
Gornji izraz za zakon masovnog djelovanja vrijedi samo za reakcije, čiji su svi sudionici ili plinovi ili otopljene tvari. U drugim slučajevima, jednadžba konstante ravnoteže se malo mijenja.
Na primjer, u reverzibilnoj reakciji koja se odvija na visokoj temperaturi
C (gr) + CO 2 2CO (g)
uključen je čvrsti grafit C (gr). Formalno, koristeći zakon masovnog djelovanja, zapisujemo izraz za konstantu ravnoteže ove reakcije, označavajući je TO ":

Čvrsti grafit koji leži na dnu reaktora reagira samo s površine, a njegova "koncentracija" ne ovisi o masi grafita i konstantna je pri bilo kojem omjeru supstanci u smjesi plina.
Pomnožimo desnu i lijevu stranu jednadžbe ovom konstantom:

Dobivena vrijednost je konstanta ravnoteže ove reakcije:
Slično tome, za ravnotežu druge reverzibilne reakcije, koja se također javlja na visokoj temperaturi,
CaCO 3 (cr) CaO (cr) + CO 2 (g),
dobivamo konstantu ravnoteže
K C \u003d.
U ovom slučaju, to je jednostavno jednako ravnotežnoj koncentraciji ugljen-dioksida.
S metrološkog gledišta, konstanta ravnoteže nije jedna fizička veličina. Ovo je skupina veličina s različitim mjernim jedinicama, ovisno o specifičnom izrazu konstante u smislu ravnotežnih koncentracija. Na primjer, za reverzibilnu reakciju grafita s ugljičnim dioksidom [ K c] \u003d 1 mol / L, ista mjerna jedinica i konstanta ravnoteže za reakciju termičke razgradnje kalcijum-karbonata, a konstanta ravnoteže za sintezu vodonik-jodida je bezdimenzionalna vrijednost. Uglavnom [ K c] \u003d 1 (mol / l) n .
OBRATNA REAKCIJA, RAVNOTEŽA OBRTIVNE REAKCIJE, RAVNOTEŽNE KONCENTRACIJE, ZAKON UČINKOVITIH MASA ZA KEMIJSKU RAVNOTEŽU.
1. Zašto se hemijska ravnoteža naziva "dinamičkom" ravnotežom? Koji su vam još slučajevi dinamičke ravnoteže poznati?
2. Napravite jednadžbe reakcija za sintezu vode i amonijaka iz jednostavnih supstanci. Zapišite izraze za konstante ravnoteže ovih reakcija.
3. Sastavite izraze za konstante ravnoteže sljedećih reverzibilnih kemijskih reakcija:
a) 2NO (d) + O 2 (d) 2NO 2 (d); b) 4HCl (d) + O 2 (d) 2H 2 O (d) + 2Cl 2 (d);
c) PCl 3 (d) + Cl 2 (d) PCl 5 (d); d) 3Fe (cr) + 4H2O (g) Fe3O4 (cr) + 4H2 (g);
e) CH 4 (d) + I 2 (d) CH 3 I (cr) + HI (d).
4. Pod određenim uslovima uspostavljena je ravnoteža u sistemu pri koncentraciji vodonika, joda i jodovododida od 0,25 mol / l; 0,05 mol / l, odnosno 0,90 mol / l. Izračunajte konstantu ravnoteže za ovu reakciju i odredite početne koncentracije vodonika i joda.
5. Konstanta ravnoteže reverzibilne reakcije
H2 (g) + Cl2 (g) 2HCl (g)
na sobnoj temperaturi je oko 1015. Na osnovu ovoga, što se može reći o ovoj reakciji?
9.6. Pomak kemijske ravnoteže. Le Chatelierov princip
Budući da su gotovo sve reakcije reverzibilne u jednom ili drugom stupnju, u industriji i laboratorijskoj praksi pojavljuju se dva problema: kako dobiti proizvod "korisne" reakcije s maksimalnim prinosom i kako smanjiti prinos proizvoda "štetne" reakcije. U oba slučaja postaje nužno pomaknuti ravnotežu prema produktima reakcije ili prema početnim tvarima. Da biste naučili kako se to radi, morate znati o čemu ovisi položaj ravnoteže bilo koje reverzibilne reakcije.
Položaj ravnoteže ovisi o:
1) na vrijednosti konstante ravnoteže (odnosno na prirodi reakcijskih supstanci i temperaturi),
2) o koncentraciji supstanci koje učestvuju u reakciji i
3) od pritiska (za plinske sisteme proporcionalan je koncentraciji supstanci).
Za kvalitativnu procjenu učinka svih ovih vrlo različitih čimbenika na kemijsku ravnotežu koristi se univerzalna priroda. le Chatelier princip (Francuski fizikohemičar i metalurg Henri Louis Le Chatelier formulirao ga je 1884. godine), koji je primjenjiv na bilo koji sistem ravnoteže, ne samo hemijski.
Ako se na sistem u ravnoteži utječe izvana, tada će se ravnoteža u sistemu pomaknuti u smjeru u kojem je taj utjecaj djelomično kompenziran.
Kao primjer utjecaja na ravnotežni položaj koncentracija supstanci koje sudjeluju u reakciji, razmotrimo već poznatu reverzibilnu reakciju dobivanja jodovodododida
H2 (g) + I2 (g) 2HI (g).
Prema zakonu masovnog djelovanja u stanju ravnoteže
 .
.
Neka se uspostavi ravnoteža u reaktoru zapremine 1 litre pri određenoj konstantnoj temperaturi, pri kojoj su koncentracije svih sudionika reakcije jednake i jednake 1 mol / L (\u003d 1 mol / L; \u003d 1 mol / L; \u003d 1 mol / L). Dakle, na ovoj temperaturi K C \u003d 1. Budući da je zapremina reaktora 1 litra, n(H2) \u003d 1 mol, n(I 2) \u003d 1 mol i n(HI) \u003d 1 mol. U vrijeme t 1 u reaktor uvedemo još 1 mol HI, njegova koncentracija će postati jednaka 2 mol / l. Ali da K C ostali konstantni, koncentracije vodika i joda trebale bi se povećati, a to je moguće samo razgradnjom dijela jodododida prema jednadžbi
2HI (g) \u003d H2 (g) + I2 (g).
Neka do trenutka postizanja novog stanja ravnoteže t 2 the x mol HI i, prema tome, dodatnih 0,5 x mol H2 i I2. Nove ravnotežne koncentracije sudionika reakcije: \u003d (1 + 0,5 x) mol / l; \u003d (1 + 0,5 x) mol / l; \u003d (2 - x) mol / L. Zamjenom numeričkih vrijednosti veličina u izraz zakona djelovanja mase, dobivamo jednadžbu
Odakle x \u003d 0,667. Prema tome, \u003d 1,333 mol / l; \u003d 1,333 mol / l; \u003d 1,333 mol / l.
Sve ove promjene koncentracije jasno su prikazane na slici 9.3. i.

Kao rezultat uvođenja dodatnog dijela HI u reaktor, ravnoteža u sistemu je poremećena i pomaknuta prema stvaranju polaznih materijala (H2 i I2). U ovom slučaju je to suprotna reakcija. Posljedično, ravnoteža se pomaknula prema suprotnoj reakciji ("lijevo").
Ako se 1 mol vodika uvede u isti reaktor pod istim uvjetima, tada će se ravnoteža pomaknuti u smjeru u kojem će vodonik reagirati, a njegova koncentracija zbog toga će se smanjiti, a koncentracija HI će se povećati. To se događa u izravnoj reakciji, pa je stoga ravnoteža pomaknuta prema izravnoj reakciji ("udesno"). Lako je izračunati nove ravnotežne koncentracije u ovom slučaju: \u003d 1,865 mol / l; \u003d 0,865 mol / l; \u003d 1.270 mol / l (vidi sliku 9.3 b).
Na ovaj način, uvođenje u sistem jedne od supstanci koje učestvuju u reakciji dovodi do pomaka ravnoteže u pravcu u kojem se ta supstanca troši.
Kao primjer utjecaja temperature na ravnotežni položaj, uzmimo u obzir reverzibilnu reakciju sinteze amonijaka N 2 (g) + 3H 2 (g) 2NH 3 (g).
Ovdje je izravna reakcija egzotermna: N 2 (g) + 3H 2 (g) \u003d 2NH 3 (g) + Q,
i, prema tome, obrnuta reakcija je endotermna: 2NH 3 (g) \u003d N 2 (g) + 3H 2 (g) - Q.
Toplina nastaje u direktnoj reakciji. Ako trebamo pomaknuti ravnotežu udesno, odnosno u smjeru izravne reakcije, tada bi oslobađanje topline trebalo postati "odgovor" sustava na vanjski utjecaj, odnosno uklanjanje topline. A uklanjanjem toplote snižavamo temperaturu u reaktoru.
Suprotno tome, ako zagrijavamo reakcijsku smjesu, odnosno isporučujemo toplinu, "odgovor" sustava bit će apsorpcija topline, koja se može dogoditi samo kada se ravnoteža pomakne "ulijevo".
Na ovaj način, zagrijavanjem, ravnoteža se pomiče prema endotermnoj reakciji, a kada se hladi, obrnuto.
Naravno, u ovom sustavu ravnoteža se također može promijeniti promjenom koncentracije supstanci koje sudjeluju u reakciji. Ali da vidimo kako će se pomaknuti ravnoteža u ovom sistemu ako se poveća pritisak. Prema Le Chatelierovom principu, ravnoteža bi se trebala pomaknuti u smjeru koji kompenzira vanjski utjecaj, odnosno u smjeru reakcije u kojoj ukupni pritisak opada konstantnom zapreminom. To je moguće samo kada se ukupan broj molekula u sistemu smanji. Ukupan broj molekula opada tokom direktne reakcije, pa će se ravnoteža pomaknuti prema stvaranju amonijaka. Suprotno tome, sa smanjenjem pritiska, ravnoteža će se pomaknuti prema stvaranju dušika i vodonika.
PROMJENA KEMIJSKOG BILANSA, NAČELO LE CHATELIER-a.
(1) Redukcija željezovog (III) oksida vodonikom pri zagrijavanju odnosi se na reverzibilne reakcije. Zašto se gvožđe može potpuno reducirati provođenjem reakcije u struji vodonika? 2.Kako će a) porast temperature, b) porast pritiska, c) smanjenje koncentracije ugljen-dioksida utjecati na ravnotežu u sistemu
2CO (g) + O 2 (g) 2CO 2 (g) + Q?
3.Za svaku od sljedećih reverzibilnih reakcija zapišite izraz za konstantu ravnoteže i navedite sve načine za pomicanje ravnoteže udesno:
a) N 2 O 4 (d) B 2 NO 2 (d) - 58,4 kJ; b) CO (d) + H20 (d) CO 2 (d) + H 2 (d) + 41,2 kJ;
c) COCl2 (g) CO (g) + Cl2 (g) - 112,5 kJ; d) 2NO (g) + O 2 (g) 2NO 2 (g) + 113 kJ;
e) SO2 (g) + O2 (g) 2SO3 (g) + 196,6 kJ; f) 2HBr (g) H2 (g) + Br2 (g) - 72,5 kJ;
g) C (t) + H20 (g) CO (g) + H2 (g) - 132 kJ; i) CuO (t) + C (t) CO (g) + Cu (t) - 46 kJ;
j) FeO (t) + CO (g) Fe (t) + CO 2 (g) + 17 kJ.
9.7. Brzina hemijske reakcije. Mehanizam reakcije
Mogućnost odvijanja reakcije određena je faktorima energije i entropije. Ako je reakcija moguća, može se odvijati brzo (ponekad čak i prebrzo - eksplozijom) ili polako (ponekad čak i tako sporo da je ne primijetimo). Ali u svakom slučaju možemo razgovarati o tome brzina hemijske reakcije.Kako brzina tijela karakterizira brzinu kretanja ovog tijela, tako i brzina reakcije karakteriše intenzitet reakcije, pokazujući koliko je čestica reagovalo u jedinici vremena po jedinici zapremine reaktora. Radi praktičnosti, umjesto broja čestica uzima se količina materije, a odnos količine materije i zapremine sistema je koncentracija dane materije.
Brzina hemijske reakcije izračunava se uzimajući u obzir koeficijent ispred formule date supstance u jednadžbi reakcije ( b B).
Ova se definicija odnosi samo na reakcije koje se odvijaju u tečnoj ili gasnoj fazi.
gde v - brzina hemijske reakcije,
od B \u003d od 2 (B) - od 1 (B) - promjena koncentracije supstance B ( c 1 - početna vrijednost, c 2 - konačna vrijednost koncentracije),
t = t 2 - t 1 - vremenski interval ( t 1 - početna vrijednost, t 2 - vrijeme završetka).
[v] \u003d mol / (l. s).
Zadatak
U reakciji H2 + I2 \u003d 2HI koncentracija vodika se promijenila sa 0,1 mol / L na 0,05 mol / L u 2 sekunde. Odredite brzinu reakcije.
Odluka
Odgovor: v \u003d 0,025 mol / (l. S).
Zadatak
U reakciji 2CO + O2 \u003d 2CO2, pod određenim uvjetima, brzina je 0,5 mol / (lCh s). U nekom trenutku od 1 (CO 2) \u003d 2 mol / l. Kolika će biti koncentracija ugljen-dioksida za tri sekunde?
Odluka
Odgovor: od 2 (CO 2) \u003d 5 mol / l.
Ako su reakcijske supstance plinovite, tada se reakcijski proizvodi mogu dobiti tek kada se molekuli početnih supstanci sudare. Što je više takvih sudara, reakcija ide brže. Broj sudara proporcionalan je koncentraciji polaznih materijala. Stoga će se brzina reakcije A + B \u003d D (sve supstance su plinovite) izraziti jednačinom ( zakon masovnog djelovanja za brzinu reakcije):
v \u003d kc A c B
gde k je konstanta brzine reakcije i od I od B - koncentracija supstanci A i B.
Povećanje pritiska u reaktoru dovodi do proporcionalnog povećanja svih koncentracija, pa se s porastom pritiska povećava brzina reakcije.
Ne dovodi svaki sudar molekula do njihove interakcije. Učinkoviti su samo dovoljno jaki sudari. Sila sudara proporcionalna je kinetičkoj energiji molekula koja se povećava s porastom temperature. Posljedično, brzina reakcije također se povećava s porastom temperature.
Za mnoge reakcije promjena brzine u ovisnosti o temperaturi može se procijeniti pomoću približne jednadžbe koju je predložio holandski kemičar Jacob Van't Hoff (1852 - 1911):
gde v 1 - brzina reakcije na temperaturi T 1 , v 2 - brzina reakcije na temperaturi T 2, a g je tzv temperaturni koeficijent reakcija, koja je različita za različite reakcije, ali obično uzima vrijednosti od 2 do 4.
I u plinovima i u tečnostima, samo dvije čestice mogu se sudariti istovremeno (slika 9.4 i). Trostruki udar je krajnje nevjerojatan (slika 9.4 b).

Stoga se većina reakcija, ponekad izraženih vrlo složenim jednadžbama, odvija u nekoliko faza, za svaku od kojih su potrebni samo dvostruki sudari. Ako je eksperimentalno moguće saznati iz kojih se faza formira jedna ili druga reakcija, tada kažu da je za tu reakciju poznata mehanizam.
| Mehanizam reakcije - ukupnost svih faza ove reakcije. |
Na primjer, reakcijski mehanizam 4HBr + O 2 \u003d 2H 2 O + 2Br 2, koji se javlja u plinskoj fazi na temperaturi od oko 500 ° C, uključuje tri stupnja:
HBr + O 2 \u003d HOOBr;
HOOBr + HBr \u003d 2HOBr;
HOBr + HBr \u003d H2O + Br2.
Brzina ovih reakcija je različita, a ukupna brzina ukupne reakcije određuje se brzinom
najsporija od ovih faza (u ovom slučaju prva).
Praktično je važno da je nemoguće odrediti jednačinom ukupne reakcije
mehanizam ove reakcije. Na primjer, reakcija H2 (g) + I2 (g) \u003d 2HI (g) jednostavno,odnosno odvija se u jednoj fazi, ali naizgled potpuno slična reakcija
H 2 (g) + Cl 2 (g) \u003d 2HCl (g)
složen, koji se odvija u nekoliko faza lančanim mehanizmom:
Cl 2 \u003d Cl + Cl (kada se zagreva ili osvetljava)
Cl + H2 \u003d HCl + H
H + Cl 2 \u003d HCl + Cl
itd.
Postoje i drugi mehanizmi reakcije, od kojih ćete neke upoznati kasnije.
Brzine reakcija i njihove mehanizme proučava grana fizičke hemije koja se naziva "hemijska kinetika".
Dakle, brzina kemijske reakcije, u kojoj su uključene samo plinovite tvari (odnosno "plinovita otopina"), ovisi
1) na temperaturi,
2) o koncentraciji supstanci koje učestvuju u reakciji i, kao posljedica toga,
3) od pritiska.
Brzine reakcija koje teku u tečnim otopinama praktički ne zavise od pritiska.
Ako reakcijske supstance međusobno ne stvaraju otopinu (tečnost ili plin), tada se reakcija odvija samo na kontaktnoj površini tih supstanci. Brzina ove reakcije ovisi o površini ove površine. Zaista, iver gori brže od trupaca, a drvena prašina pomiješana sa zrakom ponekad i eksplodira. Dakle, brzina ovih reakcija ovisi
1) od temperature;
2) o koncentraciji reagensa u određenom rastvoru;
3) od pritiska (ako su plinovi uključeni u reakciju) i
4) iz područja kontaktne površine reagensa.
STOPA KEMIJSKE REAKCIJE; ZAKON O VALJANIM MASAMA ZA KEMIJSKU REAKCIJU; VANT-HOFFOVA JEDNAČENJA; MEHANIZAM REAKCIJE; ČIMBENICI KOJI UPLIVAJU NA STOPU REAKCIJE
1. Navedite tri primjera brzih i usporenih reakcija koje znate.
2. U reakciji A + B \u003d 2C + D, koja se javlja u gasnoj fazi, za 5 sekundi koncentracija supstance C porasla je sa 10 na 15 mol / L. Odredite prosječnu brzinu ove reakcije u određenom vremenskom periodu. Zašto u izjavi o problemu dolazi prosječna brzina, a ne samo brzina reakcije?
(3) U sintezi amonijaka iz azota i vodonika pod određenim uvjetima utvrđeno je da je brzina reakcije 15 mol / (l. S). Za koliko će se sekundi koncentracija vodika u reaktoru smanjiti za polovinu pri početnoj koncentraciji koja je jednaka 10 mol / l?
4. Ako se komad natrijuma baci u vodu, reakcija će se odvijati vrlo brzo. Predložite načine za a) ubrzanje ove reakcije, b) usporavanje.
9.8. Energija aktivacije. Katalizatori
Mnoge, čak i vrlo brze reakcije, ne nastavljaju se jednostavnim kontaktom reagensa. Na primjer, smjesa vodonika s kisikom može ostati na sobnoj temperaturi vrlo dugo bez promjene. Ali na to treba unijeti goruću šibicu, a reakcija počinje odvijati se vrlo brzo, često s eksplozijom (stoga se mješavina vodika i kisika u zapreminskom omjeru 2: 1 naziva čak i "detonirajućim plinom"). Koji je razlog?
Već smo rekli da ne dolazi do njihovog sudaranja molekula ili drugih hemijskih čestica, već samo oni efikasni, odnosno oni sudari čestica čija je ukupna energija veća od određene vrijednosti. Ova energija "praga" se naziva energija aktivacijeova reakcija.
Fizičko značenje energije aktivacije postaje jasno ako uzmemo u obzir grafikone promjena energije čestica tijekom reakcije, prikazane na sl. 9.5.

Lijevi graf odgovara egzotermnoj reakciji, a desni grafu endotermnoj. Na ovim kartama E 1 - prosječna energija molekula polaznih supstanci, E 2 - prosječna energija molekula proizvoda reakcije, E a - energija aktivacije, a ± Q - toplotni efekat reakcije.
Ako je energija aktivacije niska, tada će u početnim supstancama uvijek biti molekula koji mogu prevladati "energetsku barijeru" i pretvoriti se u molekule produkata reakcije. Ako je energija aktivacije velika, takvi se molekuli možda neće pojaviti u reaktoru. Dakle, što je niža energija aktivacije, veća je brzina reakcije, pod drugim jednakim uvjetima.
U praksi često postoje slučajevi kada je potrebno provesti reakciju čija je energija aktivacije vrlo visoka. Brzina takve reakcije je prirodno vrlo mala ili praktično jednaka nuli. Ako je istodobno nemoguće jako zagrijati reakcijsku smjesu (na primjer, početna tvar se raspada pri takvom zagrijavanju ili se ravnoteža pomiče prema početnoj tvari), da bi se dobila potrebna supstanca mora se ići "zaobilaznicom".
Katalizatori se ne koriste samo za ubrzavanje hemijski procesi... Ako je između reagensa moguće nekoliko reakcija, tada je pomoću katalizatora moguće provesti praktički samo onaj koji je potreban.
Smanjivanje energije aktivacije, katalizator ubrzava reakcije naprijed i nazad i stoga se ne može koristiti za pomicanje ravnoteže.
ENERGIJA AKTIVACIJE, KATALITIČKA REAKCIJA, KATALIST.
1. Zašto se brzina većine hemijskih reakcija u normalnim uvjetima s vremenom smanjuje? Da li je moguće provesti reakciju tako da njena brzina ostane konstantna? Šta trebam učiniti?
2. Hoće li se brzina reakcije joda sa vodonikom promijeniti ako se u reakcijsku smjesu uvede argon? Objasnite odgovor.
3. Kako će se promijeniti brzina reakcije A + B \u003d C, koja se u gasnoj fazi javlja u jednoj fazi, ako je a) koncentracija supstance A udvostručena; b) smanjiti koncentraciju supstance B za 2 puta; c) povećati koncentraciju svake od ovih supstanci za 2 puta; d) smanjiti koncentraciju supstance A za 2 puta, a koncentraciju supstance B povećati za 2 puta; e) da udvostruči pritisak u reaktoru?
(4) U smjesi vodonika i kisika na sobnoj temperaturi, zapreminski udjeli plinova ne mijenjaju se u nedogled. Možemo li pretpostaviti da je u ovoj smjesi uspostavljena hemijska ravnoteža?
5. U rasponu temperatura od 30 do 80 ° C, brzina neke reakcije povećala se dva puta zagrijavanjem na svakih 10 ° C. Odredite koliko puta će se brzina ove reakcije povećavati s porastom temperature sa 35 na 55 ° C.
6. Zašto mislite da se kvarljiva hrana drži u frižideru?
9.9. Elektroliza
Proučavajući prethodne paragrafe ovog poglavlja, upoznali ste se sa zakonitostima toka onih reakcija koje se odvijaju spontano („same od sebe“, bez stalnog dodatnog uticaja spolja). Sve ove reakcije teže ka stanju ravnoteže određenoj kombinacijom faktora energije i entropije. Međutim, u nekim slučajevima mogu se provesti reakcije čiji je spontani tok nemoguć. Primjer takvih reakcija su reakcije elektroliza.
Ako se metalne pločice primijene na suprotne površine kristala natrijevog klorida, povežu ih ampermetrom s izvorom električnog napona i zatvore krug, tada u krugu neće biti električne struje - kristalni natrijev klorid je dielektrik, odnosno tvar koja ne provodi električnu struju. Kationi i anioni u jonskom kristalu čvrsto su povezani jonskim vezama (elektrostatičkim silama) i ne mogu se slobodno kretati.
Ako su iste ploče uronjene u rastopinu natrijum-klorida ((„ispražnjene“), nastaju atomi natrijuma:
Sama riječ "elektroliza" može se prevesti kao "razgradnja električnom energijom".
Svi jonski spojevi (oksidi, hidroksidi, soli) mogu biti podvrgnuti elektrolizi ako se rastope bez raspadanja.
Jonska jedinjenja koja sadrže složene ione takođe prolaze elektrolizu, ali dešavaju se mnogo složeniji procesi.
Pokretni ioni nisu prisutni samo u rastopima jonskih jedinjenja, već i u njihovim rastvorima (vidi poglavlje XI), pa čak i u nekim čvrstim supstancama. Elektrolitičke reakcije su takođe moguće u ovim hemijskim sistemima.
ELEKTROLIZA, KATODA, ANODA.
Koja se od sljedećih supstanci može elektrolizirati: BaCl 2, SiO 2, Na 2 S, Al 2 O 3, NaOH, H 2 SO 4, Cu (OH) 2, CaCO 3?
Navedite razloge zbog kojih druge supstance nisu izložene tome.
2. Napravite elektroničke jednadžbe polureakcija i kemijske jednadžbe elektrolize supstanci koje ste odabrali.
1. Primjeri reakcija povezivanja, razgradnje, supstitucije i razmjene.
2. Redoks reakcije.