Aromatski ogljikovodiki so vrste izomerije. Arene
Benzen in njegovi najbližji homologi so brezbarvne tekočine s specifičnim vonjem. Aromatski ogljikovodiki so lažji od vode in se v njej ne raztopijo, vendar se zlahka raztopijo v organskih topilih - alkoholu, etru, acetonu.
Benzen in njegovi homologi so tudi sama dobra topila za številne organske snovi. Vsa prizorišča gorijo od zadimljenega plamena visoko vsebnost ogljik v njihovih molekulah.
Fizične lastnosti nekaterih aren so predstavljene v tabeli.
Tabela. Fizikalne lastnosti nekaterih aren
|
Ime |
Formula |
t ° .pl., |
t °. vre., |
|
Benzen |
C6H6 |
5,5 |
80,1 |
|
Toluen (metilbenzen) |
C6H5CH3 |
95,0 |
110,6 |
|
Etilbenzen |
C 6 H 5 C 2 H 5 |
95,0 |
136,2 |
|
Ksilen (dimetilbenzen) |
C6H4 (CH3) 2 |
||
|
orto- |
25,18 |
144,41 |
|
|
meta- |
47,87 |
139,10 |
|
|
par- |
13,26 |
138,35 |
|
|
Propil benzen |
C6H5 (CH2) 2CH3 |
99,0 |
159,20 |
|
Kumen (izopropilbenzen) |
C6H5CH (CH3) 2 |
96,0 |
152,39 |
|
Stiren (vinil benzen) |
C6H5CH \u003d CH2 |
30,6 |
145,2 |
Benzen - nizko vrelišče ( t bale\u003d 80,1 ° C), brezbarvna tekočina, netopen v vodi
Pozor! Benzen - strup, deluje na ledvice, spreminja krvno formulo (s podaljšano izpostavljenostjo), lahko moti strukturo kromosomov.
Večina aromatičnih ogljikovodikov je življenjsko nevarnih in strupenih.
Pridobivanje arenov (benzen in njegovi homologi)
V laboratoriju
1. Fuzija soli benzojske kisline s trdnimi alkalijami
C6H5-COONa + NaOH t →C6H6 + Na2CO3
natrijev benzoat
2. Würz-Fittingova reakcija: (tukaj je G halogen)
C 6H 5 -G + 2Na + R-G →C 6 H 5 - R + 2 NaD
Z 6 H 5 -Cl + 2Na + CH 3 -Cl → C 6 H 5 -CH 3 + 2NaCl
V industriji
- izolirani iz nafte in premoga z delno destilacijo, reformiranje;
- iz premogovega katrana in koksarniškega plina
1. Dehidrociklizacija alkanov z več kot 6 atomi ogljika:
C6H14 t , kat→ C 6 H 6 + 4 H 2
2. Trimerizacija acetilena (samo za benzen) - r. Zelinsky:
3C 2 H 2 600 ° C , Zakon. premog → C 6 H 6
3. Dehidrogenacija cikloheksan in njegovi homologi:
Sovjetski akademik Nikolaj Dmitrijevič Zelinski je ugotovil, da benzen nastaja iz cikloheksana (dehidrogenacija cikloalkanov
C6H12 t, kat→ C 6 H 6 + 3 H 2

C6H11-CH3 t , kat→ C 6 H 5 -CH 3 + 3H 2
metilcikloheksantoluen
4. Alkilacija benzena (pridobivanje homologov benzena) - p Friedel-Crafts.
C6H6 + C2H5-Cl t, AlCl3→ C 6 H 5 -C 2 H 5 + HCl
kloroetan etilbenzen

Kemijske lastnosti arenov
jaz... REAKCIJE OKSIDACIJE
1. Zgorevanje (dimni plamen):
2C6H6 + 15O2 t → 12CO 2 + 6H 2 O + Q
2. Benzen v normalnih pogojih ne razbarva vode broma in vodne raztopine kalijevega permanganata
3. Homologe benzena oksidira kalijev permanganat (razbarvanje kalijevega permanganata):
A) v kislo okolje na benzojsko kislino
Ko so benzolski homologi izpostavljeni kalijevemu permanganatu in drugim močnim oksidantom, stranske verige oksidirajo. Ne glede na to, kako zapletena je veriga substituentov, je uničena, z izjemo atoma ogljika, ki je oksidiran v karboksilno skupino.
Homologi benzena z eno stransko verigo dajejo benzojsko kislino:
Homologi, ki vsebujejo dve stranski verigi, dajejo dvobazne kisline:
5C 6 H 5 -C 2 H 5 + 12KMnO 4 + 18H 2 SO 4 → 5C 6 H 5 COOH + 5CO 2 + 6K 2 SO 4 + 12MnSO 4 + 28H 2 O
5C 6 H 5 -CH 3 + 6KMnO 4 + 9H 2 SO 4 → 5C 6 H 5 COOH + 3K 2 SO 4 + 6MnSO 4 + 14H 2 O
Poenostavljeno :
C6H5-CH3 + 3O KMnO4→ C 6 H 5 COOH + H 2 O
B) v nevtralnih in rahlo alkalnih do soli benzojske kisline
C 6 H 5 -CH 3 + 2KMnO 4 → C 6 H 5 COOК + K ОН + 2MnO 2 + H 2 O
II... DODATNI REAKCIJE (trše kot alkeni)
1. Halogeniranje
C6H6 + 3C12 h ν → C 6 H 6 Cl 6 (heksaklorocikloheksan - heksakloran)
2. Hidrogeniranje
C6H6 + 3H2 t , Pt ali Ni → C 6 H 12 (cikloheksan)
3. Polimerizacija
III. NADOMESTNE REAKCIJE - ionski mehanizem (lažji od alkanov)
b) homologi benzena pri obsevanju ali segrevanju
Po kemijskih lastnostih so alkilni radikali podobni alkanom. Atome vodika v njih z mehanizmom prostih radikalov nadomesti halogen. Zato v odsotnosti katalizatorja pri segrevanju ali UV obsevanju pride do reakcije radikalne substitucije v stranski verigi. Učinek benzenskega obroča na alkilne substituente vodi v dejstvo, da atom vodika pri atomu ogljika, ki je neposredno vezan na benzenski obroč (atom ogljika), se vedno nadomesti.
1) C6H5-CH3 + Cl2 h ν → C 6 H 5 -CH 2 -Cl + HCl
c) homologi benzena v prisotnosti katalizatorja
C6H5-CH3 + Cl2 AlCl 3 → (mešanica ort, par derivatov) + HCl
2. Nitriranje (z dušikovo kislino)
C 6 H 6 + HO-NO 2 t, H2SO4→ C 6 H 5 -NO 2 + H 2 O
nitrobenzen - vonj mandlji!
C6H5-CH3 + 3HO-NO2 t, H2SO4→ Z H3-C6H2 (NO2) 3 + 3H2O2,4,6-trinitrotoluen (tol, TNT)
Uporaba benzena in njegovih homologov
Benzen C 6 H 6 je dobro topilo. Benzen kot dodatek izboljšuje kakovost pogonskega goriva. Služi kot surovina za proizvodnjo številnih aromatičnih organskih spojin - nitrobenzen C 6 H 5 NO 2 (topilo, iz njega dobimo anilin), klorobenzen C 6 H 5 Cl, fenol C 6 H 5 OH, stiren itd.
Toluen C 6 H 5 –CH 3 je topilo, ki se uporablja za proizvodnjo barvil, zdravil in eksplozivov (TNT (tol) ali 2,4,6-trinitrotoluen TNT).
KsileniC6H4 (CH3) 2. Tehnični ksilen je mešanica treh izomerov ( orto-, meta- in par-xylenes) - uporablja se kot topilo in začetni produkt za sintezo številnih organskih spojin.
Izopropilbenzen C6H5 –CH (CH3) 2 se uporablja za pridobivanje fenola in acetona.
Klorovi derivati \u200b\u200bbenzena uporablja se za zaščito rastlin. Produkt substitucije atomov H v benzenu z atomi klora je heksaklorobenzen С 6 Сl 6 - fungicid; uporablja se za suho prelivanje semen pšenice in rži proti trdi smuti. Produkt dodajanja klora benzenu - heksaklorocikloheksan (heksakloran) C 6 H 6 Cl 6 - insekticid; uporablja se za boj škodljive žuželke... Omenjene snovi spadajo med pesticide - kemična sredstva za boj proti mikroorganizmom, rastlinam in živalim.
Stiren C 6 H 5 - CH \u003d CH 2 zelo enostavno polimerizira, tvori polistiren in kopolimerizira z butadien - stiren butadienskimi gumami.
VIDEO IZKUŠNJE
Aromatski ogljikovodiki (arene) - ogljikovodiki, katerih molekule vsebujejo enega ali več benzenskih obročev. Sestava arenov z enim benzenskim obročem ustreza splošni formuli C n H 2n-6 .
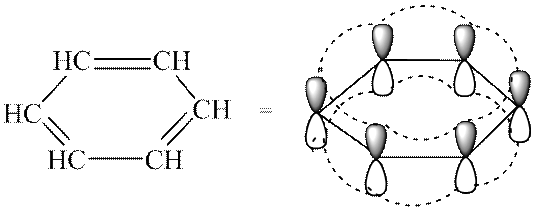
V molekuli najpreprostejšega arena - benzen (C 6 H 6) - - vezi tvorijo en delokaliziran konjugiran (aromatičen) sistem vezi.
Strukturo molekule najpreprostejšega arena - benzena - lahko prenesemo s strukturnimi formulami različnih vrst:
Izomeri in homologi
| r | benzen |
|||||
metilbenzen (toluen) |
||||||
etilbenzen |
1,2-dimetilbenzen ( orto-ksilen) |
1,3-dimetilbenzen ( meta-ksilen) |
1,4-dimetilbenzen ( par-ksilen) |
|||
propilbenzen |
izopropilbenzen |
1,2,4-tri-metilbenzen |
1-metil-2-etilbenzen |
1-metil-3-etilbenzen |
1-metil-4-etilbenzen |
|
| vELIKOST | ||||||
Ime substituiranega derivata benzena temelji na besedi "benzen". Atomi v benzenskem obroču so oštevilčeni, začenši od najvišjega substituenta do najnižjega. Primer: 1-metil-2-etilbenzen, ne 1-etil-2-metilbenzen. Če so substituenti enaki, se oštevilčenje izvede v skladu z kratka pot... Primer: 1,3-dimetilbenzen, ne 1,5-dimetilbenzen.
Predpone orto-, meta-, par- (iz grškega orthos - neposredno, meta - po, skozi, med, par - proti, blizu, preteklosti) v imenih organskih snovi (okrajšano: približno-, m-, p-) se uporabljajo za označevanje relativnega položaja dveh substituentov na benzenskem obroču.
Fizikalne lastnosti benzena: brezbarvna v vodi netopna tekočina s posebnim vonjem, tališče 5,4 o C, vrelišče 80,1 o C, gostota 0,88 g / cm 3. Hlapi benzena so strupeni.
Benzen v normalnih pogojih ne razbarva vode broma in raztopine kalijevega permanganata.
Pridobivanje aren
Naloge in testi na temo "Tema 3." Aromatski ogljikovodiki. "
- Ogljikovodiki. Polimeri - organske snovi 8-9 razred
Lekcije: 7 nalog: 9 preizkusov: 1
- - Človek v svetu snovi, materialov in kemijske reakcije 8-9 razred
Lekcije: 2 nalogi: 6 Testi: 1
- Razvrstitev snovi - Razredi anorganskih snovi 8-9 razred
Lekcije: 2 nalogi: 9 Testi: 1
- Kristalne rešetke - Struktura snovi 8-9 razred
Lekcije: 1 Naloge: 9 Testi: 1
- Sestava raztopin - Rešitve 8-9 razred
Lekcije: 3 naloge: 8 preizkusov: 1
Po preučitvi teme bi morali: obvladati koncepte aromatskih ogljikovodikov, aromatske vezi, poznati splošno formulo arenov, pravila nomenklature, vrste substitucijskih reakcij (halogeniranje v prisotnosti katalizatorja, nitriranje), dodajanje (halogeniranje v svetlobi , hidrogeniranje).
Preverite, ali znate izračunati izračune po enačbah reakcij in izpeljati molekulske formule snovi po masnih deležih elementov, poiskati donos reakcijskega produkta in rešiti probleme ob upoštevanju masnega deleža nečistoč.
Primer 1. Ogljikovodik z gostoto hlapov 15 za vodik vsebuje 80% ogljika. Poiščite njegovo molekularno formulo.
Odgovor: C2H6
2. primer Iz 7,8 g benzena smo dobili 8,61 g nitrobenzena. Določite donos reakcijskega produkta.
Odgovor: 70%
3. primer Tehnični kalcijev karbid, težak 20 g, smo obdelali z odvečno vodo. Kolikšen volumen acetilena smo dobili, če je bil masni delež nečistoč v tehničnem karbidu 20%.
Odgovor: 5,6 l
Potem ko se prepričate, da ste se naučili vsega, kar potrebujete, nadaljujte z nalogami na temo. Želimo vam veliko uspeha.
Priporočeno branje:
- OS Gabrielyan in drugi. Kemija 10 celic. M., Drolja, 2002;
- L. S. Guzei, R. P. Surovtseva, G. G. Lysova. Kemija 11 kl. Droga, 1999.
- G. G. Lysova. Opombe o podpori in testi na organska kemija... M., LLC "Glik plus", 1999.
INRENES
Aromatski ogljikovodiki (arene) - ciklični ogljikovodiki, združeni s konceptom aromatičnosti, ki določa skupne lastnosti v strukturi in kemijskih lastnostih.
Razvrstitev
Glede na število benzenskih obročev v molekuli arena, na:
mononuklearni
večžilni

Nomenklatura in izomerija
Strukturna osnova benzenov ogljikovodikov je benzen C 6 H 6iz katerega so zgrajena sistematična imena homologov.
Za monociklične spojine se obdržijo naslednja nesistematična (trivialna) imena:

Položaj substituentov je naveden v najmanjših številkah (smer oštevilčenja ni pomembna),
|
|
|
za di-substituirane spojine pa zapis orto, meta, par.
|
|
|
|
Če so v obroču trije substituenti, mora toni prejeti najmanjše številke, tj. vrstica "1,2,4" ima prednost pred "1,3,4".


1,2-dimetil-4-etilbenzen (pravilno ime) 3,4-dimetil-1-etilbenzen (napačno)
Izomerija monosubstituiranih arenov je posledica strukture ogljikovega okostja substituenta; v di- in polisubstituiranih benzolskih homologih je dodana izomerija, ki jo povzroča različna razporeditev substituentov v jedru.
Izomerija aromatskih ogljikovodikov sestave C 9 H 12:
|
|
|
|
|
Fizične lastnosti
Vrelišča in tališča arenov so višja kot pri alkanih, alkenih, alkinih, nizko polarnih, netopnih v vodi in dobro topnih v nepolarnih organskih topilih. Arene so tekočine ali trdne snovi s specifičnimi vonjavami. Benzen in številne zgoščene arene so strupene, od katerih imajo nekatere rakotvorne lastnosti. Vmesni produkti oksidacije zgoščenih arenov v telesu so epoksidi, ki bodisi sami neposredno povzročajo raka bodisi so predhodniki rakotvornih snovi.
Pridobivanje aren
Številni aromatični ogljikovodiki so zelo praktični in se proizvajajo v velikem industrijskem obsegu. Številne industrijske metode temeljijo na predelavi premoga in nafte.
Nafto sestavljajo predvsem alifatski in aliciklični ogljikovodiki; za pretvorbo alifatskih ali acikličnih ogljikovodikov v aromatske ogljikovodike so bile razvite metode aromatizacije olja, katerih kemijske osnove je razvil N.D. Zelinsky, B.A. Kazansky.
1. Ciklizacija in dehidrogenacija:
2. Hidrodezmetilacija:

3. Homologe benzena dobimo z alkiliranjem ali aciliranjem, čemur sledi redukcija karbonilne skupine.
a) Friedel-Crafts alkilacija:

b) Acilacija Friedel-Crafts:

4. Pridobivanje bifenila z Würz-Fittingovo reakcijo:
5. Pridobivanje difenilmetana po reakciji Friedel-Crafts:
Struktura in kemijske lastnosti.
Merila aromatičnosti:
Na podlagi teoretičnih izračunov in eksperimentalnih študij ciklično konjugiranih sistemov je bilo ugotovljeno, da je spojina aromatična, če ima:
- Ploski ciklični σ-okostje;
- Konjugiran zaprt π-elektronski sistem, ki zajema vse atome cikla in vsebuje 4n + 2, kjer je n \u003d 0, 1, 2, 3 itd. Ta formulacija je znana kot hückelovo pravilo.Merila aromatičnosti omogočajo razlikovanje konjugiranih aromatskih sistemov od vseh drugih. Benzen vsebuje sekstet π-elektronov in ustreza Hückelovemu pravilu za n \u003d 1.
Kaj daje aromo:
Kljub visoki stopnji nenasičenosti so aromatične spojine odporne na oksidante in temperaturo, bolj pa so nagnjene k substitucijskim reakcijam kot pa k dodajanju. Te spojine imajo povečano termodinamično stabilnost, ki jo zagotavlja visoka energija konjugacije obročnega aromatskega sistema (150 kJ / mol); zato je arene bolj prednostno vnašati v substitucijske reakcije, zaradi česar se ohrani aromatičnost.
Mehanizem elektrofilnih substitucijskih reakcij v aromatskem obroču:
Elektronska gostota π-konjugiranega sistema benzenskega obroča je primerna tarča za napad elektrofilnih reagentov.
Običajno med reakcijo nastajajo elektrofilni reagenti z uporabo katalizatorjev in ustreznih pogojev.
E - Y → E δ + - Y δ - → E + + Y -
Nastanek π-kompleksa.Začetni napad elektrofila π-elektronskega oblaka obroča vodi do koordinacije reagenta s π-sistemom in tvorbe kompleksa donor-akceptor, imenovanega π-kompleks.Aromatski sistem ni moten:

Oblikovanje σ-kompleksa. Omejitvena stopnja, v kateri elektrofil tvori kovalentno vez z atomom ogljika zaradi dveh elektronov π-sistema obroča, ki ga spremlja prehod tega atoma ogljika iz sp 2 -v sp 3 -hibridno stanje in aromatična motnja se molekula pretvori v karbokacijo.

Stabilizacija σ-kompleksa. Izvaja se tako, da se proton iz σ-kompleksa loči z bazo. V tem primeru se zaradi dveh elektronov prekinitve kovalentne vezi C - H obnovi zaprti π-sistem obroča, t.j. molekula se vrne v aromatično stanje:

Vpliv poslancev na reaktivnost in usmerjenost elektrofilne substitucije
Nadomestki v benzenskem obroču motijo \u200b\u200benakomernost porazdelitve π- elektronski oblak obroča in s tem vplivajo na reaktivnost obroča.
- Elektronski darovalci (D) povečajo elektronsko gostoto obroča in povečajo hitrost elektrofilne substitucije, taki substituenti se imenujejo aktiviranje.
- Zamenjali elektronov (A) znižujejo gostoto elektronov obroča in se zmanjšujejo hitrostna reakcijase imenujejo razkuževanje.
1. Razvrstitev aromatskih ogljikovodikov.
2. Homološke vrste monocikličnih aren, nomenklatura, priprava.
3. Izomerija, zgradba benzena in njegovi homologi.
4. Lastnosti aren.
Areni so z ogljikom bogati ciklični ogljikovodiki, ki vsebujejo jedro benzena v molekuli in imajo posebne fizikalne in kemijske lastnosti. Glede na število benzenskih obročev v molekuli in način povezovanja obročev so areni razdeljeni na monociklične (benzen in njegovi homologi) in policiklične (s kondenziranimi in izoliranimi obroči) spojine.
Arene benzenske serije lahko štejemo za produkte zamenjave vodikovih atomov v molekuli benzena z alkilnimi radikali. Splošna formula takih arenov СnH 2 n- 6. Ime radikala in cikla (benzen) je navedeno v imenu monosubstituiranih arenov:
benzen metilbenzen (toluen) etilbenzen.
V bolj substituiranih arenah je položaj radikalov označen z najmanjšimi številkami, v disubstituiranih arenah pa se položaj radikalov imenuje: 1,2 - orto ( o-) -, 1,3 - meta ( m-) - in 1,4 - par ( p-)-:

1,3-dimetilbenzen 1,2-metiletilbenzen
m-dimetilbenzen ( m-ksilen) približno-metiletilbenzen ( približno-ksilen)
Za arene so trivialna imena razširjena (nekatera imena so navedena v oklepajih).
Biti v naravi.
Aromatski ogljikovodiki se nahajajo v rastlinskih smolah in balzamih. Fenantren v delno ali popolnoma hidrogenirani obliki je vsebovan v strukturah številnih naravnih spojin, na primer steroidov, alkaloidov.
Pridobivanje aren:
1. suha destilacija premoga;
2. dehidrogenacija cikloalkanov

3. dehidrociklizacija alkanov s 6 ali več atomi ogljika v sestavi
4. alkilacija

![]()
Izomerija.Za homologe benzena je značilna strukturna izomerija: različne strukture ogljikovega okostja stranskega radikala ter različna sestava in razporeditev radikalov v benzenskem obroču. Na primer, izomeri aromatskih ogljikovodikov sestave C 9 H 12 (propilbenzen, izopropilbenzen, o-metiletilbenzen in 1,2,4-trimetilbenzen):
Struktura.Aromatski ogljikovodiki imajo številne značilnosti v elektronski strukturi molekul.
Strukturno formulo benzena je prvi predlagal A. Kekule. To je šestčlanski cikel z izmeničnimi dvojnimi in enojnimi vezmi, v strukturi se gibljejo dvojne vezi:
![]()
V obeh formulah je ogljik četverovalenten, vsi ogljikovi atomi so enakovredni in disubstituirani benzen obstaja kot trije izomeri ( orto-, meta-, par-). Takšna struktura benzena pa je bila v nasprotju z njegovimi lastnostmi: benzen ni vstopal v reakcije dodajanja (na primer brom) in oksidacije (na primer s kalijevim permanganatom), značilne za nenasičene ogljikovodike; zanj in njegovi homologi so glavna vrsta kemikalij. transformacija je substitucijske reakcije.
Sodobni pristop k opisu elektronske zgradbe benzena to protislovje reši na naslednji način. Atomi ogljika v molekuli benzena so v sp 2-hibridizaciji. Vsak od ogljikovih atomov tvori tri kovalentne σ-vezi - 2 vezi s sosednjimi atomi ogljika (sp 2 -sp 2 prekrivajoči se orbitali) in ena z atomom vodika (sp 2-s prekrivajoči se orbitali). Nehibridizirane p-orbitale zaradi bočnega prekrivanja tvorijo π-elektronski konjugirani sistem (π, π-konjugacija), ki vsebuje šest elektronov. Benzen je ravno pravilni šesterokotnik z dolžino vezi ogljik-ogljik 0,14 nm, vezjo ogljik-vodik 0,11 nm, koti vezi 120 0:

Molekula benzena je bolj stabilna kot ciklične spojine z izoliranimi dvojnimi vezmi; zato so benzen in njegovi homologi bolj nagnjeni k substitucijskim reakcijam (benzenski obroč je ohranjen) kot k dodajanju in oksidaciji.
Tudi druge ciklične spojine kažejo podobnosti v strukturi in lastnostih (aromatičnosti) z benzenom. Merila aromatičnosti (E. Hückel, 1931):
a) ravno ciklično strukturo, t.j. atomi, ki tvorijo cikel, so v sp 2 -hibridizaciji; b) povezani elektronski sistem; c) število elektronov (N) v obroču je 4n + 2, kjer je n poljubna celoštevilčna vrednost - 0,1,2,3 itd.
Merila aromatičnosti veljajo tako za nevtralne kot za nabite ciklično konjugirane spojine, zato bi bile aromatske spojine, na primer:
furan kation ciklopropenila.
Za benzen in druge aromatske spojine so najbolj značilne reakcije substitucije vodikovih atomov pri atomih ogljika v obroču, reakcije dodajanja na π-vezi v ciklu pa so manj značilne.
Fizične lastnosti.
Benzen in njegovi homologi so brezbarvne tekočine in kristalne snovi s posebnim vonjem. So lažji od vode in se v njej slabo raztopijo. Nepolarni benzen (μ \u003d 0), alkilbenzen -
polarne spojine (μ ≠ 0).
Kemijske lastnosti.
Elektrofilna substitucija.Najbolj značilna preobrazba arenov je elektrofilna substitucija - S E. Reakcija poteka v dveh fazah z nastankom vmesnega σ-kompleksa:
Reakcijski pogoji: temperatura 60-80 0 С, katalizatorji - Lewsove kisline ali mineralne kisline.
Tipične S E - reakcije:
a) halogeniranje(Cl2, Br2):
b) nitriranje:
v) sulfonacija(H2S04, SO3, oleum) :
d) Friedel-Craftsova alkilacija (1877)(RHal, ROH, alkeni) :
e) Friedel-Craftsova alkilacija(halogenidi, anhidridi karboksilne kisline):
V homologah benzena je zaradi vpliva stranskega radikala (+ I-učinek, skupina darovalcev elektronov) gostota π-elektronov benzenskega obroča neenakomerno porazdeljena in se poveča na 2,4,6-položajih. Zato S E-reakcije potekajo usmerjeno (v 2,4,6- oz približno-in p-določbe). Homologi benzena v primerjavi z benzenom kažejo večjo reaktivnost v tovrstnih reakcijah.
toluen p-klorotoluen približno-klorotoluen
Stranske radikalne reakcije v alkilbenzenih (radikalna substitucija -S R in oksidacija).
Radikalne substitucijske reakcije potekajo tako kot pri nasičenih ogljikovodikih z verižnim mehanizmom in vključujejo faze iniciacije, rasti in prekinitve verige. Reakcija kloriranja poteka neusmerjeno, bromirana reakcija je regioselektivna - zamenjava vodika poteka pri atomu α-ogljika.
V alkilbenzenih stranska veriga oksidira s kalijevim permanganatom, kalijevim dikromatom, da tvori karboksilne kisline. Ne glede na dolžino stranske verige se ogljikov atom, vezan na benzenski obroč (α-ogljikov ali benzil-ogljikov atom), oksidira, preostali ogljikovi atomi se oksidirajo v CO 2 ali karboksilne kisline.
etilbenzen benzojska kislina
p-metiletilbenzen-tereftalna kislina
Reakcije benzena s kršitvijo aromatskega sistema.
Aromatski ogljikovodiki imajo močan cikel, zato reakcije s kršitvijo aromatskega sistema (oksidacija, dodajanje radikalov) potekajo v težkih pogojih ( visoke temperature, močni oksidanti).
a) radikalni dodatek:
1. hidrogeniranje
![]()
toluen cikloheksan
2. kloriranje

benzen 1,2,3,4,5,6-heksaklorocikloheksan (heksakloran).
Produkt te reakcije je zmes prostorskih izomerov.
Usmeritev elektrofilne substitucije v aromatskih spojinah.Namestniki v benzenskem obroču so glede na njihov orientacijski vpliv razdeljeni na dve vrsti: orto-, par- orientante (substituenti 1. vrste) in meta-orientante (substituenti 2. vrste).
Namestniki 1. vrste so skupine, ki dajejo elektrone, ki povečajo elektronsko gostoto obroča, povečajo hitrost elektrofilne substitucijske reakcije in v teh reakcijah aktivirajo benzenski obroč:
D (+ I-učinek): - R, -CH2OH, -CH2 NH2 itd.
D (-I, + M-učinki): -NH 2, -OH, -OR, -NR 2, -SH itd.
Nadomestki druge vrste - elektronske odvzemne skupine, ki znižujejo elektronsko gostoto obroča, zmanjšujejo hitrost reakcije elektrofilne substitucije in v teh reakcijah deaktivirajo benzenski obroč:
A (-I-učinek): -SO 3 H, -CF 3, -CCl 3 itd.
A (-I, -M-učinek): -HC \u003d O, -COOH, -NO2 itd.
Atomi halogena zavzamejo vmesni položaj - znižajo elektronsko gostoto obroča, zmanjšajo hitrost elektrofilne substitucijske reakcije in v teh reakcijah deaktivirajo benzenski obroč. približno-,p-oriente.
Če sta v benzenskem obroču dva substituenta, lahko njihov usmerjevalni učinek sovpada ( dosledno usmerjenost) ali se ne ujema ( nedosledna usmerjenost). Pri elektrofilnih substitucijskih reakcijah spojine z dosledno orientacijo tvorijo manjše število izomerov; v drugem primeru nastane zmes večjega števila izomerov. Na primer:
 p-
hidroksibenzojska kislina m-
hidroksibenzojska kislina
p-
hidroksibenzojska kislina m-
hidroksibenzojska kislina
(dosledna usmeritev) (nedosledna usmeritev)
Policiklični kondenzirani aromatski ogljikovodiki (naftalen, antracen, fenantren itd.) So po lastnostih na splošno podobni benzenu, hkrati pa imajo nekatere razlike.
Uporaba:
1. aromatski ogljikovodiki - surovine za sintezo barvil, eksplozivov, zdravil, polimerov, površinsko aktivnih snovi, karboksilnih kislin, aminov;
2. Tekoči aromatski ogljikovodiki so dobra topila za organske spojine;
3. arene - dodatki za pridobivanje visokooktanskega bencina.
Ali veš to -Leta 1649 je nemški kemik Johann Glauber prvič pridobil benzen.
Leta 1825 je M. Faraday iz plina iz žarnice izoliral ogljikovodik in določil njegovo sestavo - C 6 H 6.
Leta 1830 je Justus Liebig nastalo spojino imenoval benzen (iz arabske arome Ven-aroma + zoa-sok + latinsko ol-olje).
Leta 1837 je Auguste Laurent benzenski radikal imenoval C 6 H 5 - fenil (iz grškega phenix-light).
Leta 1865 je nemški organski kemik Friedrich August Kekule predlagal formulo za benzen z izmeničnimi dvojnimi in enojnimi vezmi v šestčlenskem ciklu.
V 1865-70-ih je V. Kerner predlagal uporabo predpon za označevanje relativnega položaja dveh substituentov: 1,2 položaj - orto- (ortos - naravnost); 1,3- meta (meta - po) in 1,4- par (odstavek je nasproten).
Aromatski ogljikovodiki so zelo strupene snovi, ki povzročajo zastrupitve in poškodbe nekaterih organov, kot so ledvice in jetra.
Nekateri aromatski ogljikovodiki so rakotvorne snovi (snovi, ki povzročajo raka), na primer benzen (ki povzroča levkemijo), eden najmočnejših je benzopiren (najdemo ga v tobačnem dimu).
TEMA 20. Aromatski ogljikovodiki iz benzenske serije.
Homološke serije. Splošna formula. Nomenklatura. Izomerija.
Naravni viri in metode pridobivanja: iz alifatskih, alicikličnih in aromatskih spojin. Reakcije Würz-Fittiga in Friedel-Crafts.
Fizikalne lastnosti benzena in njegovih homologov.
Kemijske lastnosti. Elektrofilne substitucijske reakcije: halogeniranje, nitriranje, sulfonacija, alkilacija in acilacija. Reakcije dodajanja vodika, halogenov, ozona. Oksidacija benzena. Stranske verižne reakcije homologov benzena: halogeniranje, nitriranje, oksidacija, dehidrogeniranje.
Homološke serije. Splošna formula.
Prvi in \u200b\u200bnajbolj pomemben predstavnik monociklični aromatski ogljikovodiki (areni) so benzenC6H6.
Od tod pogosto ime homologne serije aromatskih ogljikovodikov - serija benzena.
Splošna formulahomologne serije benzena: C p N 2p-6.
Nomenklatura aren.
Arene pogosto poimenujejo s trivialnimi imeni: benzen, toluen, stiren, kumen itd.
V skladu z mednarodno nadomestno nomenklaturoareni se štejejo za derivate benzena, pri katerih je položaj substituentov označen s številkami, medtem ko mora biti število atomov ogljika, v katerih so substituenti, najmanjše:
metilbenzen etilbenzen izopropilbenzen
(toluen) (kumen)

vinilbenzen etinbenbenzen
(stiren) (fenilacetilen)
V primeru dveh enakih nadomestkov lahko namesto številk uporabite predpone: 1,2- (orto-), 1,3- (meta-), 1,4- (para-):

1,2-dimetilbenzen 1,3-dimetilbenzen 1,4-dimetilbenzen
(orto-ksilen) (meta-ksilen) (para-ksilen)