Kemijske lastnosti možnosti priprave alkenov 1. Fizikalne lastnosti alkenov, uporaba, proizvodne metode
Alkeni so nenasičeni ogljikovodikiki imajo eno dvojno vez med atomi. Njihovo drugo ime so olefini, povezano je z zgodovino odkritja tega razreda spojin. V osnovi teh snovi v naravi ni, jih pa človek sintetizira za praktične namene. V nomenklaturi IUPAC je ime teh spojin oblikovano po enakem principu kot za alkane, le pripona "an" se nadomesti z "en".
V stiku z
Struktura alkenov
Dva atoma ogljika, ki sodelujeta pri tvorbi dvojne vezi, sta vedno v hibridizaciji sp2, kot med njima pa je enak 120 stopinj. Dvojna vez nastane s prekrivanjem π -π orbital, vendar ni zelo močna, zato je ta vez dovolj enostavna za prekinitev, ki se uporablja pri kemijskih lastnostih snovi.
Izomerija
V primerjavi z omejevalnimi je v teh ogljikovodikih to mogoče več vrst, tako prostorski kot strukturni. Strukturno izomerijo lahko razvrstimo tudi v več vrst.
Prva obstaja tudi za alkane in je v drugačnem vrstnem redu povezovanja ogljikovih atomov. Izomeri so torej lahko penten-2 in 2-metilbuten-2. In drugo je sprememba položaja dvojne vezi.
Prostorska izomerija v teh spojinah je možna zaradi pojava dvojne vezi. Je dveh vrst - geometrijska in optična.
Geometrijska izomerija je ena najbolj razširjenih vrst v naravi, medtem ko bodo imeli skoraj vedno geometrijski izomeri radikalno različne fizikalne in kemijske lastnosti. Razlikovati cis in trans izomeri.Prvič, substituenti se nahajajo na eni strani večkratna povezava, medtem ko so za trans izomere v različnih ravninah.
Proizvodnja alkenov
 Prvič so jih, tako kot mnoge druge snovi, dobili povsem po naključju.
Prvič so jih, tako kot mnoge druge snovi, dobili povsem po naključju.
Nemški kemik in raziskovalec Becher je konec 17. stoletja preučeval učinek žveplove kisline na etilni alkohol in ugotovil, da dobil neznan plin, ki je bolj reaktiven kot metan.
Pozneje podobne študije izvedlo še več znanstvenikov, izvedeli so tudi, da ta plin pri interakciji s klorom tvori oljnato snov.
Zato je bil sprva ta razred spojin z imenom olefini, kar se prevede kot mastno. A vseeno znanstveniki niso uspeli določiti sestave in zgradbe te spojine. To se je zgodilo šele skoraj dve stoletji pozneje, konec devetnajstega stoletja.
Trenutno obstaja veliko načinov za pridobivanje alkenov.
Industrijske metode
Prejemanje industrijske metode:
- Dehidrogeniranje nasičenih ogljikovodikov. Ta reakcija je mogoča le pod vplivom visokih temperatur (približno 400 stopinj) in katalizatorjev - bodisi kromovega oksida 3 ali aluminijevo-platinastih katalizatorjev.
- Dehalogeniranje dihaloalkanov. Pojavi se le v prisotnosti cinka ali magnezija in pri visokih temperaturah.
- Dehidrohalogeniranje haloalkanov. Izvaja se z uporabo natrijevih ali kalijevih soli organskih kislin pri povišanih temperaturah.
Pomembno! Te metode pridobivanja alkenov ne dajo čistega produkta; rezultat reakcije bo mešanica nenasičenih ogljikovodikov. Prevladujoča spojina med njimi je določena z uporabo pravila Zaitsev. Pravi, da se vodik najverjetneje odcepi od ogljikovega atoma, ki ima najmanj vezi z vodiki.
Dehidracija alkohola. Izvaja se lahko le pri segrevanju in v prisotnosti raztopin močnih mineralnih kislin z lastnostjo odstranjevanja vode.
Hidrogeniranje alkinov. Možno samo v prisotnosti paladij katalizatorjev.
Kemijske lastnosti alkenov
Alkeni so zelo kemično aktivne snovi.To je v veliki meri posledica prisotnosti dvojne vezi. Najbolj značilne reakcije za ta razred spojin so elektrofilni in radikalni dodatek.
- Halogeniranje alkenov - se nanaša na klasične reakcije elektrofilnega dodajanja. Pojavi se le v prisotnosti inertnih organskih topil, najpogosteje ogljikovega tetraklorida.
- Hidrohalogeniranje. Ta vrsta spajanja se izvede v skladu s pravilom Markovnikov. Ion se veže na bolj hidrogeniran ogljik v bližini dvojne vezi, zato se halidni ion veže na drugi ogljik. To pravilo je kršeno v prisotnosti peroksidnih spojin - učinek Harrosh. Dodajanje vodikovega halogenida se zgodi povsem nasprotno pravilu Markovnikova.
- Hidroboracija. Ta reakcija je zelo pomembna v praksi. Zato znanstvenik, ki ga je celo odkril in preučeval prejel Nobelovo nagrado. Ta reakcija poteka v več fazah, dodajanje borovega iona pa ne sledi pravilu Markovnikova.
- Hidratacija ali dodajanje alkenov. Ta reakcija poteka tudi v skladu s pravilom Markovnikova. Hidroksidni ion je vezan na najmanj hidrogeniran ogljikov atom v dvojni vezi.
- Alkilacija je še ena reakcija, ki se pogosto uporablja v industriji. Sestavljen je iz dodajanja nasičenih ogljikovodikov nenasičenim pod vplivom nizkih temperatur in katalizatorjev za povečanje atomske mase spojin. Močne mineralne kisline so najpogosteje katalizator. Tudi ta reakcija lahko poteka po mehanizmu prostih radikalov.
- Polimerizacija alkenov je še ena nenavadna reakcija nasičenih ogljikovodikov. Predpostavlja povezavo številnih molekul med seboj, da se tvori močna povezava, ki se razlikuje po svojih fizikalnih lastnostih.
 n v tej reakciji je število molekul, ki so stopile v vez. Predpogoj za izvedbo je kislo okolje, povišana temperatura in zvišan tlak.
n v tej reakciji je število molekul, ki so stopile v vez. Predpogoj za izvedbo je kislo okolje, povišana temperatura in zvišan tlak.
Za alkene so značilne tudi druge elektrofilne reakcije dodajanja, ki niso prejeli tako obsežne praktične distribucije.
Na primer reakcija dodajanja alkoholov, da nastanejo etri.
Ali dodajanje kislinskih kloridov s prejemom nenasičenih ketonov - Kondakova reakcija.
Opomba!Ta reakcija je mogoča le v prisotnosti katalizatorja cinkovega klorida.
Naslednji glavni razred reakcij, značilnih za alkene, so reakcije radikalnih adicij. Te reakcije so možne le, če prosti radikali nastanejo pod vplivom visokih temperatur, sevanja in drugih vplivov. Najbolj značilna reakcija radikalnega dodajanja je hidrogeniranje s tvorbo nasičenih ogljikovodikov. Pojavi se izključno pod vplivom temperature in v prisotnosti platinskega katalizatorja.
Zaradi prisotnosti dvojne vezi so alkeni zelo značilni za različne reakcije oksidacije.
- Zgorevanje je klasična reakcija oksidacije. Dobro deluje brez katalizatorjev. Glede na količino kisika so možni različni končni proizvodi: od ogljikovega dioksida do ogljika.
- Oksidacija s kalijevim permanganatom v nevtralnem mediju. Izdelki so polihidrični alkoholi in rjavi manganov dioksid. Ta reakcija velja za kakovostno za alkene.
- Prav tako lahko blago oksidacijo izvedemo z vodikovim peroksidom, osmijevim oksidom 8 in drugimi oksidanti v nevtralnem okolju. Za blago oksidacijo alkenov je značilen le en prelom vezi; reakcijski produkt so praviloma polihidrični alkoholi.
- Možna je tudi močna oksidacija, pri kateri se obe vezi pretrgata in nastanejo kisline ali ketoni. Predpogoj je kislo okolje, ki se najpogosteje uporablja žveplova kislinasaj lahko tudi druge kisline oksidirajo in tvorijo stranske produkte.
Fizikalne lastnosti alkenov
 Edini plini v normalnih pogojih so etilen, propen in buten.
Edini plini v normalnih pogojih so etilen, propen in buten.
Od pentena do heptodecena so vsi alkeni v tekočem stanju.
In vse ostalo so trdne snovi.
Tališča in vrelišča se povečujejo sorazmerno z naraščajočo molekulsko maso, vendar se pri izomerah lahko razlikujejo.
Vsi alkeni ne raztapljajte v vodi, vendar se dobro raztopijo v inertnih organskih topilih.
Uporaba alkenov
Alkeni se pogosto uporabljajo v industriji in se uporabljajo za sintezo velikega števila snovi. Na primer, s pomočjo etilena sintetiziramo polivinilklorid (PVC), stiren, etilen glikol, etanol, polietilen, gume in številne druge snovi. Največja količina propilena se uporablja za proizvodnjo polipropilena.
Alkeni - zgradba, lastnosti, uporaba
Preučujemo kemijo - lastnosti alkenov, uporaba v industriji
Zaključek
Na splošno lahko zagotovo trdimo, da so alkeni zaradi svojih kemijskih lastnosti v velikem povpraševanju v industriji. Ukvarjajo se s proizvodnjo najrazličnejših plastičnih mas, gum in številnih drugih snovi.
Spodnji alkeni (C 2 - C 5) se pridobivajo v industrijskem merilu iz plinov, ki nastanejo med termično obdelavo nafte in naftnih derivatov. Alkene je mogoče dobiti tudi z laboratorijskimi metodami sinteze.
4.5.1. Dehidrohalogeniranje
Ko haloalkane obdelamo z bazami v brezvodnih topilih, na primer z alkoholno raztopino kavstičnega kalija, se izloči vodikov halid.
4.5.2. Dehidracija
Ko se alkoholi segrejejo z žveplovo ali fosforno kislino, pride do intramolekularne dehidracije ( - izločanje).
Prevladujoča smer reakcije, tako kot pri dehidrohalogeniranju, je tvorba najbolj stabilnega alkena (Zaitsevo pravilo).
Dehidracijo alkoholov lahko izvedemo s prehajanjem alkoholnih hlapov preko katalizatorja (aluminijevi ali torijevi oksidi) pri 300 - 350 o C.
4.5.3. Dehalogeniranje vicinalnih dihalidov
Z delovanjem cinka v alkoholu se lahko dibromidi, ki vsebujejo halogene na sosednjih atomih (vicinal), pretvorijo v alkene.

4.5.4. Hidrogeniranje alkinov
Ko se alkini hidrogenirajo v prisotnosti platinastih ali nikljevih katalizatorjev, katerih aktivnost se zmanjša z dodatkom majhne količine svinčevih spojin (katalitični strup), nastane alken, ki ni več reduciran.
4.5.5. Zmanjševanje kombinacije aldehidov in ketonov
Po obdelavi z litijev aluminijevim hidridom in titanovim (III) kloridom iz dveh molekul aldehida ali ketona nastanejo di- ali tetrasubstituirani alkeni z dobrimi izkoristki.

5. ALKINI
Alkini so ogljikovodiki, ki vsebujejo trojno vez ogljik-ogljik –CC–.
Splošna formula enostavnih alkinov je C n H 2n-2. Najenostavnejši predstavnik razreda alkinov je acetilen H - CC - H, zato alkine imenujemo tudi acetilenski ogljikovodiki.
5.1 Struktura acetilena
Atomi ogljika acetilena so v sp-hibridno stanje. Oglejmo orbitalno konfiguracijo takega atoma. Pri hibridizaciji 2 s-orbitale in 2p-orbitale tvorita dva enakovredna sp-hibridne orbitale, ki se nahajajo v eni ravni črti, dve pa nehibridizirani r-orbitalna.

Slika: 5.1 Shemanastaneksp -hibridne orbitale ogljikovega atoma
Smer in oblike orbital sr-hibridizirani atom ogljika: hibridizirane orbitale so enakovredne, med seboj največje oddaljene
V molekuli acetilena je preprosta vez ( - vez) med atomi ogljika nastane s prekrivanjem dveh sp-hibridizirane orbitale. Dva medsebojno pravokotna - obveznice nastanejo, ko sta dva para nehibridizirana 2p-orbitale, - elektronski oblaki pokrivajo okostje, tako da ima elektronski oblak simetrijo blizu cilindrične. Vezi z vodikovimi atomi nastanejo zaradi sp-hibridne orbitale ogljikovega atoma in 1 s-orbitali vodikovega atoma, je molekula acetilena ravna.

Slika: 5.2 Molekula acetilena
a - stransko prekrivanje 2porbitali daje dve -povezave;
b - molekula je linearna, - oblak ima valjasto obliko
V propini obstaja preprosta povezava ( - komunikacija z sp -FROM sp3 krajši od analogne povezave C sp -FROM sp2 pri alkenih je to posledica dejstva, da sp-orbitala bližje jedru kot sp 2 - orbitalna .
Trojna vez ogljik-ogljik C C je krajša od dvojne vezi, skupna energija trojne vezi pa je približno enaka vsoti energij ene preproste vezi C - C (347 kJ / mol) in dveh vezi (259 · 2 kJ / mol) (tabela 5.1 ).
Najbolj preprosto organske spojine so nasičeni in nenasičeni ogljikovodiki. Sem spadajo snovi iz razreda alkani, alkini, alkeni.
Njihove formule vključujejo atome vodika in ogljika v določenem zaporedju in količini. V naravi so pogoste.
Določanje alkenov
Njihovo drugo ime so olefini ali etilen ogljikovodiki. Tako so v 18. stoletju imenovali ta razred spojin, ko so odkrili oljno tekočino - etilenklorid.
Alkeni so snovi, sestavljene iz vodika in ogljikovih elementov. Uvrščeni so med aciklične ogljikovodike. V njihovi molekuli obstaja enojna dvojna (nenasičena) vez, ki med seboj povezuje dva ogljikova atoma.
Formule alkena
Vsak razred spojin ima svojo kemijsko oznako. V njih simboli elementov periodični sistem navedena je sestava in struktura vezi vsake snovi.

Splošno formulo alkenov označujemo na naslednji način: C n H 2n, kjer je število n večje ali enako 2. Ko ga razberemo, je razvidno, da sta za vsak atom ogljika dva atoma vodika.
Molekulske formule alkenov iz homologne serije predstavljajo naslednje strukture: C 2 H 4, C 3 H 6, C 4 H 8, C 5 H 10, C 6 H 12, C 7 H 14, C 8 H 16, C 9 H 18, C10H20. Vidno je, da vsak naslednji ogljikovodik vsebuje še en ogljik in še dva vodika.
Obstaja grafična oznaka lokacije in vrstnega reda kemične spojine med atomi v molekuli, kar kaže strukturna formula alkenov.Z valenčnimi črticami je prikazana vez ogljika z vodikom.
Strukturno formulo alkenov lahko kadar koli prikažemo v razširjeni obliki kemični elementi in komunikacija. Bolj jedrnat izraz za olefine ne prikazuje spojine ogljika in vodika z valentnimi pomišljaji.
Skeletna formula označuje najpreprostejšo strukturo. Prelomljena črta predstavlja osnovo molekule, v kateri so ogljikovi atomi predstavljeni z njenimi vrhovi in \u200b\u200bkonci, povezave pa vodik.
Kako nastajajo olefinska imena
CH 3 -HC \u003d CH 2 + H 2 O → CH 3 -OHCH-CH 3.
Ko so alkeni izpostavljeni žveplovi kislini, pride do procesa sulfonacije:
CH 3 -HC \u003d CH 2 + HO-OSO-OH → CH 3 -CH 3 CH-O-SO 2 -OH.
Reakcija poteka s tvorbo kislih estrov, na primer izopropil žveplove kisline.
Alkeni so med izgorevanjem dovzetni za oksidacijo pod delovanjem kisika in tvorijo vodo in plin iz ogljikovega dioksida:
2CH 3 -HC \u003d CH 2 + 9O 2 → 6CO 2 + 6H 2 O.
Medsebojno delovanje olefinskih spojin in razredčenega kalijevega permanganata v obliki raztopine vodi do tvorbe glikolov ali dvoatomskih alkoholov. Ta reakcija je tudi oksidativna z nastankom etilen glikola in razbarvanjem raztopine:
3H 2 C \u003d CH 2 + 4H 2 O + 2KMnO 4 → 3OHCH-CHOH + 2MnO 2 + 2KOH.
Molekule alkenov lahko sodelujejo pri polimerizaciji s prostim radikalom ali kationno-anionskim mehanizmom. V prvem primeru pod vplivom peroksidov dobimo polimer polietilenskega tipa.
Po drugem mehanizmu kisline delujejo kot kationski katalizatorji, organometalne snovi pa so anionske s sproščanjem stereoselektivnega polimera.
Kaj so alkani
Imenujejo se tudi parafini ali nasičeni aciklični ogljikovodiki. Imajo linearno ali razvejano strukturo, ki vsebuje le nasičene enostavne vezi. Vsi predstavniki tega razreda imajo splošno formulo C n H 2n + 2.

Vsebujejo samo atome ogljika in vodika. Splošna formula za alkene izhaja iz zapisa nasičenih ogljikovodikov.
Imena alkanov in njihove značilnosti
Najenostavnejši predstavnik tega razreda je metan. Sledijo snovi, kot so etan, propan in butan. Njihovo ime temelji na korenu številke v grščini, ki ji je dodana pripona -an. Imena alkanov so navedena v nomenklaturi IUPAC.
Splošna formula alkenov, alkinov, alkanov vključuje le dve vrsti atomov. Sem spadajo elementi ogljik in vodik. Število ogljikovih atomov je v vseh treh razredih enako, razliko opazimo le pri številu vodika, ki ga lahko odcepimo ali pritrdimo. Od dobite nenasičene spojine. Predstavniki parafinov v molekuli vsebujejo 2 vodikova atoma več kot olefini, kar potrjuje splošna formula alkanov, alkenov. Struktura alkenov je zaradi prisotnosti dvojne vezi nenasičena.
Če v al-ka-nah povežemo število atomov na vodni osnovi in \u200b\u200bna osnovi ogljika, bo vrednost max-si-mal-ny v primerjavi z drugimi razredi ang-le-vo-do -ro-dov.
Od metana do butana (od C 1 do C 4) snovi obstajajo v plinasti obliki.
V tekoči obliki so predstavljeni ogljikovodiki s homolognim razponom od C 5 do C 16. Začenši z alkanom, ki ima v glavni verigi 17 atomov ogljika, pride do prehoda agregatnega stanja v trdno obliko.
Zanje je značilna izomerija ogljikovega okostja in optične modifikacije molekule.

V parafinih se šteje, da valenco ogljika v celoti zasedajo sosednji koti ali vode-palice z oblikovanjem vezi tipa σ. S stališča chi-ch-ch to določa njihove šibke lastnosti, zato se alkani imenujejo pre-del-n-x ali n-sy-schen-n-x ug-le-vo-do-ro- golobi brez afinitete.
Vstopajo v substitucijske reakcije, povezane z radikalnim halogeniranjem, sulfokloriranjem ali nitriranjem molekule.
Parafini se pri visokih temperaturah podvržejo oksidaciji, zgorevanju ali razgradnji. Pod delovanjem reakcijskih pospeševalcev se izločijo atomi vodika ali dehidrirajo alkani.
Kaj so alkini
Imenujejo se tudi acetilenski ogljikovodiki, ki imajo v ogljikovi verigi trojno vez. Struktura alkinov je opisana s splošno formulo C n H 2 n-2. Iz njega je razvidno, da za razliko od alkanov acetilenski ogljikovodiki nimajo štirih atomov vodika. Nadomestita jih s trojno vezjo, ki jo tvorita dve π-spojini.
Ta struktura določa kemijske lastnosti tega razreda. Strukturna formula alkenov in alkinov jasno kaže na nenasičenost njihovih molekul, pa tudi na prisotnost dvojnih (H 2 C꞊CH 2) in trojnih (HC≡CH) vezi.
Ime alkinov in njihove značilnosti
Najenostavnejši primer je acetilen ali HC≡CH. Imenuje se tudi etin. Izhaja iz imena nasičenega ogljikovodika, pri katerem se odstrani končnica -an in doda -in. V imenih dolgih alkinov številka označuje lokacijo trojne vezi.
Če poznamo strukturo nasičenih in nenasičenih ogljikovodikov, je mogoče ugotoviti, pod katero črko je navedena splošna formula alkinov: a) CnH2n; c) CnH2n + 2; c) CnH2n-2; d) CnH2n-6. Tretja možnost je pravilen odgovor.
Začnejo z acetilenom in končajo z butanom (od C 2 do C 4), snovi imajo plinasto naravo.

Ogljikovodiki v homolognem območju od C 5 do C 17 so v tekoči obliki. Začenši z alkinom, ki ima v glavni verigi 18 atomov ogljika, pride do prehoda fizičnega stanja v trdno obliko.
Zanje je značilna izomerija v ogljikovem okostju, v položaju trojne vezi, pa tudi medrazredne modifikacije molekule.
Avtor kemijske lastnosti acetilenski ogljikovodiki so podobni alkenom.
Če ima alkin končno trojno vez, potem opravljajo funkcijo kisline s tvorbo alkinidnih soli, na primer NaC≡CNa. Prisotnost dveh π-vezi naredi molekulo natrijevega acetiledina močan nukleofil, ki vstopi v substitucijske reakcije.
Acetilen klorira v prisotnosti bakrovega klorida, da dobi dikloracetilen, kondenzira pod delovanjem haloalkinov s sproščanjem molekul diacetilena.
Alkini sodelujejo v reakcijah, katerih princip je osnova halogeniranja, hidrohalogeniranja, hidracije in karbonilacije. Vendar so takšni procesi šibkejši od alkenov z dvojno vezjo.
Za acetilenske ogljikovodike so možne nukleofilne reakcije dodajanja molekul alkohola, primarnega amina ali vodikovega sulfida.
4.3.b. Dodajanje vodikovih halogenidov (hidrohalogeniranje)
Druga pomembna reakcija elektrofilnega dodajanja alkenom je dobro znano hadrohalogeniranje alkenov.
Spodaj so tipični primeri dodajanja HCl, HBr in HI različnim alkenom.


Vpliv alkilnih substituentov na dvojno vez na hitrost vezave je opisan z naslednjim zaporedjem:
R 2 C \u003d CHR\u003e RCH \u003d CHR\u003e RCH \u003d CH 2
To je v skladu z mehanizmom, pri katerem nastaja karbokacija na stopnji reakcije, ki določa hitrost, saj se stabilnost alkilnih kationov zmanjšuje v terciarnem\u003e sekundarnem\u003e primarnem redu. Mehanizem dodajanja mora torej vključevati vmesno tvorbo bodisi prostega karbokacije, ki je redko opažena, bodisi intermediata s karbokacijskim značajem. Slednji primer je najbolj značilen.
Če bi dodajanje potekalo s "prostim karbokacijo", bi bila reakcija popolnoma nestereoselektivna, saj imajo alkilni kationi plosko strukturo. Vendar hidrohalogeniranje praviloma poteka stereoselektivno in, odvisno od vrste alkena, selektivno anti-povezava, selektivna sinh- ali mešano sinh-anti-druženje.
Za alkene, pri katerih dvojna vez ni konjugirana z aromatskim obročem, je značilna anti-dodajanje vodikovega halogenida. Antidodatek vodikovega klorida in bromida, devterijevega klorida in bromida opazimo pri cikloheksenu, ciklopentenu, 1,2-dimetilheksenu, 1,2-dimetilpentenu, cis- in trans-buten-2, heksen-3 in številni drugi preprosti alkeni in cikloalkeni.

V dodatku so isti substituenti (metilne skupine) na različnih straneh srednje ravnine cikloheksanskega obroča, zato spada v trans-blizu. Anti-dodatek je komaj združljiv z mehanizmom, v katerem se predpostavlja nastanek diskretne karbokacije. Za ravninsko karbokacijo je nukleofilni napad halogenidnega iona enako verjeten na obeh straneh ravnine, kar bi moralo privesti do tvorbe mešanice produktov sinh- in anti-povezava. Kinetika hidrohalogeniranja alkenov kaže tudi na bolj zapleten mehanizem dodajanja. Za nekonjugirane alkene je hitrost reakcije opisana z enačbo tretjega reda z vodikovim halogenidom drugega reda, to pomeni, da ustreza mehanizmu Ad E 3.
v \u003d k [alken] 2
Protiv dodajanja in drugi vrstni red reakcije glede na halogenidni vodik se dobro ujemata z mehanizmom Ad E 3, pri katerem alken sodeluje z dvema molekulama vodikovega halogenida, od katerih ena deluje kot elektrofilno sredstvo, druga pa kot nukleofilno sredstvo.

Ta trimolekularni mehanizem predvideva, da na začetku nastane kompleks alkena in ene molekule vodikovega halogenida, čemur sledi napad druge molekule HX na ta kompleks z anti-strani brez tvorbe diskretnega karbokationa. Posebej je treba opozoriti, da mora biti kateri koli trimolekularni mehanizem sestavljen iz dveh zaporednih stopenj, saj je trčenje treh molekul hkrati zelo malo verjetno.

Protiv dodajanja kaže na prednostni nukleofilni napad vodikovega halogenida s strani, ki je nasprotna strani, od koder se alken protonira. Namesto halogenida vodika lahko funkcijo nukleofilnega sredstva v končni fazi opravlja tudi halogenidni ion. Dejansko se hitrost reakcije običajno poveča sorazmerno s koncentracijo halogenidovega iona, vnesenega v reakcijsko zmes v obliki tetraalkilamonijevih halogenidov NR 4+ X - ali litijev LiX. V tem primeru obstaja stereospecifik anti-druženje.
Za alkane, pri katerih je dvojna vez konjugirana na aromatski obroč, je značilna sinh-druženje ali mešanje sinh-anti-dodajanje vodikovega halogenida, na primer:

Sin-navezanost je prevladujoč postopek za cis- in trans-izomeri 1-fenilpropena, 1-fenil-4-alkilcikloheksena, acenaftilena, indena. Ko se takšni alkeni protonirajo, nastanejo karbokacije benzilnega tipa, ki so stabilnejše od čisto alkilnih kationov, ki nastanejo pri protoniranju običajnih alkenov in cikloalkenov. Kinetiko reakcije v tem primeru običajno opisuje preprostejša enačba drugega reda v \u003d k [alken], tj. Ustreza bimolekularnemu mehanizmu Ad E 2. Ad E 2-Mehanizem vključuje tvorbo ionskega para, vključno s karbokacijo in halidnim ionom.

Ne moremo pričakovati, da bo mehanizem dodajanja, ki vključuje ionske pare, zelo stereoselektiven. Če se ionski par pretvori v končni izdelek hitreje, kot da se vrti okoli preproste vezi ogljik-ogljik, je končni rezultat sinh-dodatka, kjer sta na isto stran dvojne vezi pritrjena proton in halogenidni ion. V nasprotnem primeru nastanek izdelkov opazimo kot sinh- in anti-povezava HX. To velja za hidrohalogeniranje par-supstituirani stireni Z-C 6 H 4 -CH \u003d CH 2. Tu je opazen vzorec sinh-dodajanje je značilno le za tiste olefine, ki ob protonaciji dajo razmeroma stabilno karbokacijo, to je pri donatorskih substituentih Z.
Za reakcije hidrohalogeniranja, ki potekajo po mehanizmu Ad E 2, je značilna konkurenca med postopki konjugiranega dodajanja in prerazporeditve, saj je karbokacijski ali ionski par tvorjen kot vmesni produkt.

Kot primer preureditve z 1,2-migracijo alkilne skupine in hidridnega iona predstavljamo reakcije hidrohalogeniranja terc-butiletilena oziroma izopropiletilena.

Pri isti reakciji brez topila na mrazu (-78 ° С) nastane zmes 33% normalnih in 67% nenormalnih (preurejenih) adicijskih produktov.

4.3.c. Usmerjenost. Pravilo Markovnikova
V nasprotju s simetričnimi elektrofili (Hal 2) so vodikovi halogenidi asimetrični elektrofilni reagenti. Dodatek kakršnega koli nesimetričnega elektrofila (HBr, ICl, H2O, Hg (OAc) 2 itd.) K nesimetričnemu alkenu bi načeloma lahko pomešal mešanico dveh alternativnih produktov, vendar v praksi običajno nastane le eden od njih. Kot primer razmislite o dodajanju vodikovega bromida propilenu.

Leta 1870 je V.V. Markovnikov je oblikoval pravilo, po katerem so asimetrični alkeni pritrjeni na HX tako, da pretežno nastane produkt, v katerem je vodik pritrjen na najmanj substituiran konec dvojne vezi, X pa na najbolj substituiran konec dvojne vezi.
Običajno pravilo Markovnikova pojasnjujejo z razliko v stabilnosti dveh alternativnih karbokacij. Na primer, v zgornjem primeru je normalno n-propilni kation je veliko manj stabilen kot izopropilni kation, zato reakcija poteka po drugi poti.
Pravilo Markovnikov se je prvotno uporabljalo samo za primere dodajanja HX ogljikovodikovim substratom, načeloma pa ga je mogoče razširiti na reakcije drugih substituiranih alkenov. Dodatek HCl k CF 3 CH \u003d CH 2 daje " anti-markovnik "izdelek CF 3 CH 2 CH 2 Cl. To je pričakovati, saj je kation CF 3 CH + CH 3 zaradi močnega (-I) -učinka CF 3-skupine manj stabilen kot kation CF 3 CH 2 CH 2+ Kation CF 3 CH 2 CH 2+ je pretežno tvorjen, vendar je tudi, čeprav v manjši meri, destabiliziran z induktivnim učinkom skupine CF 3, zaradi česar je dodajanje HCl trifluorometiletilenu veliko počasnejše od dodajanja nesubstituiranega etilena.
Iz podobnega razloga viniltrialkilamonijevi kationi pritrdijo HBr tudi proti Markovnikovemu pravilu:
Dodajanje HX alkenom z močnimi (-I) in (-M) substituenti, na primer akrilonitrilu ali nitroetilenu, bi moralo biti tudi v nasprotju s pravilom Markovnikova. Vendar je v tem primeru dvojna vez tako močno deaktivirana glede na elektrofilne reagente, da te reakcije potekajo le v zelo težkih pogojih. Vinilklorid CH 2 \u003d CHCl vedno daje izključno "adukte Markovnikovega". Na primer, ko reagira s HCl, nastane le 1,1-dikloroetan (geminalni diklorid) CH 3 CHCl 2. Klor ima podobno kot skupina CF 3 močan (-I) -učinek in na prvi pogled se zdi, da bi moral dodatek imeti protimarkovsko usmerjenost, saj bi moral biti kation + CH 2 CH 2 Cl bolj stabilen kot kation CH3CH + Cl. Vendar ima v nasprotju s skupino CF 3 klor poleg (-I) -učinka tudi nasprotni (+ M) -učinek (saj ima osamljene pare). Izkušnje kažejo, da je velikost mezomernega učinka povsem zadostna za znižanje energije 1-kloroetilnega kationa pod raven energije 2-kloroetilnega kationa, pri katerem + M-učinek ni izražen.
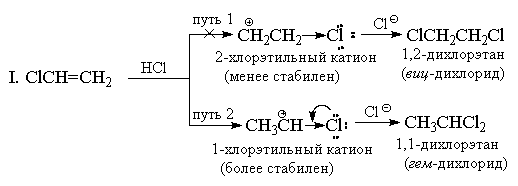
II. S stališča teorije resonance lahko strukturo 1-kloroetilnega kationa predstavimo na naslednji način:
Kljub temu se dodajanje vinil kloridu v enakih pogojih pojavlja počasneje kot etilenu, tj. Glede na celoten učinek (-I\u003e + M) klor ostaja substituent, ki odvaja elektrone v primerjavi z vodikom, 1-kloroetil kation pa je manj stabilen. kot C2H5 +. Drugi vinilhalogenidi reagirajo na podoben način s HX.
Vinil etri CH 2 \u003d CHOR dodajo HX (X \u003d Hal) po Markovnikovem pravilu z veliko večjo hitrostjo kot vsi zgoraj našteti substituirani alkeni. To je posledica pomembnega + M-učinka skupine RO. V nasprotju z atomom klora je RО-skupina po celotnem elektronskem učinku (+ M\u003e -I) močan elektro-donatorski substituent, ki učinkovito stabilizira sosednji karbokacijski center. Strukturo karbokacije lahko v tem primeru predstavimo tudi kot sklop dveh resonančnih struktur
Napad oksonijevega kationa s halogenidnim anionom povzroči nastanek α-haloesterjev tipa CH 3 CH (Hal) OR.
4.3.y. Hidracija alkenov
Kiselinsko katalizirana hidracija alkenov vodi do tvorbe alkoholov. Smer hidracije alkenov določa pravilo Markovnikova, zato se domneva, da v tej reakciji kot vmesni delček nastane karbokacija.
Težnja preurejanja sekundarnih alkilnih karbokacij preprečuje uporabo hidracije alkenov za pridobivanje sekundarnih alkoholov.

Ta metoda v laboratoriju je našla omejeno področje uporabe samo za proizvodnjo terciarnih alkoholov. Hidracijska reakcija je v tem primeru večinoma reverzibilna in terciarni alkoholi nastajajo z nizkimi donosi (40-45%).


Hidracija najpreprostejših alkenov, etilena in propilena, je pomembna industrijska metoda za proizvodnjo etilnega in izopropilnega alkohola.

V laboratorijski praksi neposredna hidracija alkenov ni našla široke uporabe tako zaradi težkih pogojev kot tudi zaradi tvorbe večje količine izomernih alkoholov. Trenutno se za regioselektivno proizvodnjo alkoholov iz alkenov običajno uporablja s tem povezana reakcija hidroksimerkulacije, demerkuracija.
4.3.d. Hidroksimerkurizacija-demerkurizacija
Elektrofilni napad na dvojno vez alkena lahko izvajajo kovinski ioni, med katerimi ima poseben položaj kation živega srebra (II). Živosrebrni acetat v zelo blagih pogojih pri 20 ° C doda alkene v vodnem tetrahidrofuranu (THF) ali vodni ocetni kislini, da tvori organske spojine živega srebra. Dodajanje živega srebra acetata pri dvojni vezi poteka regiospecifično v strogem skladu z pravilom Markovnikova, tj. Kation živega srebra je vezan na najmanj substituiran atom ogljika.
Vez C-Hg v organsko-živosrebrovih spojinah je mogoče enostavno razgraditi z delovanjem natrijevega borohidrida NaBH 4, pri čemer nastane živo srebro in nova komunikacija C-H... Predpostavlja se, da dobimo alkil živosrebrov hidrid kot nestabilen intermediat, ki se še naprej razgrajuje s sproščanjem kovinskega živega srebra po radikalnem mehanizmu.

Ta dvostopenjski postopek hidroksimerkuracije in demerkuracije na koncu predstavlja regiospecifično hidracijo alkena po Markovnikovem pravilu v izredno blagih razmerah, ko je tvorba stranskih produktov zmanjšana na največji možni minimum. To lahko jasno ponazorimo z naslednjimi primeri, pri katerih je skupni izkoristek reakcijskih produktov 90-98%. Dani digitalni podatki v tem primeru ne pomenijo donosov nastalih spojin, temveč njihovo razmerje v zmesi.




Kot je razvidno iz zgornjih primerov, hidroksimerkuizacija in demerkurizacija alkenov v večini primerov zagotavlja regiospecifično hidracijo alkenov s tvorbo praktično le enega od dveh izomernih alkoholov. Upoštevati je treba, da organske žive spojine ni treba ločevati, oba postopka pa je mogoče izvesti neposredno enega za drugim.
Hidroksimerkuizacija nesimetričnih alkenov se očitno začne z napadom kationa AcOHg + in tvorbo nesimetričnega cikličnega kationa mercuriniuma kot vmesnega izdelka (analog asimetričnega halogenonijevega iona), ki se nato odpre kot posledica nukleofilnega napada vode na najbolj substituiran atom ogljika, ki nosi višji pozitivni naboj.

Premostitveni živosrebrni ion lahko pritrdimo v ne-nukleofilni močno kisli medij tudi pri 20 ° C z dodatkom močnejšega elektrofilnega sredstva - živega srebra trifluoroacetata v mešanici fluorosulfonske kisline in antimonovega pentafluorida.

Kation živega srebra lahko razdelimo ne samo z delovanjem vode, temveč tudi z drugimi donorji elektronov: alkoholi, ocetna kislina, acetonitril itd. Končni produkt reakcije bodo v tem primeru etri, acetati ali N-substituirani amidi ocetne kisline, na primer:


Kadar se v reakciji alkoksimerkuracije-demerkuracije uporabljajo razvejani sekundarni ali terciarni alkoholi, sta trifluoroacetat Hg (OCOCF 3) 2 ali živosrebrni triflat Hg (OSO 2 CF 3) 2 učinkovitejša od živega acetata.

Tako je hidroksi- in alkoksimerkuracija-demerkuracija ena najboljših pripravljalnih metod za sintezo alkoholov in etrov z razvejanimi alkilnimi radikali.
Dodajanje soli živega srebra alkenom je najbolj presenetljiv primer konjugiranega dodatka dvojni vezi, kjer topilo deluje kot zunanje nukleofilno sredstvo. Stereokemija postopka dvojne hidroksimerkulacije-demerkuracije je odvisna od stereokemije vsakega posameznega koraka. Za hidroksimerkuizacijo je značilno anti-dodatek, kot pri drugih reakcijah, ki vključujejo ciklični kation. Vendar radikalna demerkuracija ni zelo stereoselektivna. Zato je celoten postopek kot celota tudi nestereospecifičen.
4.3.e. Dodajanje alkenov (kationna dimerizacija in polimerizacija alkenov)
Najbolj zanimiv primer te vrste reakcije je dimerizacija in polimerizacija izobutilena v prisotnosti žveplove kisline.

Tehnično ime te mešanice alkenov je "diizobutilen". Ta reakcija poteka s kationskim mehanizmom, podobno kot mehanizem dodajanja mineralnih kislin dvojni vezi alkenov. V prvi fazi molekuli izobutilena dodamo proton, da nastane razmeroma stabilna vtrite-butilni kation. Nadalje oblikovan vtrite-butilni kation (Lewisova kislina) reagira z molekulo izobutilena (Lewisova baza) in tvori nov stabilen terciarni oktilni kation.

V teh pogojih oktilna karbokacija pod delovanjem baz (H 2 O, HSO 4 - -ions) hitro izgubi proton in se pretvori v mešanico izomernih pentenov, saj se odcep protona odvija iz dveh različnih položajev:

Prevladujoča tvorba termodinamično manj stabilnega alkena, 2,4,4-trimetilpenten-1 (80% v reakcijski zmesi), je posledica večje prostorske dostopnosti metilnih skupin za napad baze, v primerjavi z vodikovimi atomi metilenske skupine. V industriji se "diizobutilen" hidrogenira na Ni-Raneyju in dobi "izooktan" (tehnično ime za 2,2,4-trimetilpentanski ogljikovodik), ki se uporablja kot visokooktansko gorivo za motorje z notranjim zgorevanjem.
Pri visokih koncentracijah žveplove kisline (več kot 80%) pride do kationske polimerizacije izobutilena, da nastane polimer, imenovan poliizobutilen (-CH2C (CH3) 2 -) n. Ta gumijasti polimer se uporablja za pridobivanje protikorozijskih in hidroizolacijskih premazov, tesnilnih mas itd.
S kationskim mehanizmom se poleg izobutilena polimerizirajo tudi 3-metilbuten-1, vinil etri in nekateri derivati \u200b\u200bstirena, ki lahko tvorijo razmeroma stabilne karbokationa. Vodikov fluorid in Lewisove kisline se uporabljajo tudi kot katalizatorji za kationsko polimerizacijo: BF 3, AlCl 3, AlBr 3 itd. V prisotnosti zelo majhnih količin vode.
4.3.j. Dodajanje alkanov (alkilacija alkenov)
Druga industrijska metoda za sintezo "izooktana" temelji na interakciji izobutilena s presežkom izobutana v prisotnosti koncentrirane žveplove kisline ali brezvodnega vodikovega fluorida pri 0 10 0 C.

Ta reakcija poteka tudi s kationskim mehanizmom in, kar je še posebej zanimivo, je primer kationnega verižnega procesa. Najprej se izobutilen v reakcijskih pogojih dimerizira in tvori terciarni oktilni kation (CH 3) 3 CCH 2 C + (CH 3) 2. Mehanizem njegovega nastanka je podrobno opisan v prejšnjem poglavju. Nadalje pride do hitrega prenosa vodika (v obliki hidridnega iona) iz izobutana v oktilni kation z nastankom molekule "izooktana" in novega terc-butilnega kationa, ki nato hitro reagira z izobutilenom, da tvori nov oktilni kation itd.

Poleg sinteze izooktana se ta metoda alkiliranja v petrokemični industriji uporablja za sintezo razvejanih ogljikovodikov z visokimi vrelišči iz razvejanih alkenov in alkanov z nizkim vreliščem iz frakcije termičnega krekinga.
Alkeni so nenasičeni alifatski ogljikovodiki z eno ali več dvojnimi vezmi ogljik-ogljik. Dvojna vez pretvori dva atoma ogljika v ravninsko strukturo z koti vezi med sosednjima vezema pri 120 ° C:
Homologna vrsta alkenov ima splošno formulo; prva dva člana sta eten (etilen) in propen (propilen):

Člani serije alkenov s štirimi ali več atomi ogljika kažejo izomerijo položaja vezi. Na primer, alken s formulo ima tri izomere, od katerih sta dva izomera položaja vezi:
Upoštevajte, da je alkenska veriga oštevilčena s tega konca, ki je bližje dvojni vezi. Položaj dvojne vezi označuje spodnje od obeh števil, ki ustrezata dvema ogljikovima atomoma, vezanima z dvojno vezjo. Tretji izomer ima razvejano strukturo:

Število izomerov katerega koli alkena se povečuje s številom atomov ogljika. Na primer, heksen ima tri izomere položaja vezi:
dienes je buta-1,3-dien ali samo butadien:
Spojine, ki vsebujejo tri dvojne vezi, se imenujejo trieni. Spojine z več dvojnimi vezmi se skupaj imenujejo polieni.
Fizične lastnosti
Alkeni imajo tališča in vrelišča nekoliko nižje kot njihovi alkani. Na primer, pentan ima vrelišče. Izomeri etilena, propena in treh butenov so plinasti pri sobni temperaturi in normalnem tlaku. Alkeni s številom atomov ogljika od 5 do 15 so v normalnih pogojih v tekočem stanju. Njihova hlapnost, tako kot pri alkanih, narašča s prisotnostjo razvejanosti v ogljikovi verigi. Alkeni z več kot 15 ogljikovimi atomi so v normalnih pogojih trdne snovi.
Pridobivanje v laboratorijskih pogojih
Dve glavni metodi za pripravo alkenov v laboratoriju sta dehidracija alkoholov in dehidrohalogeniranje haloalkanov. Na primer, etilen lahko dobimo z dehidracijo etanola z delovanjem presežka koncentrirane žveplove kisline pri temperaturi 170 ° C (glej oddelek 19.2):
Etilen lahko dobimo tudi iz etanola s prehajanjem hlapov etanola po površini segretega glinice. V ta namen lahko uporabite shematsko namestitev, prikazano na sl. 18.3.
Druga razširjena metoda za pridobivanje alkenov temelji na dehidrohalogeniranju haloalkanov v osnovnih pogojih katalize.
Mehanizem te vrste reakcije izločanja je opisan v odd. 17.3.
Alkenske reakcije
Alkeni imajo veliko več reaktivnostkot alkani. To je posledica sposobnosti elektronov z dvojno vezjo, da privlačijo elektrofile (glej oddelek 17.3). Zato so značilne reakcije alkenov predvsem reakcije elektrofilnega dodajanja pri dvojni vezi:

Mnoge od teh reakcij imajo ionske mehanizme (glejte poglavje 17.3).
Hidrogeniranje
Če kateri koli alken, na primer etilen, zmešamo z vodikom in to zmes speljemo po površini platinskega katalizatorja pri sobni temperaturi ali nikljevega katalizatorja pri temperaturi približno 150 ° C, potem pride do dodatka
vodik na dvojni vezi alkena. Ta tvori ustrezni alkan:

Ta vrsta reakcije je primer heterogene katalize. Njegov mehanizem je opisan v odd. 9.2 in shematsko prikazano na sl. 9.20.
Pritrditev halogenov
Klor ali brom sta zlahka pritrjena na alkenski dvojni vezi; ta reakcija poteka v nepolarnih topilih, kot sta tetraklorometan ali heksan. Reakcija poteka z ionskim mehanizmom, ki vključuje tvorbo karbokacije. Dvojna vez polarizira molekulo halogena in jo spremeni v dipol:

Zato raztopina broma v heksanu ali tetraklorometanu ob tresenju z alkenom postane obarvana. Enako se zgodi, če alken stresamo z bromovo vodo. Bromova voda je raztopina broma v vodi. Ta raztopina vsebuje hipobromno kislino. Molekula hipobromne kisline se veže na dvojno vez alkena in rezultat je bromo alkohol. na primer

Povezava vodikovih halogenidov
Ta reakcijski mehanizem je opisan v odd. 18.3. Kot primer razmislite o dodajanju klorovodika k propenu:
Upoštevajte, da je produkt te reakcije 2-kloropropan in ne 1-kloropropan:
![]()
Pri takih reakcijah dodajanja je na atom ogljika, na katerega je vezan, vedno vezan najbolj elektronegativni atom ali najbolj elektronegativna skupina
najmanjše število atomov vodika. Ta vzorec se imenuje pravilo Markovnikov.
Prednostna vezava elektronegativnega atoma ali skupine na atom ogljika, vezanega na najmanjše število atomov vodika, je posledica povečanja stabilnosti karbokacije, ko se poveča število alkilnih substituentov na ogljiku. To povečanje stabilnosti pa je razloženo z induktivnim učinkom, ki nastane v alkilnih skupinah, saj so dajalci elektronov:

V prisotnosti organskega peroksida propen reagira z vodikovim bromidom in se tvori, torej ne v skladu z pravilom Markovnikove Tak izdelek se imenuje anti-Markovnikov. Nastane kot posledica radikalne reakcije, ne ionskega mehanizma.
Hidracija
Alkeni reagirajo s hladno koncentrirano žveplovo kislino in tvorijo alkil hidrogen sulfate. na primer

Ta reakcija je dodatek, saj vključuje dodajanje kisline z dvojno vezjo. To je obratna reakcija na dehidracijo etanola, da nastane etilen. Mehanizem te reakcije je podoben mehanizmu dodajanja vodikovih halogenidov pri dvojni vezi. Vključuje nastanek vmesnega karbokationa. Če produkt te reakcije razredčimo z vodo in previdno segrejemo, hidrolizira, da nastane etanol:
Reakcija dodajanja žveplove kisline alkenom upošteva pravilo Markovnikova:

Reakcija z nakisano raztopino kalijevega permanganata
Vijolična barva kisle raztopine kalijevega permanganata izgine, če jo raztopimo v mešanici s katerim koli alkenom. Alken je hidroksiliran (vnos hidroksi skupine, ki nastane kot posledica oksidacije), ki se pretvori v diol. Na primer, ko odvečno količino etilena stresamo z nakisano raztopino, nastane etan-1,2-diol (etilen glikol)

Če alken stresamo s prekomerno količino raztopine β-ionov, oksidativna razgradnja alken, kar vodi do tvorbe aldehidov in ketonov:
Nastali aldehidi so podvrženi nadaljnji oksidaciji in tvorijo karboksilne kisline.
Hidroksilacija alkenov, da tvorijo diole, lahko izvedemo tudi z uporabo alkalna raztopina kalijev permanganat.
Reakcija s perbenzojsko kislino
Alkeni reagirajo s peroksikislinami (peracidi), kot je perbenzojska kislina, in tvorijo ciklične etre (epoksi spojine). na primer

Ko epoksietan previdno segrejemo z razredčeno raztopino kisline, nastane etan-1,2-diol:

Reakcije s kisikom
Tako kot vsi drugi ogljikovodiki tudi alkeni gorijo in z obilnim dostopom zraka tvorijo ogljikov dioksid in vodo:
Z omejenim dostopom zraka zgorevanje alkenov povzroči nastanek ogljikovega monoksida in vode:
Ker imajo alkeni višjo relativno vsebnost ogljika kot ustrezni alkani, sežgejo in tvorijo bolj dimljen plamen. To je posledica tvorbe ogljikovih delcev:
Če zmešate alken s kisikom in to zmes spustite po površini srebrnega katalizatorja, pri temperaturi približno 200 ° C nastane epoksietan:
Ozonoliza
Ko plinasti ozon prepustimo skozi raztopino alkena v triklorometanu ali tetraklorometanu pri temperaturah pod 20 ° C, nastane ozonid ustreznega alkena (oksirana)

Ozonidi so nestabilne spojine in so lahko eksplozivni. Hidrolizirajo se, da nastanejo aldehidi ali ketoni. na primer

V tem primeru del metanala (formaldehid) reagira z vodikovim peroksidom in tvori metansko (mravljično) kislino:
Polimerizacija
Najenostavnejši alkeni se lahko polimerizirajo in tvorijo spojine z visoko molekulsko maso, ki imajo enako empirično formulo kot prvotni alken:
Ta reakcija poteka pri visokem tlaku, 120 ° C in v prisotnosti kisika, ki deluje kot katalizator. Polimerizacijo etilena pa lahko izvedemo pri nižjih tlakih z uporabo Zieglerjevega katalizatorja. Eden najpogostejših Zieglerjevih katalizatorjev je mešanica trietilaluminija in titanovega tetraklorida.
Polimerizacija alkenov je podrobneje obravnavana v odd. 18.3.








