Aromatické uhľovodíky sú typmi izomerizmu. Arény
Benzén a jeho najbližšie homológy sú bezfarebné kvapaliny so špecifickým zápachom. Aromatické uhľovodíky sú ľahšie ako voda a nerozpúšťajú sa v nej, ľahko sa však rozpúšťajú v organických rozpúšťadlách - alkohole, éteri, acetóne.
Benzén a jeho homológy sú samy o sebe dobrým rozpúšťadlom pre mnoho organických látok. Všetky arény horia dymovým plameňom kvôli vysoký obsah uhlík v ich molekulách.
Fyzikálne vlastnosti niektorých arén sú uvedené v tabuľke.
Tabuľka. Fyzikálne vlastnosti niektorých arén
|
názov |
Vzorec |
t ° .pl., |
t. var., |
|
Benzén |
C 6 H 6 |
5,5 |
80,1 |
|
Toluén (metylbenzén) |
C6H5CH3 |
95,0 |
110,6 |
|
Etylbenzén |
C 6 H 5 C 2 H 5 |
95,0 |
136,2 |
|
Xylén (dimetylbenzén) |
C6H4 (CH3) 2 |
||
|
orto- |
25,18 |
144,41 |
|
|
meta- |
47,87 |
139,10 |
|
|
pár- |
13,26 |
138,35 |
|
|
Propylbenzén |
C6H5 (CH2) 2CH3 |
99,0 |
159,20 |
|
Kumén (izopropylbenzén) |
C6H5CH (CH3) 2 |
96,0 |
152,39 |
|
Styrén (vinylbenzén) |
C6H5CH \u003d CH2 |
30,6 |
145,2 |
Benzén - nízkovriace ( t balík\u003d 80,1 ° C), bezfarebná kvapalina, nerozpustná vo vode
Pozor! Benzén - jed, pôsobí na obličky, mení krvný vzorec (pri dlhodobej expozícii), môže narušiť štruktúru chromozómov.
Väčšina aromatických uhľovodíkov je život ohrozujúcich a toxických.
Získavanie arénov (benzén a jeho homológy)
V laboratóriu
1. Fúzia solí kyseliny benzoovej s tuhými zásadami
C6H5-COONa + NaOH t →C6H6 + Na2C03
benzoát sodný
2. Würz-Fittingova reakcia: (tu G je halogén)
C 6H 5 -G + 2Na + R-G →C. 6 H 5 - R + 2 NaD
ZO 6 H5-Cl + 2Na + CH3-Cl → C6H5-CH3 + 2NaCl
V priemysle
- izolovaný z ropy a uhlia frakčnou destiláciou, reformovaním;
- z uhoľného dechtu a koksárenského plynu
1. Dehydrocyklizácia alkánov s viac ako 6 atómami uhlíka:
C 6 H 14 t , kat→ C6H6 + 4H2
2. Orezávanie acetylénom (iba pre benzén) - r. Zelinsky:
3C 2 H 2 600 ° C. , Zák. uhlie → C6H6
3. Dehydrogenácia cyklohexán a jeho homológy:
Sovietsky akademik Nikolaj Dmitrijevič Zelinský uviedol, že benzén vzniká z cyklohexánu (dehydrogenácia cykloalkánov)
C 6 H 12 t, kat→ C6H6 + 3H2

C6Hn-CH3 t , kat→ C6H5-CH3 + 3H2
metylcyklohexantoluén
4. Alkylácia benzénu (získanie homológov benzénu) - p Friedel-Crafts.
C6H6 + C2H5-Cl t, AlCl3→ C6H5-C2H5 + HCl
chlóretán etylbenzén

Chemické vlastnosti arénov
Ja... OXIDAČNÉ REAKCIE
1. Spaľovanie (dymový plameň):
2C6H6 + 15O2 t → 12CO 2 + 6 H 2 O + Q
2. Benzén za normálnych podmienok nezmenil farbu brómovej vody a vodného roztoku manganistanu draselného
3. Homológy benzénu sa oxidujú manganistanom draselným (odfarbujú manganistan draselný):
A) v kyslé prostredie na kyselinu benzoovú
Pôsobením manganistanu draselného a iných silných oxidantov na homológy benzénu dochádza k oxidácii bočných reťazcov. Bez ohľadu na to, aký zložitý je reťazec substituenta, je zničený, s výnimkou atómu a-uhlíka, ktorý sa oxiduje na karboxylovú skupinu.
Homológy benzénu s jedným bočným reťazcom poskytujú kyselinu benzoovú:
Homológy obsahujúce dva bočné reťazce poskytujú kyseliny dvojsýtne:
5C 6 H 5-C 2 H 5 + 12 KMnO 4 + 18 H 2 SO 4 → 5 C 6 H 5 COOH + 5 CO 2 + 6 K 2 SO 4 + 12 MnSO 4 + 28 H 2 O
5C 6 H 5-CH 3 + 6 KMnO 4 + 9 H 2 SO 4 → 5 C 6 H 5 COOH + 3 K 2 SO 4 + 6 MnSO 4 + 14 H 2 O
Zjednodušené :
C6H5-CH3 + 3O KMnO4→ C6H5COOH + H20
B) v neutrálnych a mierne zásaditých až soliach s kyselinou benzoovou
C6H5-CH3 + 2KMnO4 → C6H5COOК + K ОН + 2MnO 2 + H 2 O
II... DODATOČNÉ REAKCIE (tvrdšie ako alkény)
1. Halogenácia
C6H6 + 3CI2 h ν → C6H6CI6 (hexachlórcyklohexán - hexachlór)
2. Hydrogenácia
C6H6 + 3H2 t , Pt alebo Ni → C6H12 (cyklohexán)
3. Polymerizácia
III. NÁHRADNÉ REAKCIE - iónový mechanizmus (ľahší ako alkány)
b) homológy benzénu po ožiarení alebo zahriatí
Z hľadiska chemických vlastností sú alkylové radikály podobné alkánom. Atómy vodíka v nich sú nahradené halogénom mechanizmom voľných radikálov. Preto v neprítomnosti katalyzátora pri zahrievaní alebo ožarovaní ultrafialovým žiarením dochádza v bočnom reťazci k radikálnej substitučnej reakcii. Účinok benzénového kruhu na alkylové substituenty vedie k tomu, že atóm vodíka na atóme uhlíka priamo viazaný na benzénový kruh (atóm a-uhlíka) je vždy nahradený.
1) C6H5-CH3 + Cl2 h ν → C6H5-CH2-Cl + HCl
c) homológy benzénu v prítomnosti katalyzátora
C6H5-CH3 + Cl2 AlCl 3 → (zmes ORL, pár derivátov) + HCl
2. Nitrácia (kyselinou dusičnou)
C6H6 + HO-NO2 t, H2SO4→ C6H5-N02 + H20
nitrobenzén - vôňa mandle!
C6H5-CH3 + 3HO-N02 t, H2SO4→ ZO H3-C6H2 (N02) 3 + 3H202,4,6-trinitrotoluén (tol, TNT)
Použitie benzénu a jeho homológov
Benzén C6H6 je dobré rozpúšťadlo. Benzén ako prísada zlepšuje kvalitu motorového paliva. Slúži ako surovina na výrobu mnohých aromatických organických zlúčenín - nitrobenzén C 6 H 5 NO 2 (rozpúšťadlo, získava sa z neho anilín), chlórbenzén C 6 H 5 Cl, fenol C 6 H 5 OH, styrén atď.
Toluén C6H5-CH3 je rozpúšťadlo používané na výrobu farieb, liečiv a výbušnín (TNT (tol) alebo 2,4,6-trinitrotoluén TNT).
XylényC6H4 (CH3) 2. Technický xylén je zmesou troch izomérov ( orto-, meta- a pár-xylény) - sa používa ako rozpúšťadlo a východiskový produkt pre syntézu mnohých organických zlúčenín.
Izopropylbenzén C6H5-CH (CH3) 2 sa použije na získanie fenolu a acetónu.
Chlórové deriváty benzénu používané na ochranu rastlín. Produkt substitúcie atómov H v benzéne atómami chlóru je teda hexachlórbenzén С 6 Сl 6 - fungicíd; používa sa na suché opracovanie semien pšenice a raže proti tvrdej plesni. Produktom pridania chlóru k benzénu je hexachlórcyklohexán (hexachlór) С 6 Н 6 Сl 6 - insekticíd; používa sa na boj škodlivý hmyz... Uvedené látky sú pesticídy - chemické prostriedky na boj proti mikroorganizmom, rastlinám a zvieratám.
Styrén C6H5-CH \u003d CH2 polymerizuje veľmi ľahko, vytvára polystyrén a kopolymerizuje s butadién-styrén-butadiénovými gumami.
VIDEO SKÚSENOSTI
Aromatické uhľovodíky (arény) - uhľovodíky, ktorých molekuly obsahujú jeden alebo viac benzénových kruhov. Zloženie arénov s jedným benzénovým kruhom zodpovedá všeobecnému vzorcu C. n H 2n-6 .
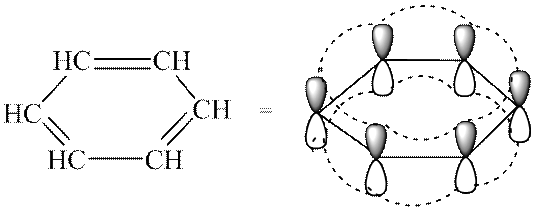
V molekule najjednoduchšej väzby arén - benzén (C6H6) - - tvoria jediný delokalizovaný konjugovaný (aromatický) systém - väzieb.
Štruktúru molekuly najjednoduchšieho arénu - benzénu - možno odvodiť pomocou štruktúrnych vzorcov rôznych typov:
Izoméry a homológy
| r | benzén |
|||||
metylbenzén (toluén) |
||||||
etylbenzén |
1,2-dimetylbenzén ( orto-xylén) |
1,3-dimetylbenzén ( meta-xylén) |
1,4-dimetylbenzén ( pár-xylén) |
|||
propylbenzén |
izopropylbenzén |
1,2,4-tri-metylbenzén |
L-metyl-2-etylbenzén |
L-metyl-3-etylbenzén |
L-metyl-4-etylbenzén |
|
| vEĽKOSŤ | ||||||
Názov substituovaného benzénového derivátu je založený na slove „benzén“. Atómy v benzénovom kruhu sú číslované od najvyššieho substituenta po najnižší. Príklad: 1-metyl-2-etylbenzén, nie 1-etyl-2-metylbenzén. Ak sú substituenty rovnaké, číslovanie sa uskutoční podľa krátka cesta... Príklad: 1,3-dimetylbenzén, nie 1,5-dimetylbenzén.
Predpony orto-, meta-, pár- (z gréckeho orthos - priamy, meta - po, cez, medzi, pár - proti, blízky, minulý) v názvoch organických látok (skrátene: o-, m-, p-) sa používajú na označenie relatívnej polohy dvoch substituentov na benzénovom kruhu.
Fyzikálne vlastnosti benzénu: bezfarebná vo vode nerozpustná kvapalina so zvláštnym zápachom, teplota topenia 5,4 ° C, teplota varu 80,1 ° C, hustota 0,88 g / cm3. Výpary benzénu sú jedovaté.
Benzén za normálnych podmienok nezmení farbu brómovej vody a roztoku manganistanu draselného.
Získavam arény
Úlohy a testy na tému „Téma 3.„ Aromatické uhľovodíky “.
- Uhľovodíky. Polyméry - Organické látky triedy 8-9
Lekcie: 7 Zadania: 9 Testy: 1
- - Človek vo svete látok, materiálov a chemické reakcie Stupeň 8-9
Lekcie: 2 úlohy: 6 testy: 1
- Klasifikácia látok - Triedy anorganických látok triedy 8-9
Lekcie: 2 úlohy: 9 testy: 1
- Kryštalické mriežky - Štruktúra hmoty triedy 8-9
Lekcie: 1 Zadania: 9 Testy: 1
- Zloženie roztokov - Riešenia triedy 8-9
Lekcie: 3 úlohy: 8 testy: 1
Po preštudovaní témy by ste mali: ovládať pojmy aromatické uhľovodíky, aromatické väzby, poznať všeobecný vzorec arénov, pravidlá nomenklatúry, typy substitučných reakcií (halogenácia v prítomnosti katalyzátora, nitrácia), adícia (halogenácia vo svetle , hydrogenácia).
Skontrolujte, či viete, ako robiť výpočty pomocou reakčných rovníc a odvodiť molekulárne vzorce látok podľa hmotnostných zlomkov prvkov, zistiť výťažok reakčného produktu a vyriešiť problémy so zohľadnením hmotnostného podielu nečistôt.
Príklad 1. Uhľovodík s hustotou pár 15 pre vodík obsahuje 80% uhlíka. Nájdite jeho molekulárny vzorec.
Odpoveď: C 2 H 6
Príklad 2. Zo 7,8 g benzénu sa získalo 8,61 g nitrobenzénu. Určte výťažok reakčného produktu.
Odpoveď: 70%
Príklad 3. Technický karbid vápenatý s hmotnosťou 20 g sa spracuje prebytočnou vodou. Aký objem acetylénu sa získal, ak hmotnostný podiel nečistôt v technickom karbide bol 20%.
Odpoveď: 5,6 l
Potom, čo sa ubezpečíte, že ste sa naučili všetko, čo potrebujete, prejdite k úlohám k danej téme. Prajeme vám veľa úspechov.
Odporúčané čítanie:
- OS Gabrielyan a ďalší. Chémia 10 buniek. M., drop, 2002;
- L. S. Guzei, R. P. Surovtseva, G. G. Lysova. Chémia 11 cl. Drop, 1999.
- G. G. Lysovej. Poznámky a testy k podpore organická chémia... M., LLC „Glik plus“, 1999.
ARENES
Aromatické uhľovodíky (arény) - cyklické uhľovodíky spojené pojmom aromatickosti, ktorý určuje spoločné znaky v štruktúre a chemických vlastnostiach.
Klasifikácia
Podľa počtu benzénových kruhov v molekule arénu na:
mononukleárne
viacjadrové

Nomenklatúra a izoméria
Štruktúrny základ benzénových uhľovodíkov je benzén C6H6z ktorých sú konštruované systematické názvy homológov.
Pre monocyklické zlúčeniny sa zachovajú tieto nesystematické (triviálne) názvy:

Pozícia substituentov je označená najmenšími číslicami (smer číslovania nezáleží),
|
|
|
a pre disubstituované zlúčeniny označenie orto, meta, pár.
|
|
|
|
Ak sú v kruhu tri substituenty, tony by mali dostať najmenšie čísla, t.j. riadok „1,2,4“ má prednosť pred „1,3,4“.


1,2-dimetyl-4-etylbenzén (správny názov) 3,4-dimetyl-1-etylbenzén (nesprávny)
Izoméria monosubstituovaných arénov je spôsobená štruktúrou uhlíkového skeletu substituenta; v di- a polysubstituovaných benzénových homológoch sa pridáva izoméria spôsobená rozdielnym usporiadaním substituentov v jadre.
Izoméria aromatických uhľovodíkov so zložením C 9 H 12:
|
|
|
|
|
Fyzikálne vlastnosti
Teplota varu a teploty topenia arénov je vyššia ako v prípade alkánov, alkénov, alkínov, nízkej polarity, nerozpustných vo vode a ľahko rozpustných v nepolárnych organických rozpúšťadlách. Arény sú kvapaliny alebo pevné látky so špecifickým zápachom. Benzén a mnoho kondenzovaných arén sú toxické, z ktorých niektoré majú karcinogénne vlastnosti. Medziprodukty oxidácie kondenzovaných arénov v tele sú epoxidy, ktoré buď priamo spôsobujú rakovinu, alebo sú prekurzormi karcinogénov.
Získavam arény
Mnoho aromatických uhľovodíkov má veľký praktický význam a vyrába sa vo veľkom priemyselnom meradle. Mnoho priemyselných metód je založených na spracovaní uhlia a ropy.
Olej pozostáva hlavne z alifatických a alicyklických uhľovodíkov; pre premenu alifatických alebo acyklických uhľovodíkov na aromatické uhľovodíky boli vyvinuté metódy aromatizácie oleja, ktorých chemické základy vyvinul N.D. Zelinský, B.A. Kazansky.
1. Cyklizácia a dehydrogenácia:
2. Hydrodesmetylácia:

3. Homológy benzénu sa získajú alkyláciou alebo acyláciou s následnou redukciou karbonylovej skupiny.
a) Friedel-Craftsova alkylácia:

b) Friedel-Craftsova acylácia:

4. Získanie bifenylu reakciou Würz-Fitting:
5. Získanie difenylmetánu Friedel-Craftsovou reakciou:
Štruktúra a chemické vlastnosti.
Kritériá aromatickosti:
Na základe teoretických výpočtov a experimentálneho štúdia cyklických konjugovaných systémov sa zistilo, že zlúčenina je aromatická, ak má:
- Plochý cyklický σ-skelet;
- Konjugovaný uzavretý π-elektrónový systém, ktorý zahŕňa všetky atómy cyklu a obsahuje 4n + 2, kde n \u003d 0, 1, 2, 3 atď. Táto formulácia je známa ako hückelova vláda.Kritériá aromaticity umožňujú odlíšiť konjugované aromatické systémy od všetkých ostatných. Benzén obsahuje sextet π-elektrónov a zodpovedá Hückelovmu pravidlu pre n \u003d 1.
Čo dáva arómu:
Napriek vysokému stupňu nenasýtenia sú aromatické zlúčeniny rezistentné voči oxidačným látkam a teplote, sú náchylnejšie na podstúpenie substitučných reakcií než na pridanie. Tieto zlúčeniny majú zvýšenú termodynamickú stabilitu, ktorú poskytuje vysoká konjugačná energia kruhového aromatického systému (150 kJ / mol); preto je vhodnejšie vstúpiť do substitučných reakcií s arénmi, v dôsledku čoho sa zachováva aromatičnosť.
Mechanizmus elektrofilných substitučných reakcií v aromatickom kruhu:
Elektrónová hustota π-konjugovaného systému benzénového kruhu je vhodným cieľom útoku elektrofilnými činidlami.
Typicky sa elektrofilné činidlá generujú počas reakcie pomocou katalyzátorov a vhodných podmienok.
E - Y → E δ + - Y δ - → E + + Y -
Tvorba π-komplexu.Počiatočný útok elektrofilu π-elektrónového mraku kruhu vedie ku koordinácii činidla s π-systémom a k vytvoreniu komplexu typu donor-akceptor tzv. π-komplex.Aromatický systém nie je narušený:

Tvorba σ-komplexu. Obmedzujúci stupeň, v ktorom elektrofil vytvára kovalentnú väzbu s atómom uhlíka v dôsledku dvoch elektrónov π-systému kruhu, ktorý je sprevádzaný prechodom tohto atómu uhlíka z sp 2 -v sp 3 -hybridnom stave a aromatickom narušení, sa molekula prevedie na karbokáciu.

Stabilizácia σ-komplexu. Uskutočňuje sa to štiepením protónu z σ-komplexu s bázou. V tomto prípade je uzavretý π-systém kruhu obnovený v dôsledku dvoch elektrónov rozbíjajúcej sa kovalentnej väzby C - H, t.j. molekula sa vráti do aromatického stavu:

Vplyv poslancov na reaktivita a orientácia elektrofilnej substitúcie
Substituenty v benzénovom kruhu narúšajú rovnomernosť distribúcie π- elektrónový mrak kruhu a tým ovplyvňujú reaktivitu kruhu.
- Substituenty darujúce elektrón (D) zvyšujú elektrónovú hustotu kruhu a zvyšujú rýchlosť elektrofilnej substitúcie, také substituenty sa nazývajú aktivačný.
- Substituenty (A) priťahujúce elektróny znižujú elektrónovú hustotu kruhu a znižujú sa rýchlostná reakciasa volajú dekontaminácia.
1. Klasifikácia aromatických uhľovodíkov.
2. Homologická séria monocyklických arénov, názvoslovie, príprava.
3. Izoméria, štruktúra benzénu a jeho homológy.
4. Vlastnosti arén.
Arény sú cyklické uhľovodíky bohaté na uhlík, ktoré obsahujú v molekule benzénové jadro a majú špeciálne fyzikálne a chemické vlastnosti. Podľa počtu benzénových kruhov v molekule a spôsobu spojenia kruhov sa arény ďalej delia na monocyklické (benzén a jeho homológy) a polycyklické (s kondenzovanými a izolovanými kruhmi) zlúčeniny.
Arény benzénovej série možno považovať za produkty nahradenia atómov vodíka v molekule benzénu alkylovými radikálmi. Všeobecný vzorec takýchto arénov СnH 2 n- 6. Názov radikálu a cyklu (benzén) je uvedený v názve monosubstituovaných arénov:
benzénmetylbenzén (toluén) etylbenzén.
Vo viac substituovaných arénoch je poloha radikálov označená najmenšími číslami, v disubstituovaných arénoch sa pozícia radikálov nazýva: 1,2 - orto ( o-) -, 1,3 - meta ( m-) - a 1,4 - pár ( p-)-:

1,3-dimetylbenzén 1,2-metyletylbenzén
m-dimetylbenzén ( m-xylén) o-metyletylbenzén ( o-xylén)
Pre arény sú rozšírené triviálne názvy (niektoré názvy sú uvedené v zátvorkách).
Byť v prírode.
Aromatické uhľovodíky sa nachádzajú v rastlinných živiciach a balzamoch. Fenantrén v čiastočne alebo úplne hydrogenovanej forme je obsiahnutý v štruktúrach mnohých prírodných zlúčenín, napríklad steroidov, alkaloidov.
Získavanie arén:
1. suchá destilácia uhlia;
2. dehydrogenácia cykloalkánov

3.dehydrocyklizácia alkánov so 6 alebo viac atómami uhlíka v kompozícii
4. alkylácia

![]()
Izoméria.Pre benzénové homológy je charakteristická štruktúrna izoméria: odlišné štruktúry uhlíkového skeletu bočného radikálu a odlišné zloženie a usporiadanie radikálov v benzénovom kruhu. Napríklad izoméry aromatických uhľovodíkov s kompozíciou C 9H 12 (propylbenzén, izopropylbenzén, o-metyletylbenzén a 1,2,4-trimetylbenzén):
Štruktúra.Aromatické uhľovodíky majú v elektronickej štruktúre molekúl celý rad znakov.
Štruktúrny vzorec benzénu ako prvý navrhol A. Kekule. Je to šesťčlenný cyklus so striedajúcimi sa dvojitými a jednoduchými väzbami, pričom dvojité väzby sa pohybujú v štruktúre:
![]()
V obidvoch vzorcoch je uhlík štvormocný, všetky atómy uhlíka sú ekvivalentné a disubstituovaný benzén existuje ako tri izoméry ( orto-, meta-, pár-). Táto štruktúra benzénu však bola v rozpore s jeho vlastnosťami: benzén nevstupoval do adičných reakcií (napríklad na bróm) a do oxidácie (napríklad s manganistanom draselným), ktorá je charakteristická pre nenasýtené uhľovodíky; pre ňu a jej homológy predstavuje hlavný typ chemickej látky. transformácia sú substitučné reakcie.
Moderný prístup k popisu elektronickej štruktúry benzénu tento rozpor rieši nasledovne. Atómy uhlíka v molekule benzénu sú v sp2-hybridizácii. Každý z atómov uhlíka vytvára tri kovalentné σ-väzby - 2 väzby so susednými atómami uhlíka (sp 2-sp 2 prekrývajúce sa orbitaly) a jeden s atómom vodíka (sp 2-s prekrývajúcimi sa orbitaly). Nehybridizované p-orbitály v dôsledku bočného prekrytia tvoria systém konjugovaný s n-elektrónom (π, π-konjugácia) obsahujúci šesť elektrónov. Benzén je plochý pravidelný šesťuholník s dĺžkou väzby uhlík-uhlík 0,14 nm, väzbou uhlík-vodík 0,11 nm, uhlami väzby 120 0:

Molekula benzénu je stabilnejšia ako cyklické zlúčeniny s izolovanými dvojitými väzbami; preto je benzén a jeho homológy náchylné na substitučné reakcie (benzénový kruh je zachovaný), a nie na adíciu a oxidáciu.
Ostatné cyklické zlúčeniny tiež vykazujú podobnosť v štruktúre a vlastnostiach (aromatickosti) s benzénom. Kritériá aromatickosti (E. Hückel, 1931):
a) plochá cyklická štruktúra, t.j. atómy tvoriace cyklus sú v sp2-hybridizácii; b) spojený elektronický systém; c) počet elektrónov (N) v kruhu je 4n + 2, kde n je akákoľvek celočíselná hodnota - 0,1,2,3 atď.
Kritériá aromatickosti sa vzťahujú na neutrálne aj nabité cyklické konjugované zlúčeniny, takže aromatické zlúčeniny budú napríklad:
furánový katión cyklopropenylu.
Pre benzén a iné aromatické zlúčeniny sú najbežnejšie reakcie substitúcie atómov vodíka na atómoch uhlíka v kruhu a menej typické sú adičné reakcie na π-väzbe v cykle.
Fyzikálne vlastnosti.
Benzén a jeho homológy sú bezfarebné kvapaliny a kryštalické látky so zvláštnym zápachom. Sú ľahšie ako voda a zle sa v nich rozpúšťajú. Nepolárny benzén (μ \u003d 0), alkylbenzény -
polárne zlúčeniny (μ ≠ 0).
Chemické vlastnosti.
Elektrofilná substitúcia.Najcharakteristickejšou transformáciou pre arény je elektrofilná substitúcia - S E. Reakcia prebieha v dvoch fázach s tvorbou medziproduktu σ-komplexu:
Reakčné podmienky: teplota 60 - 80 0 ° C, katalyzátory - levé alebo minerálne kyseliny.
Typické S E - reakcie:
a) halogenácia(Cl2, Br2):
b) nitrácia:
v) sulfonácia(H2SO4, SO3, oleum) :
d) Friedel-Craftsova alkylácia (1877)(RHal, ROH, alkény) :
e) Friedel-Craftsova alkylácia(halogenidy, anhydridy karboxylové kyseliny):
V benzénových homológoch je v dôsledku vplyvu bočného radikálu (+ I-efekt, donorová skupina elektrónov) hustota π-elektrónov benzénového kruhu nerovnomerne rozložená, zvyšuje sa v polohách 2,4,6. Preto SE-reakcie prebiehajú smerovo (v 2,4,6- alebo o-a p-ustanovenia). Homológy benzénu vykazujú v porovnaní s benzénom vyššiu reaktivitu pri reakciách tohto typu.
toluén p-chlórtoluén o-chlórtoluén
Vedľajšie radikálne reakcie v alkylbenzénoch (radikálna substitúcia -S R a oxidácia).
Reakcie radikálnej substitúcie prebiehajú, rovnako ako v prípade nasýtených uhľovodíkov, reťazovým mechanizmom a zahŕňajú fázy iniciácie, rastu a ukončenia reťazca. Chloračná reakcia prebieha neusmernene, bromačná reakcia je regioselektívna - k nahradeniu vodíka dochádza na atóme a-uhlíka.
V alkylbenzénoch sa bočný reťazec oxiduje manganistanom draselným, dichrómanom draselným za vzniku karboxylových kyselín. Bez ohľadu na dĺžku bočného reťazca je atóm uhlíka viazaný na benzénový kruh (atóm α-uhlíka alebo benzyl uhlíka) oxidovaný, zvyšok atómov uhlíka je oxidovaný na C02 alebo karboxylové kyseliny.
kyselina etylbenzénbenzoová
p-metyletylbenzén-tereftalová kyselina
Reakcie benzénu s narušením aromatického systému.
Aromatické uhľovodíky majú silný cyklus, preto reakcie s narušením aromatického systému (oxidácia, pridanie radikálu) prebiehajú za drsných podmienok ( vysoké teploty, silné oxidanty).
a) radikálne doplnenie:
1. hydrogenácia
![]()
toluéncyklohexán
2. chlorácia

benzén 1,2,3,4,5,6-hexachlórcyklohexán (hexachlór).
Produktom tejto reakcie je zmes priestorových izomérov.
Orientácia elektrofilnej substitúcie v aromatických zlúčeninách.Substituenty v benzénovom kruhu sú rozdelené do dvoch typov podľa ich orientačného vplyvu: orto-, pár-orientanty (substituenty 1. druhu) a meta-orientanty (substituenty 2. druhu).
Substituenty prvého druhu sú skupiny poskytujúce elektróny, ktoré zvyšujú elektrónovú hustotu kruhu, zvyšujú rýchlosť elektrofilnej substitučnej reakcie a aktivujú benzénový kruh v týchto reakciách:
D (+ I-efekt): - R, -CH20H, -CH2NH2 atď.
D (-I, + M-efekty): -NH2, -OH, -OR, -NR2, -SH atď.
Substituenty druhého druhu sú skupiny priťahujúce elektróny, ktoré znižujú elektrónovú hustotu kruhu, znižujú rýchlosť elektrofilnej substitučnej reakcie a deaktivujú benzénový kruh v týchto reakciách:
A (-I-efekt): -S03H, -CF3, -CCI3 atď.
A (-I, -M-efekt): -HC \u003d O, -COOH, -N02 atď.
Atómy halogénu zaujímajú medzipolohu - znižujú elektrónovú hustotu kruhu, znižujú rýchlosť elektrofilnej substitučnej reakcie a deaktivujú benzénový kruh v týchto reakciách, čo však o-,p-orienti.
Ak sú v benzénovom kruhu dva substituenty, môže sa ich orientačný účinok zhodovať ( dôsledná orientácia) alebo sa nezhoduje ( nedôsledná orientácia). Pri elektrofilných substitučných reakciách tvoria zlúčeniny s konzistentnou orientáciou menší počet izomérov; v druhom prípade vzniká zmes väčšieho počtu izomérov. Napríklad:
 p-
kyselina hydroxybenzoová m-
kyselina hydroxybenzoová
p-
kyselina hydroxybenzoová m-
kyselina hydroxybenzoová
(konzistentná orientácia) (nekonzistentná orientácia)
Polycyklické kondenzované aromatické uhľovodíky (naftalén, antracén, fenantrén atď.) Sú všeobecne podobné svojimi vlastnosťami ako benzén, ale zároveň majú určité rozdiely.
Prihláška:
1.aromatické uhľovodíky - suroviny na syntézu farbív, výbušnín, liečiv, polymérov, povrchovo aktívnych látok, karboxylových kyselín, amínov;
2. Kvapalné aromatické uhľovodíky sú dobrým rozpúšťadlom pre organické zlúčeniny;
3. arény - prísady na výrobu vysokooktánového benzínu.
Vieš to -V roku 1649 nemecký chemik Johann Glauber najskôr získal benzén.
V roku 1825 M. Faraday izoloval uhľovodík z výbojky a ustanovil jeho zloženie - C 6 H 6.
V roku 1830 nazval Justus Liebig výslednú zlúčeninu benzénom (z arabskej arómy Véna + šťava zoa + latinský olej).
V roku 1837 nazval Auguste Laurent benzénový radikál C6H5-fenyl (z gréckeho fenix-light).
V roku 1865 navrhol nemecký organický chemik Friedrich August Kekule vzorec pre benzén so striedaním dvojitých a jednoduchých väzieb v šesťčlennom cykle.
V rokoch 1865-70s V. Kerner navrhol použiť predpony na označenie relatívnej polohy dvoch substituentov: poloha 1,2 - orto- (orthos - priamy); 1,3- meta (meta - po) a 1,4- pár (odsek je opačný).
Aromatické uhľovodíky sú vysoko toxické látky, ktoré spôsobujú otravu a poškodenie niektorých orgánov, ako sú obličky a pečeň.
Niektoré aromatické uhľovodíky sú karcinogény (látky, ktoré spôsobujú rakovinu), napríklad benzén (ktorý spôsobuje leukémiu), jedným z najsilnejších je benzopyrén (nachádza sa v tabakovom dyme).
TÉMA 20. Aromatické uhľovodíky benzénovej série.
Homologická séria. Všeobecný vzorec. Nomenklatúra. Izoméria.
Prírodné zdroje a spôsoby výroby: z alifatických, alicyklických a aromatických zlúčenín. Reakcie Würz-Fittig a Friedel-Crafts.
Fyzikálne vlastnosti benzénu a jeho homológov.
Chemické vlastnosti. Elektrofilné substitučné reakcie: halogenácia, nitrácia, sulfonácia, alkylácia a acylácia. Reakcie pridania vodíka, halogénov, ozónu. Oxidácia benzénu. Vedľajšie reťazové reakcie benzénových homológov: halogenácia, nitrácia, oxidácia, dehydrogenácia.
Homologická séria. Všeobecný vzorec.
Prvý a najviac dôležitý predstaviteľ monocyklické aromatické uhľovodíky (arény) je benzénC 6 H 6.
Odtiaľ spoločný názov homológne série aromatických uhľovodíkov - séria benzénu.
Všeobecný vzorechomologická séria benzénu: C p N 2p-6.
Nomenklatúra arén.
Arény sú často pomenované triviálnymi menami: benzén, toluén, styrén, kumén atď.
Podľa medzinárodnej náhradnej nomenklatúryarény sa považujú za deriváty benzénu, v ktorých je poloha substituentov označená číslami, zatiaľ čo počet atómov uhlíka, v ktorých sú substituenty umiestnené, musí byť najmenší:
metylbenzén etylbenzén izopropylbenzén
(toluén) (kumén)

vinylbenzén etinylbenzén
(styrén) (fenylacetylén)
V prípade dvoch rovnakých substituentov môžete namiesto čísel použiť predvoľby: 1,2- (orto-), 1,3- (meta-), 1,4- (para-):

1,2-dimetylbenzén 1,3-dimetylbenzén 1,4-dimetylbenzén
(orto-xylén) (meta-xylén) (para-xylén)