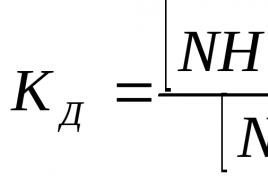Ionenaustauschreaktionen. Elektrolytische Dissoziation
Elektrolytische Dissoziation - Dies ist der Prozess der Zersetzung von Elektrolytmolekülen in Ionen unter Einwirkung polarer Lösungsmittelmoleküle.
ElektrolyteSind Substanzen, deren Schmelzen oder wässrige Lösungen elektrischen Strom leiten. Dazu gehören Lösungen von Säuren, Schmelzen und Lösungen von Alkalien und Salzen. Nichtelektrolyte Sind Substanzen, die keinen elektrischen Strom leiten. Dazu gehören viele organische Substanzen.
Man nennt Elektrolyte, die fast vollständig in Ionen dissoziieren stark; Elektrolyte, die teilweise in Ionen dissoziieren, werden genannt schwach.Zur quantitativen Beurteilung der Vollständigkeit der Dissoziation wird das Konzept des Dissoziationsgrades eingeführt. Der Grad der Dissoziation Der Elektrolyt wird als Verhältnis der Anzahl der in Ionen zerlegten Moleküle zur Gesamtzahl der in Lösung befindlichen Moleküle bezeichnet.
Normalerweise der Grad der Dissoziation ( α ) werden in Bruchteilen einer Einheit oder% ausgedrückt:
wo n - die Anzahl der Partikel, die einer elektrolytischen Dissoziation ausgesetzt sind;
n 0 - die Gesamtzahl der Partikel in der Lösung.
Starke Elektrolyte - fast alle Salze, lösliche Basen ( NaOH, KOH, Ba(OH) 2 und andere), anorganische Säuren ( H. 2 DAMIT 4 , HCl, HNO 3 , HBr, HALLO usw) .
Schwache Elektrolyte - unlösliche Basen und NH 4 OH, anorganische Säuren ( H. 2 CO 3, , H. 2 S., HNO 2, H. 3 PO 4 und andere), organische Säuren und Wasser H. 2 Ö.
Starke Elektrolyte dissoziieren fast vollständig in Ionen (d. H. Der Dissoziationsprozess ist irreversibel) und in einem Schritt:
HCl \u003d H. + + Cl – H. 2 DAMIT 4 \u003d 2H + + SO 4 2–
Schwache Elektrolyte dissoziieren teilweise (d. H. Der Dissoziationsprozess ist reversibel) und schrittweise . Beispielsweise wird für mehrbasische Säuren in jeder Stufe ein Wasserstoffion abstrahiert:
1.H. 2 DAMIT 3 ⇄ H. + + HSO 3 - 2. Hso 3 - ⇄ H. + + SO 3 2-
Somit wird die Anzahl der Stufen von mehrbasigen Säuren durch die Basizität der Säure (die Anzahl der Wasserstoffionen) bestimmt, und die Anzahl der Stufen der Polysäurebasen wird durch die Azidität der Base (oder die Anzahl der Hydroxylgruppen) bestimmt: NH 4
OH
⇄
NH 4
+
+
OH –
.
Der Prozess der elektrolytischen Dissoziation endet mit der Herstellung eines chemischen Gleichgewichtszustands im System, der durch die Gleichgewichtskonstante gekennzeichnet ist: 
Die Gleichgewichtskonstante des elektrolytischen Dissoziationsprozesses wird als Dissoziationskonstante bezeichnet - ZU D. ... Die Dissoziationskonstante hängt von der Art des Elektrolyten, der Art des Lösungsmittels und der Temperatur ab, hängt jedoch nicht von der Konzentration des Elektrolyten ab.
Zwischen ZU D. und α Es gibt eine quantitative Beziehung:
 (13)
(13)
Beziehung (13) heißt Ostwald-Verdünnungsgesetz: Der Dissoziationsgrad eines schwachen Elektrolyten nimmt mit der Verdünnung der Lösung zu.
Für schwache Elektrolyte, wenn α 1, ZU D. = α 2 VON.
Wasser ist ein schwacher Elektrolyt und dissoziiert daher reversibel:
H. 2 Ö ⇄ H. + + OH – ∆ H. \u003d + 56,5 kJ / mol
Dissoziationskonstante von Wasser: 
Der Dissoziationsgrad von Wasser ist sehr gering (es ist ein sehr schwacher Elektrolyt). Da Wasser in großem Überschuss vorhanden ist, kann seine Konzentration als konstant angesehen werden und ist  dann
dann
ZU D. [ H. 2 Ö] = [ H. + ]∙[ OH - ] = 55,6∙1,8∙10 -16 = 10 -14
[ H. + ]∙[ OH - ] = 10 -14 = K. W. - Ionenprodukt von Wasser
Da die Konzentrationen von Wasserstoffkationen und Hydroxidionen in Wasser gleich sind, gilt Folgendes: [
H. +
]
= [
OH -
]
=
 .
.
Die Auflösung anderer Substanzen (Säuren, Basen, Salze) in Wasser verändert die Ionenkonzentration H. + oder ER – , und ihr Produkt bleibt immer konstant und gleich 10 -14 bei T \u003d 25 0 The. Die Konzentration der Ionen H. + kann als Maß für die Säure oder Alkalität einer Lösung dienen. Normalerweise wird der pH-Wert für diesen Zweck verwendet: pH = - lg[ H. + ]. Auf diese Weise, pH Wert Ist der Dezimallogarithmus der Konzentration von Wasserstoffionen mit dem entgegengesetzten Vorzeichen.
Je nach Konzentration der Wasserstoffionen werden drei Medien unterschieden.
BEIM neutralumgebung [ H. + ] = [ OH - ]= 10 -7 mol / l, pH \u003d -lg 10 -7 = 7 ... Diese Umgebung ist typisch für reines Wasser und neutrale Lösungen. BEIM sauer Lösungen [ H. + ] > 10 -7 mol / l, pH< 7 ... In sauren Umgebungen pH variiert innerhalb 0 < рН < 7 ... BEIM alkalisch Umgebungen [ H. + ] < [ОН – ] und [ H. + ] < 10 -7 mol / l, Folglich, pH\u003e 7... Bereich der pH-Änderung: 7 < рН < 14 .
Ionenaustauschreaktionen (RIO) Sind Reaktionen zwischen Ionen, die in wässrigen Elektrolytlösungen stattfinden. Eine Besonderheit von Stoffwechselreaktionen: Die Elemente, aus denen die Reaktanten bestehen, verändern ihre Oxidationsstufe nicht. Ionenaustauschreaktionen sind irreversible Reaktionen und verlaufen unter der Voraussetzung: 1) die Bildung einer schwerlöslichen Substanz, 2) die Freisetzung einer gasförmigen Substanz, 3) die Bildung eines schwachen Elektrolyten.
Im Verlauf des RIO werden entgegengesetzt geladene Ionen gebunden und aus der Reaktionssphäre entfernt. Die Essenz von Ionenaustauschreaktionen wird unter Verwendung von Ionengleichungen ausgedrückt, die im Gegensatz zu molekularen die wahren Teilnehmer an der Reaktion zeigen. Bei der Erstellung von Ionengleichungen sollte man sich von der Tatsache leiten lassen, dass niedrig dissoziierende, schwerlösliche (ausgefällte) und gasförmige Substanzen in molekularer Form geschrieben sind. Stark lösliche Elektrolyte werden als Ionen aufgezeichnet. Daher ist es beim Schreiben von Ionengleichungen erforderlich, die Tabelle der Löslichkeit von Salzen und Basen in Wasser zu verwenden.
Hydrolyse- Dies ist der Prozess der Wechselwirkung von Salzionen mit Wassermolekülen, der zur Bildung von niedrig dissoziierenden Verbindungen führt. ist ein Sonderfall von Ionenaustauschreaktionen. Die gebildeten Salze werden einer Hydrolyse unterzogen:
schwache Säure und starke Base ( NaCH 3 GURREN, N / a 2 CO 3 , N / a 2 S., );
schwache Base und starke Säure ( NH 4 Cl, FeCl 3 , AlCl 3 ,);
schwache Base und schwache Säure ( NH 4 CN, NH 4 CH 3 GURREN).
Durch eine starke Säure und eine starke Base gebildete Salze werden nicht hydrolysiert: N / a 2 DAMIT 4 , BaCl 2 , NaCl, NaJ usw.
Die Salzhydrolyse erhöht die Ionenkonzentration H. + oder ER – ... Dies führt zu einer Verschiebung des Ionengleichgewichts von Wasser und gibt der Lösung je nach Art des Salzes ein saures oder alkalisches Medium (siehe Beispiele zur Problemlösung).
Berechnungsformeln.
1. Berechnen Sie die normale Konzentration einer Säurelösung (Test Nr. 1) oder einer Alkalilösung (Test Nr. 2) aus der Formel des Äquivalenzgesetzes für Lösungen:
2. Berechnen Sie die Masse der in 10 ml der entsprechenden Lösung enthaltenen Säure (Test Nr. 1) oder Alkali (Test Nr. 2) aus der Formel der Normalkonzentration:
3. Berechnen Sie die Masse an Wasser (Lösungsmittel) in 10 ml Lösung unter der Annahme, dass die Dichte der Lösung 1 beträgt:
4. Berechnen Sie anhand der erhaltenen Daten die angegebenen Konzentrationen gemäß den entsprechenden Formeln.
Laborarbeit Nr. 5
Zielsetzung: Untersuchen Sie die Bedingungen für den Verlauf von Ionenaustauschreaktionen und die Regeln für das Schreiben von Ionenaustauschreaktionen in molekularer und ionenmolekularer Form.
Theoretischer Teil.
Elektrolytische Dissoziation Der teilweise oder vollständige Zerfall von Elektrolytmolekülen in Ionen unter Einwirkung polarer Lösungsmittelmoleküle wird genannt. Die Dissoziation erfolgt durch eine komplexe physikalisch-chemische Wechselwirkung von Elektrolytmolekülen mit polaren Lösungsmittelmolekülen. Die Wechselwirkung von Ionen mit polaren Lösungsmittelmolekülen wird als Solvatation (für wässrige Lösungen - Hydratation) von Ionen bezeichnet. In Elektrolytlösungen werden solvatisierte Ionen gebildet.
Elektrolyte leiten elektrischen Strom, da Lösungen geladene Teilchen enthalten: Kationen und Anionen.
Der Dissoziationsprozess ist quantitativ gekennzeichnet durch grad der elektrolytischen Dissoziation α. Der Dissoziationsgrad ist das Verhältnis der Anzahl der in Ionen n zerfallenen Moleküle zur Gesamtzahl der Moleküle N des gelösten Stoffes:
Der Dissoziationsgrad wird als Prozentsatz oder Bruchteil einer Einheit ausgedrückt.
Elektrolyte werden in drei Gruppen eingeteilt: a) stark (α\u003e 30%), b) mittel (3)<α<30%), в) слабые (α<3%).
Die Lehrliteratur enthält Tabellen über den Dissoziationsgrad von Säuren, Basen und Salzen. Der Dissoziationsgrad hängt von der Art des gelösten Stoffes und der Lösungsmittel, der Temperatur, der Konzentration und dem Vorhandensein gleichnamiger Ionen in der Lösung ab. Bei schwachen Elektrolyten hängt der Dissoziationsgrad wesentlich von der Konzentration ab: Je niedriger die Konzentration der Lösung ist, desto höher ist der Grad der elektrolytischen Dissoziation.
Es ist viel bequemer, die Fähigkeit von Elektrolyten zu charakterisieren, sich zur Lösung zu dissoziieren dissoziationskonstante K. , was nicht von der Konzentration der Lösung abhängt. Die Dissoziationskonstante K ist die Gleichgewichtskonstante des reversiblen Dissoziationsprozesses einer schwachen Elektrolytsäure oder Base. Die Dissoziationskonstante von Säuren wird auch als Säurekonstante und die Basenkonstante als Basizitätskonstante bezeichnet. Die Werte der Dissoziationskonstanten schwacher Elektrolyte sind in den Tabellen für Standardbedingungen angegeben.
Die Dissoziationskonstante (Basizität) wird ausgedrückt durch das Verhältnis des Produkts der Gleichgewichtskonzentrationen von Ionen in einer Lösung eines gegebenen schwachen Elektrolyten zur Konzentration nicht dissoziierter Moleküle:
![]()
Die Dissoziationskonstante ist ein Maß für die relative Stärke schwacher Elektrolyte: Je kleiner sie ist, desto schwächer ist der Elektrolyt. Die Beziehung zwischen der Konstanten und dem Dissoziationsgrad eines schwachen binären Elektrolyten gehorcht ostwalds Zuchtgesetz:
![]()
Unter dem Gesichtspunkt der elektrolytischen Dissoziation werden Säuren Elektrolyte genannt, die in wässrigen Lösungen positiv geladene Wasserstoffionen und Säurerestanionen bilden. Wasserstoffionen sind charakteristisch für Säuren und bestimmen deren Eigenschaften. Säuren, die starke Elektrolyte sind: Salpetersäure HNO 3, Salzsäure HCl, Bromwasserstoff HBr, Iodwasserstoff HJ, Schwefelsäure H 2 SO 4, Mangan HMnO 4 und andere.
Es gibt deutlich mehr schwache Elektrolyte als starke. Schwache Elektrolyte sind Säuren: schwefelhaltiges H 2 SO 3, Flusssäure-HF, Kohlensäure H 2 CO 3, Schwefelwasserstoff H 2 S, Essigsäure CH 3 COOH usw. Polybasische Säuren dissoziieren schrittweise. Beispiele für die Säuredissoziation:
HCl \u003d H + + Cl -
CH 3 COOH CH 3 COO - + H +
Stufe I: H 2 SO 3 H + + HSО 3 -
oder H 2 SO 3 2H + + SO 3 2-,
II Stufe: HSО 3 - H + + SO 3 2 -
Unter dem Gesichtspunkt der elektrolytischen Dissoziation werden Basen als Elektrolyte bezeichnet, die in wässrigen Lösungen negativ geladene OH - Hydroxidionen und Metallkationen bilden. Hydroxidionen bestimmen die allgemeinen Eigenschaften von Basen. Basen mit einer Kationenvalenz größer als Eins dissoziieren schrittweise. Starke Elektrolyte sind Basen, in denen die Kationen Alkali- und Erdalkalimetalle sind, mit Ausnahme von Be (OH) 2 und Mg (OH) 2.
Grundsätzlich sind die Basen schwache Elektrolyte, insbesondere solche, die von amphoteren Metallen gebildet werden. Amphotere Hydroxide dissoziieren als Basen in einem sauren Medium und als Säuren in einem alkalischen Medium. Beispiele für die Dissoziation von Basen und amphoteren Hydroxiden:
NaOH \u003d Na + + OH -
1. Fe (OH) 2 FeOH + + OH -
II Art. FeOH + Fe 2+ + OH - oder Fe (OH) 2 Fe 2+ + 2OH -
Zn 2+ + 2OH - Zn (OH) 2 H 2 ZnО 2 2H + + ZnO 2 2-
Salze sind Elektrolyte, die in Wasser in positive Metallionen und negative Ionen des Säurerests dissoziieren. Alle in Wasser gut löslichen Salze sind starke Elektrolyte. Beispiele für die Dissoziation von normalen (mittleren), sauren, basischen, komplexen und doppelten Salzen:
KBr \u003d K + + Br -; K 3 \u003d 3K + + 3-;
NaHCO 3 \u003d Na + + HCO 3 -; KAl (SO 4) 2 \u003d K + + Al 3+ + 2SO 4 2-.
AlOHCl 2 \u003d AlOH 2+ + 2C1 -;
Die Untersuchung verschiedener Reaktionen, hauptsächlich in nichtwässrigen Medien, führte zur Schaffung allgemeinerer Konzepte für Säuren und Basen. Die wichtigste der modernen Theorien über Säuren und Basen gehört zur Protonentheorie, nach der die Säure ein Protonendonor ist, dh ein Teilchen (Molekül oder Ion), das ein Wasserstoffion abgeben kann - ein Proton, und die Base ist ein Protonenakzeptor, d.h. ein Teilchen (Molekül oder Ion), das ein Proton binden kann. Zum Beispiel in einer Reaktion:
HC1 + NH 3 \u003d NH 4 + + Cl -
das C1 - -Ion ist die an die HCl-Säure konjugierte Base, und das NH 4 + -Ion ist die an die NH 3 -Base konjugierte Säure. Reaktionen in Elektrolytlösungen finden zwischen Ionen statt, in die sich gelöste Moleküle zersetzen. Reaktionen werden in drei Formen aufgezeichnet: molekular, vollständig ionisch-molekular und abgekürzt ionenmolekular. Starke Elektrolyte werden in Form von Ionen, mittleren und schwachen Elektrolyten, Niederschlägen und Gasen - in Form von Molekülen - aufgezeichnet. Das Wesen der Reaktion spiegelt sich in der abgekürzten ionisch-molekularen Gleichung wider, in der nur Partikel angegeben sind, die direkt in die Reaktion eintreten, und Ionen und Moleküle, deren Konzentration sich nicht signifikant ändert, nicht angegeben sind. Reaktionen zwischen Elektrolyten gehen in Richtung der Bildung von Gas, Sediment oder schwächer
elektrolyt.
Ein Beispiel für eine Reaktion in Elektrolytlösungen: Neutralisation einer starken Salpetersäure mit einer schwachen Base (Ammoniumhydroxid). Molekulare Reaktionsgleichung:
HNO 3 + NH 4 OH \u003d NH 4 NO 3 + H 2 O.
Bei dieser Reaktion sind starke Elektrolyte Salpetersäure und das resultierende Ammoniumnitrat-Salz, das wir in Form von Ionen schreiben, und schwache Elektrolyte sind Ammoniumhydroxid und Wasser, die wir in Form von Molekülen schreiben. Die vollständige ionisch-molekulare Gleichung lautet:
H + + NO 3 - + NH 4 OH \u003d NH 4 + + NO 3 - + H 2 O.
Wie Sie sehen können, unterliegen nur NO 3 - -Ionen im Verlauf der Reaktion keinen Änderungen. Wenn wir sie nicht ausschließen, schreiben wir die abgekürzte Ionen-Molekül-Gleichung auf:
H + + NH 4 OH \u003d NH 4 + + H 2 O.
Praktischer Teil
Ionen - molekulare Austauschreaktionen
Reaktionen zwischen Elektrolytlösungen entsprechend der Aufgabe durchführen. Gießen Sie dazu 7-8 Tropfen eines Reagenz in ein Reagenzglas und geben Sie 7-8 Tropfen eines anderen Reagenz hinzu. Anzeichen einer Reaktion beobachten: Ausfällung, Gasentwicklung oder Geruchsänderung (was auf die Bildung einer niedrig dissoziierenden Substanz hinweist).
Klassifizieren Sie dann gemäß den beobachteten Zeichen die Reaktion als einen von drei Typen:
1) Ionenaustauschreaktionen unter Bildung einer schwerlöslichen Substanz (Niederschlag);
2) Ionenaustauschreaktionen mit Gasentwicklung;
3) Ionenaustauschreaktionen unter Bildung eines schwachen Elektrolyten.
Schreiben Sie jede Reaktion in 3 Formen auf:
a) molekular,
b) voll ionisch - molekular,
c) reduziert ionisch-molekular.
Machen Sie eine Schlussfolgerung über die Richtung der Ionenaustauschreaktionen.
Aufgabenliste:
| 1. CH 3 COONa + H 2 SO 4 2. NaNO 2 + H 2 SO 4 3. MgCl 2 + Na 3 PO 4 4. NH 4 Cl + KOH 5. Na 2 CO 3 + HCl 6. Na 2 CO 3 + Ba (NO 3) 2 7. (CH 3 COO) 2 Pb + HCl 8. Hg (NO 3) 2 + NaOH 9. H 2 SO 4 + BaCl 2 10. NaCl + Pb (NO 3) 2 11. NiSO 4 + KOH 12. NaNO 2 + HCl 13. Bi (NO 3) 3 + KOH 14. Na 2 S + CdCl 2 15. Bi (NO 3) 3 + Na 2 S 16. CoSO 4 + KOH 17. CuSO 4 + KOH 18. Na 2 CO 3 + HNO 3 19. K 2 CrO 4 + CuSO 4 20. K 2 CrO 4 + MnSO 4 21. K 2 CrO 4 + NiSO 4 22. K 2 CO 3 + MnSO 4 23. Na 2 SO 3 + HCl | 24. Hg (NO 3) 2 + Na 2 S 25. NiSO 4 + NH 4 OH 26. NiSO 4 + NH 4 OH g 27. AlCl 3 + KOH 28. FeCl 3 + Na 3 PO 4 29. K 2 CrO 4 + Ba (NO 3) 2 30. NaNO 2 + HNO 3 31. MgCl 2 + NaOH 32. CuSO 4 + NH 4 OH 33. CuSO 4 + NH 4 OH g 34. AlCl 3 + KOH g 35. Pb (NO 3) ) 2 + KI 36. CH 3 COOK + HCl 37. Al 2 (SO 4) 3 + NaOH 38. Al 2 (SO 4) 3 + NaOH g 39. CoSO 4 + Na 2 S 40. Pb (NO 3) 2 + Na 3 PO 4 41. Na 3 PO 4 + CuSO 4 42. CH 3 COOK + HNO 3 43. CH 3 COOH + KOH 44. CoSO 4 + NH 4 OH 45. CoSO 4 + NH 4 OH g 46. Hg (NO 3 ) 2 + KI | 47. Hg (NO 3) 2 + KI g 48. CdCl 2 + NH 4 OH 49. CdCl 2 + NH 4 OH g 50. NaHCO 3 + HNO 3 51. ZnSO 4 + BaCl 2 52. ZnSO 4 + KOH 53. ZnSO 4 + KOH g 54. (CH 3 COO) 2 Pb + H 2 SO 4 55. NaHCO 3 + H 2 SO 4 56. (NH 4) 2 SO 4 + KOH 57. K 2 CO 3 + H 2 SO 4 58 (NH 4) 2 SO 4 + NaOH 59. K 2 CO 3 + HCl 60. CrCl 3 + KOH 61. CrCl 3 + KOH g 62. ZnCl 2 + NaOH 63. ZnCl 2 + NaOH g 64. MnSO 4 + KOH 65. MnSO 4 + Na 3 PO 4 66. Na 2 SO 3 + H 2 SO 4 67. K 2 CO 3 + CH 3 COOH 68. Na 2 CO 3 + CH 3 COOH 69. NaHCO 3 + CH 3 COOH |
Laborarbeit Nr. 6
ELEKTROLYTISCHE DISSOCIATION
ELEKTROLYTE UND NICHTELEKTROLYTE
Theorie der elektrolytischen Dissoziation
(S. Arrhenius, 1887)
Wenn Elektrolyte in Wasser gelöst (oder geschmolzen) werden, zersetzen sie sich in positiv und negativ geladene Ionen (elektrolytische Dissoziation).
Unter Einwirkung eines elektrischen Stroms bewegen sich Kationen (+) zur Kathode (-) und Anionen (-) zur Anode (+).
Die elektrolytische Dissoziation ist ein reversibler Prozess (die umgekehrte Reaktion wird als Molarisation bezeichnet).
Grad der elektrolytischen Dissoziation (a) hängt davon ab von der Art des Elektrolyten und des Lösungsmittels, der Temperatur und der Konzentration. Es zeigt das Verhältnis der Anzahl der in Ionen zerfallenen Moleküle (n) auf die Gesamtzahl der in die Lösung eingebrachten Moleküle (N).
a \u003d n / N 0< a < 1
Der Mechanismus der elektrolytischen Dissoziation ionischer Substanzen
Beim Auflösen von Verbindungen mit Ionenbindungen (z.B. NaCl) der Hydratationsprozess beginnt mit der Ausrichtung der Wasserdipole um alle Grate und Flächen der Salzkristalle.
Wassermoleküle orientieren sich an den Ionen des Kristallgitters und bilden mit ihnen entweder Wasserstoff- oder Donor-Akzeptor-Bindungen. Bei diesem Prozess wird eine große Energiemenge freigesetzt, die als Hydratationsenergie bezeichnet wird.
Die Hydratationsenergie, deren Wert mit der Energie des Kristallgitters vergleichbar ist, wird zur Zerstörung des Kristallgitters verwendet. In diesem Fall gelangen hydratisierte Ionen Schicht für Schicht in das Lösungsmittel und bilden beim Mischen mit seinen Molekülen eine Lösung.
Der Mechanismus der elektrolytischen Dissoziation polarer Substanzen
Substanzen, deren Moleküle nach der Art der polaren kovalenten Bindung (polare Moleküle) gebildet werden, dissoziieren auf ähnliche Weise. Um jedes polare Materiemolekül (z.B. HCl), wasserdipole sind in gewisser Weise orientiert. Durch die Wechselwirkung mit Wasserdipolen wird das polare Molekül noch stärker polarisiert und verwandelt sich in ein ionisches Molekül. Dann bilden sich leicht freie hydratisierte Ionen.
Elektrolyte und Nichtelektrolyte
Die elektrolytische Dissoziation von Substanzen, die unter Bildung freier Ionen auftritt, erklärt die elektrische Leitfähigkeit von Lösungen.
Der Prozess der elektrolytischen Dissoziation wird normalerweise in Form eines Diagramms geschrieben, ohne seinen Mechanismus aufzudecken und das Lösungsmittel wegzulassen (H 2 O), obwohl er einen großen Beitrag leistet.
CaCl 2 «Ca 2+ + 2Cl -
KAl (SO 4) 2 "K + + Al 3+ + 2SO 4 2-
HNO 3 "H + + NO 3 -
Ba (OH) 2 «Ba 2+ + 2OH -
Aus der Elektroneutralität der Moleküle folgt, dass die Gesamtladung der Kationen und Anionen Null sein sollte.
Zum Beispiel für
Al 2 (SO 4) 3 –– 2 (+3) + 3 (-2) \u003d +6–6 \u003d 0
KCr (SO 4) 2 –– 1 (+1) + 3 (+3) + 2 (-2) \u003d +1 + 3 - 4 \u003d 0
Starke Elektrolyte
Dies sind Substanzen, die sich in Wasser fast vollständig in Ionen zersetzen. Starke Elektrolyte umfassen in der Regel Substanzen mit ionischen oder stark polaren Bindungen: alle leicht löslichen Salze, starke Säuren (HCl, HBr, HI, HClO 4, H 2 SO 4, HNO 3) und starke Basen (LiOH, NaOH, KOH, RbOH, CsOH, Ba (OH) 2, Sr (OH) 2, Ca (OH) 2).
In einer Lösung eines starken Elektrolyten liegt der gelöste Stoff hauptsächlich in Form von Ionen (Kationen und Anionen) vor; nicht dissoziierte Moleküle fehlen praktisch.
Schwache Elektrolyte
Substanzen, die teilweise in Ionen dissoziieren. Lösungen schwacher Elektrolyte enthalten zusammen mit Ionen nicht dissoziierte Moleküle. Schwache Elektrolyte können keine hohe Konzentration an Ionen in Lösung ergeben.
Schwache Elektrolyte umfassen:
fast alle organischen Säuren (CH 3 COOH, C 2 H 5 COOH usw.);
einige anorganische Säuren (H 2 CO 3, H 2 S usw.);
fast alle Salze, Basen und Ammoniumhydroxide sind in Wasser schwer löslich(Ca 3 (PO 4) 2; Cu (OH) 2; Al (OH) 3; NH 4 OH);
wasser.
Sie leiten elektrischen Strom schlecht (oder kaum).
CH 3 COOH CH 3 COO - + H +
Cu (OH) 2 «[CuOH] + + OH - (erste Stufe)
[CuOH] + Cu 2+ + OH - (zweite Stufe)
H 2 CO 3 «H + + HCO - (erste Stufe)
HCO 3 - H + + CO 3 2- (zweite Stufe)
Nichtelektrolyte
Substanzen, wässrige Lösungen und Schmelzen leiten keinen elektrischen Strom. Sie enthalten kovalente unpolare oder niedrigpolare Bindungen, die nicht in Ionen zerfallen.
Gase, Feststoffe (Nichtmetalle), organische Verbindungen (Saccharose, Benzin, Alkohol) leiten keinen elektrischen Strom.
IONISCHE REAKTIONEN. HYDROLYSE
Ionenreaktionen in Lösung
Ionenaustauschreaktionen sind Reaktionen zwischen Ionen, die infolge der Dissoziation von Elektrolyten gebildet werden.
Regeln zur Erstellung von Ionenreaktionsgleichungen
In Wasser unlösliche Verbindungen (einfache Substanzen, Oxide, einige Säuren, Basen und Salze) dissoziieren nicht.
Bei Reaktionen werden Lösungen von Substanzen verwendet, daher liegen auch schwerlösliche Substanzen in Lösungen in Form von Ionen vor.
Wenn sich durch die Reaktion eine schwerlösliche Substanz bildet, gilt diese beim Schreiben der Ionengleichung als unlöslich.
Die Summe der elektrischen Ladungen der Ionen auf der linken und rechten Seite der Gleichung sollte gleich sein.
Das Verfahren zur Erstellung von Ionenreaktionsgleichungen
Schreiben Sie die molekulare Reaktionsgleichung
MgCl 2 + 2AgNO 3 ® 2AgCl + Mg (NO 3) 2
Bestimmen Sie die Löslichkeit jeder Substanz anhand der Löslichkeitstabelle
LEKTION 9 10. Klasse (erstes Studienjahr)
Die Theorie der elektrolytischen Dissoziation. Ionenaustauschreaktionen Plan
1. Elektrolyte und Nichtelektrolyte.
2. Die Theorie der elektrolytischen Dissoziation (TED) S. A. Arrhenius.
3. Der Mechanismus der elektrolytischen Dissoziation von Elektrolyten mit ionischen und kovalenten polaren Bindungen.
4. Der Grad der Dissoziation.
5. Säuren, Basen, amphotere Hydroxide, Salze aus Sicht von TED.
6. Der Wert von Elektrolyten für lebende Organismen.
7. Dissoziation von Wasser. Ionenprodukt von Wasser. Wasserstoffindikator. Medien wässriger Elektrolytlösungen. Indikatoren.
8. Reaktionen des Ionenaustauschs und Bedingungen ihres Verlaufs.
Entsprechend der Fähigkeit, elektrischen Strom in einer wässrigen Lösung oder Schmelze zu leiten, können alle Substanzen in Elektrolyte und Nichtelektrolyte unterteilt werden.
Elektrolyte - Dies sind Substanzen, Lösungen oder Schmelzen, die elektrischen Strom leiten. Elektrolyte (Säuren, Salze, Laugen) haben ionische oder polare kovalente Bindungen.
Nichtelektrolyte - Dies sind Substanzen, Lösungen oder Schmelzen, die keinen elektrischen Strom leiten. In Nichtelektrolytmolekülen (organische Substanzen, Gase, Wasser) sind Bindungen kovalent unpolar oder niedrigpolar.
Um die elektrische Leitfähigkeit von Elektrolytlösungen und -schmelzen zu erklären, schuf Arrhenius 1887 theorie der elektrolytischen DissoziationDie wichtigsten Bestimmungen lauten wie folgt.
1. Elektrolytmoleküle in Lösung oder Schmelze dissoziieren (zerfallen in Ionen). Der Prozess des Abbaus von Elektrolytmolekülen in Ionen in Lösung oder Schmelze wird als elektrolytische Dissoziation bezeichnet. Jona Sind Teilchen, die eine Ladung haben. Positiv geladene Ionen - kationen, negativ geladen - anionen... Die Eigenschaften von Ionen unterscheiden sich von denen der entsprechenden neutralen Atome, was durch die unterschiedliche elektronische Struktur dieser Partikel erklärt wird.
2. In einer Lösung oder Schmelze bewegen sich Ionen chaotisch. Wenn jedoch ein elektrischer Strom durch eine Lösung oder Schmelze geleitet wird, wird die Bewegung der Ionen geordnet: Kationen bewegen sich zur Kathode (negativ geladene Elektrode) und Anionen bewegen sich zur Anode (positiv geladene Elektrode).
3. Dissoziation ist ein reversibler Prozess. Gleichzeitig mit der Dissoziation geht verband - der Prozess der Bildung von Molekülen aus Ionen.
4. Die Gesamtsumme der Ladungen der Kationen in Lösung oder Schmelze entspricht der Gesamtsumme der Ladungen der Anionen und hat ein entgegengesetztes Vorzeichen. Die Lösung ist im Allgemeinen elektrisch neutral.
Der Hauptgrund für die Dissoziation in Lösungen mit einem polaren Lösungsmittel ist die Solvatisierung von Ionen (im Fall von wässrigen Lösungen Hydratation). Die Dissoziation ionischer Verbindungen in einer wässrigen Lösung verläuft vollständig (KCl, LiNO 3, Ba (OH) 2 usw.). Elektrolyte mit einer polaren kovalenten Bindung können je nach Polarität der Bindung (H 2 SO 4, HNO 3, HI usw.) teilweise oder vollständig dissoziieren. In einer wässrigen Lösung werden hydratisierte Ionen gebildet, aber der Einfachheit halber zeigen die Gleichungen Ionen ohne Wassermoleküle:

Einige Elektrolyte dissoziieren vollständig, andere teilweise. Um die Dissoziation zu charakterisieren, wird das Konzept eingeführt grad der elektrolytischen Dissoziation ... Die Menge zeigt das Verhältnis der Anzahl dissoziierter Moleküle n auf die Anzahl der gelösten Moleküle N. Elektrolyt in Lösung:
= n/N..
Der Dissoziationsgrad nimmt mit der Verdünnung der Lösung und mit steigender Temperatur der Lösung zu. Je nach Dissoziationsgrad werden Elektrolyte in stark, mittelstark und schwach unterteilt. Starke Elektrolyte dissoziieren in Lösung fast vollständig, ihr Dissoziationsgrad beträgt mehr als 30% und tendiert zu 100%. Mittlere Elektrolyte umfassen Elektrolyte, deren Dissoziationsgrad im Bereich von 3% bis 30% liegt. Der Dissoziationsgrad schwacher Elektrolyte beträgt weniger als 3%. Starke Elektrolyte umfassen Salze, starke Säuren und Laugen. Schwach - schwache Säuren, unlösliche Basen, Ammoniumhydroxid, Wasser.
Aus Sicht der Theorie der elektrolytischen Dissoziation können Substanzen verschiedener Klassen definiert werden.
Säuren - Dies sind Elektrolyte, die während der Dissoziation Wasserstoffkationen und Säurerestanionen bilden. Die Anzahl der Dissoziationsschritte hängt von der Basizität der Säure ab, zum Beispiel:
HCl H + + Cl -,
H 2 CO 3 H + + HCO 3 - 2H + + CO 3 2–.
Stiftungen Dissoziieren Elektrolyte in Metallkationen und Hydroxygruppenanionen? Die Anzahl der Dissoziationsschritte hängt von der Säure der Base ab, zum Beispiel:
NaOH Na + + 2OH -,
Ca (OH) 2 CaOH + + OH - Ca 2+ + 2OH -.
Amphotere Hydroxide Sind schwache Elektrolyte, die bei Dissoziation sowohl Wasserstoffkationen als auch Hydroxygruppenanionen bilden, zum Beispiel:
Zn (OH) 2 ZnOH + + OH - Zn 2+ + 2OH -,
H 2 ZnO 2 H + + HZnO 2 - 2H + + ZnO 2 2–.
Mittlere Salze Dissoziieren Elektrolyte in Metallkationen und Säurerestanionen, zum Beispiel:
Na 2 SO 4 2Na + + SO 4 2–.
Saure Salze Sind Elektrolyte, die in Metallkationen und komplexe Anionen dissoziieren, zu denen Wasserstoffatome und ein Säurerest gehören, zum Beispiel:
NaHCO 3 Na + + HCO 3 -.
Grundsalze Dissoziieren Elektrolyte in Säurerestanionen und komplexe Kationen, die aus Metallatomen und Hydroxygruppen bestehen, zum Beispiel:
Сu (OH) Сl CuОН + + Сl -.
Komplexe Salze - Dies sind Elektrolyte, die während der Dissoziation komplexe Komplexionen bilden, die in wässrigen Lösungen ziemlich stabil sind, zum Beispiel:
K 3 3K + + 3–.
Elektrolyte sind ein wesentlicher Bestandteil der Flüssigkeiten und Gewebe lebender Organismen. Für den normalen Verlauf physiologischer und biochemischer Prozesse sind Natrium-, Kalium-, Calcium-, Magnesium-, Wasserstoffkationen, Chloranionen, Sulfationen, Bicarbonationen, Hydroxidionen usw. erforderlich. Die Konzentrationen dieser Ionen im menschlichen Körper sind unterschiedlich. Beispielsweise sind die Konzentrationen an Natrium- und Chlorionen sehr signifikant und werden täglich nachgefüllt. Die Konzentrationen von Wasserstoffionen und Hydroxidionen sind sehr gering, spielen jedoch eine große Rolle in Lebensprozessen und tragen zur normalen Funktion von Enzymen, Stoffwechsel, Verdauung usw. bei.
Dissoziation von Wasser.
Wasserstoffexponent
Wasser ist ein schwacher amphoterer Elektrolyt. Die Wasserdissoziationsgleichung lautet:
H 2 OH + + OH -
2H 2 OH 3 O + + OH -.
Die Konzentration von Protonen und Hydroxidionen in Wasser ist gleich und beträgt 10–7 mol / l bei 25 ° C.
Das Produkt der Konzentrationen von Wasserstoffionen und Hydroxidionen wird genannt ionenprodukt von Wasser und bei 25 ° С ist es 10 –14.
Die Umgebung jeder wässrigen Lösung kann durch die Konzentration von H + - oder OH - -Ionen charakterisiert werden. Unterscheiden Sie zwischen neutralen, sauren und alkalischen Lösungen.
In einer neutralen Lösungsumgebung:
10 -7 mol / l,
in einer sauren Lösung:
\u003e, d.h. \u003e 10 -7 mol / l,
in einer alkalischen Lösung:
\u003e, d.h. \u003e 10 –7 mol / l.
Zur Charakterisierung des Lösungsmediums ist es zweckmäßig, den pH-Wert zu verwenden (Tabelle 1, siehe S. 14). Wasserstoffexponent Ist der negative Dezimallogarithmus der Wasserstoffionenkonzentration:
pH \u003d –lg.
Im Verlauf der Lektion werden wir uns mit dem Thema „Elektrolytische Dissoziation. Ionenaustauschreaktionen ". Betrachten Sie die Theorie der elektrolytischen Dissoziation und machen Sie sich mit der Definition von Elektrolyten vertraut. Machen wir uns mit der physikalischen und chemischen Theorie der Lösungen vertraut. Betrachten wir im Lichte der Theorie der elektrolytischen Dissoziation die Bestimmung von Basen, Säuren und Salzen und lernen wir auch, wie man die Gleichungen von Ionenaustauschreaktionen zusammensetzt und die Bedingungen für ihre Irreversibilität kennenlernt.
Thema: Lösungen und ihre Konzentration, dispergierte Systeme, elektrolytische Dissoziation
Lektion: Elektrolytische Dissoziation. Ionenaustauschreaktionen
1. Physikalische und chemische Theorie der Lösungen
Schon zu Beginn der Untersuchung elektrischer Phänomene stellten Wissenschaftler fest, dass nicht nur Metalle, sondern auch Lösungen Strom leiten können. Aber nicht alle von ihnen. So leiten wässrige Lösungen von Natriumchlorid und anderen Salzen, Lösungen von starken Säuren und Laugen den Strom gut. Lösungen von Essigsäure, Kohlendioxid und Schwefeldioxid führen es viel schlechter. Lösungen von Alkohol, Zucker und den meisten anderen organischen Verbindungen leiten jedoch überhaupt keinen Strom.
Elektrischer Strom ist die gerichtete Bewegung frei geladener Teilchen... In Metallen wird diese Bewegung von relativ freien Elektronen, Elektronengas, ausgeführt. Aber nicht nur Metalle können elektrischen Strom leiten.
Elektrolyte - Dies sind Substanzen, Lösungen oder Schmelzen, die elektrischen Strom leiten.
Nichtelektrolyte - Dies sind Substanzen, deren Lösungen oder Schmelzen keinen elektrischen Strom leiten.
Um die elektrische Leitfähigkeit einiger Lösungen zu beschreiben, muss man verstehen, was eine Lösung ist. Bis zum Ende des 19. Jahrhunderts gab es zwei Haupttheorien von Lösungen:
· Körperlich. Nach dieser Theorie ist die Lösung - es ist eine rein mechanische Mischung von Komponenten, und es gibt keine Wechselwirkung zwischen Partikeln darin. Sie beschrieb die Eigenschaften von Elektrolyten gut, hatte jedoch gewisse Schwierigkeiten bei der Beschreibung von Elektrolytlösungen.
· Chemisch. Nach dieser Theorie findet während der Auflösung eine chemische Reaktion zwischen dem gelösten Stoff und dem Lösungsmittel statt. Dies wird durch das Vorhandensein eines thermischen Effekts beim Auflösen sowie einer Farbänderung bestätigt. Wenn beispielsweise weißes wasserfreies Kupfersulfat gelöst wird, wird eine gesättigte blaue Lösung gebildet.
Die Wahrheit liegt zwischen diesen beiden Extrempunkten. In Lösungen finden nämlich sowohl ein chemischer als auch ein physikalischer Prozess statt.
Zahl: 1. Svante Arrhenius
1887 schlug der schwedische Physiker - Chemiker Svante Arrhenius (Abb. 1), der die elektrische Leitfähigkeit wässriger Lösungen untersuchte, vor, dass sich in solchen Lösungen Substanzen in geladene Teilchen - Ionen - zersetzen, die sich zu den Elektroden bewegen können - negativ geladene Kathode und positiv geladene Anode.
Dies ist der Grund für den elektrischen Strom in Lösungen. Dieser Vorgang wird als elektrolytische Dissoziation bezeichnet (wörtliche Übersetzung - Aufspaltung, Zersetzung unter dem Einfluss von Elektrizität). Dieser Name legt auch nahe, dass die Dissoziation durch die Einwirkung eines elektrischen Stroms erfolgt. Weitere Studien haben gezeigt, dass dies nicht der Fall ist: Ionen sind nur Ladungsträger in einer Lösung und existieren darin, unabhängig davon, ob Strom durch die Lösung fließt oder nicht. Unter aktiver Beteiligung von Svante Arrhenius wurde die Theorie der elektrolytischen Dissoziation formuliert, die häufig nach diesem Wissenschaftler benannt wird. Die Hauptidee dieser Theorie ist, dass sich Elektrolyte unter Einwirkung eines Lösungsmittels spontan in Ionen zersetzen. Und es sind diese Ionen, die Ladungsträger sind und für die elektrische Leitfähigkeit der Lösung verantwortlich sind.
2. Die wichtigsten Bestimmungen der Theorie der elektrolytischen Dissoziation
1. Elektrolyte in Lösungen unter Einwirkung eines Lösungsmittels zersetzen sich spontan in Ionen. Dieser Vorgang wird aufgerufen elektrolytische Dissoziation. Eine Dissoziation kann auch stattfinden, wenn Festelektrolyte geschmolzen sind.
2. Ionen unterscheiden sich von Atomen in Zusammensetzung und Eigenschaften. In wässrigen Lösungen befinden sich Ionen in einem hydratisierten Zustand. Ionen in einem hydratisierten Zustand unterscheiden sich in ihren Eigenschaften von Ionen in einem gasförmigen Zustand einer Substanz. Dies wird wie folgt erklärt: In ionischen Verbindungen sind zunächst bereits Kationen und Anionen vorhanden. Wenn es aufgelöst ist, nähert sich das Wassermolekül den geladenen Ionen: dem positiven Pol - zum negativen Ion, zum negativen Pol - zum positiven. Ionen werden als hydratisiert bezeichnet (Abb. 2).
3. In Lösungen oder Schmelzen von Elektrolyten bewegen sich Ionen chaotisch, aber wenn ein elektrischer Strom geleitet wird, bewegen sich Ionen in eine gerichtete Weise: Kationen zur Kathode, Anionen - zur Anode.
3. Basen, Säuren, Salze im Lichte der Theorie der elektrolytischen Dissoziation
Im Lichte der Theorie der elektrolytischen Dissoziation ist es möglich, Basen, Säuren und Salze als Elektrolyte zu definieren.
Stiftungen- Dies sind Elektrolyte, bei deren Dissoziation in wässrigen Lösungen nur eine Art von Anionen gebildet wird: Hydroxidanion: OH-.
NaOH ↔ Na + + OH–
Die Dissoziation von Basen, die mehrere Hydroxylgruppen enthalten, erfolgt schrittweise:
Ba (OH) 2↔ Ba (OH) + + OH– Erste Stufe
Ba (OH) + ↔ Ba2 + + 2OH - Zweite Stufe
Ba (OH) 2↔ Ba2 + + 2 OH− Gesamtgleichung
Säuren - Dies sind Elektrolyte, aufgrund deren Dissoziation in wässrigen Lösungen nur eine Art von Kationen gebildet wird: H +. Es ist das hydratisierte Proton, das als Wasserstoffion bezeichnet wird und als H3O + bezeichnet wird. Der Einfachheit halber wird jedoch H + geschrieben.
HNO3↔ H + + NO3−
Mehrbasige Säuren dissoziieren in Schritten:
H3PO4↔ H + + H2PO4- Erste Stufe
H2PO4- ↔ H + + HPO42- Zweite Stufe
HPO42-↔ H + + PO43- Dritte Stufe
H3PO4↔ 3H + + PO43-Summengleichung
Salz - Dies sind Elektrolyte, die in wässrigen Lösungen in Metallkationen und Anionen des Säurerests dissoziieren.
Na2SO4 ↔ 2Na + + SO42−
Mittlere Salze - dies sind Elektrolyte, die in wässrigen Lösungen in Metallkationen oder Ammoniumkationen und Säurerestanionen dissoziieren.
Grundsalze - Dies sind Elektrolyte, die in wässrigen Lösungen in Metallkationen, Hydroxidanionen und Anionen eines Säurerests dissoziieren.
Saure Salze - dies sind Elektrolyte, die in wässrigen Lösungen in Metallkationen, Wasserstoffkationen und Säurerestanionen dissoziieren.
Doppelsalze - Dies sind Elektrolyte, die in wässrigen Lösungen in Kationen mehrerer Metalle und Anionen eines Säurerests dissoziieren.
KAl (SO4) 2↔ K + + Al3 + + 2SO42
Gemischte Salze - Dies sind Elektrolyte, die in wässrigen Lösungen in Metallkationen und Anionen mehrerer Säurereste dissoziieren
4. Starke und schwache Elektrolyte
Elektrolytische Dissoziation in unterschiedlichem Maße - der Prozess ist reversibel. Beim Auflösen einiger Verbindungen verschiebt sich das Dissoziationsgleichgewicht jedoch weitgehend in Richtung der dissoziierten Form. In Lösungen solcher Elektrolyte verläuft die Dissoziation nahezu irreversibel. Daher wird beim Schreiben der Gleichungen für die Dissoziation solcher Substanzen entweder ein Gleichheitszeichen oder ein gerader Pfeil geschrieben, was darauf hinweist, dass die Reaktion nahezu irreversibel ist. Solche Substanzen werden genannt starkelektrolyte.
Schwach Es werden Elektrolyte genannt, bei denen eine Dissoziation leicht auftritt. Verwenden Sie beim Schreiben das Umkehrbarkeitszeichen. Tab. 1.
Um die Stärke des Elektrolyten zu quantifizieren, wurde das Konzept eingeführt elektrolytgraddissoziation.
Die Stärke des Elektrolyten kann auch charakterisiert werden durch chemische Gleichgewichtskonstanten Dissoziation. Es wird die Dissoziationskonstante genannt.
Faktoren, die den Grad der elektrolytischen Dissoziation beeinflussen:
Die Art des Elektrolyten
Konzentration des Elektrolyten in Lösung
· Temperatur
Mit zunehmender Temperatur und Verdünnung der Lösung nimmt der Grad der elektrolytischen Dissoziation zu. Daher kann die Stärke des Elektrolyten nur durch Vergleichen unter den gleichen Bedingungen geschätzt werden. T \u003d 180 ° C und c \u003d 0,1 mol / l werden als Standard genommen.
5. Ionenaustauschreaktionen
Das Wesen der Reaktion in Elektrolytlösungen wird durch die Ionengleichung ausgedrückt. Es berücksichtigt die Tatsache, dass in einer Lösung Elektrolyte in Form von Ionen vorliegen. Und schwache Elektrolyte und nicht dissoziierbare Substanzen werden in einer in Ionen dissoziierten Form aufgezeichnet. Die Löslichkeit des Elektrolyten in Wasser kann nicht als Maß für seine Festigkeit herangezogen werden. Viele wasserunlösliche Salze sind starke Elektrolyte, aber die Konzentration der Ionen in Lösung ist gerade wegen ihrer geringen Löslichkeit sehr gering. Deshalb ist es beim Schreiben der Reaktionsgleichungen unter Beteiligung solcher Substanzen üblich, sie in nicht dissoziierter Form zu schreiben .
Reaktionen in Elektrolytlösungen verlaufen in Richtung der Ionenbindung.
Es gibt verschiedene Formen der Ionenbindung:
1. Sedimentbildung
2. Gasentwicklung
3. Bildung eines schwachen Elektrolyten.
· 1. Sedimentbildung:
BaCl2 + Na2CO3 → BaCO3 ↓ + 2NaCl.
Ba2 ++ 2Cl - + 2Na ++ CO32- → BaCO3 ↓ + 2Na ++ 2Cl- vollständige Ionengleichung
Ba2 + + CO32- → BaCO3 ↓ verkürzte Ionengleichung.
Die abgekürzte Ionengleichung zeigt, dass, wenn eine lösliche Verbindung, die das Ba2 + -Ion enthält, mit der Verbindung interagiert, die das Carbonatanion CO32- enthält, das Ergebnis ein unlöslicher Niederschlag BaCO3 ↓ ist.
· 2. Gasentwicklung:
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2 &