Čo je nikel a ako vyzerá? Nikel (Ni): všetko o minerále a jeho úlohe v ľudskom živote
nikel- jednoduchá látka, ťažný, kujný, prechodný kov striebristo-bielej farby, pri bežnej teplote na vzduchu je pokrytý tenkým filmom oxidu. Chemicky neaktívny. Patrí medzi ťažké neželezné kovy v čistej forme na zemi - je zvyčajne súčasťou rôznych rúd, má vysokú tvrdosť, je dobre leštený, je feromagnetický - priťahovaný magnetom, v periodickom systéme Mendelejeva; je označený symbolom Ni a má 28. sériové číslo.
Pozri tiež:
ŠTRUKTÚRA
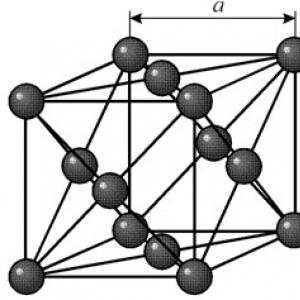
 Má plošne centrovanú kubickú mriežku s periódou a = 0,35238 å nm, priestorová grupa Fm3m. Táto kryštálová štruktúra je odolná voči tlaku najmenej 70 GPa. Za normálnych podmienok existuje nikel vo forme b-modifikácie, ktorá má plošne centrovanú kubickú mriežku (a = 3,5236 å). Ale nikel vystavený katódovému naprašovaniu v atmosfére h2 tvorí a-modifikáciu, ktorá má šesťuholníkovú mriežku s tesným usporiadaním (a = 2,65 å, c = 4,32 å), ktorá sa pri zahriatí nad 200 °C premení na kubickú mriežku. Kompaktný kubický nikel má hustotu 8,9 g/cm 3 (20 °C), atómový polomer 1,24 å
Má plošne centrovanú kubickú mriežku s periódou a = 0,35238 å nm, priestorová grupa Fm3m. Táto kryštálová štruktúra je odolná voči tlaku najmenej 70 GPa. Za normálnych podmienok existuje nikel vo forme b-modifikácie, ktorá má plošne centrovanú kubickú mriežku (a = 3,5236 å). Ale nikel vystavený katódovému naprašovaniu v atmosfére h2 tvorí a-modifikáciu, ktorá má šesťuholníkovú mriežku s tesným usporiadaním (a = 2,65 å, c = 4,32 å), ktorá sa pri zahriatí nad 200 °C premení na kubickú mriežku. Kompaktný kubický nikel má hustotu 8,9 g/cm 3 (20 °C), atómový polomer 1,24 å VLASTNOSTI
 Nikel je tvárny a tvárny kov, možno ho použiť na výrobu veľmi tenkých plechov a rúrok. Pevnosť v ťahu 400-500 MN/m2, medza pružnosti 80 MN/m2, medza klzu 120 MN/m2; relatívne predĺženie 40 %; modul normálnej pružnosti 205 Gn/m2; Tvrdosť podľa Brinella 600-800 Mn/m2. V teplotnom rozsahu od 0 do 631 K (horná hranica zodpovedá Curieho bodu). Feromagnetizmus niklu je spôsobený štruktúrnymi vlastnosťami vonkajších elektrónových obalov jeho atómov. Nikel je súčasťou najdôležitejších magnetických materiálov a zliatin s minimálnym koeficientom tepelnej rozťažnosti (permalloy, monel metal, invar a pod.).
Nikel je tvárny a tvárny kov, možno ho použiť na výrobu veľmi tenkých plechov a rúrok. Pevnosť v ťahu 400-500 MN/m2, medza pružnosti 80 MN/m2, medza klzu 120 MN/m2; relatívne predĺženie 40 %; modul normálnej pružnosti 205 Gn/m2; Tvrdosť podľa Brinella 600-800 Mn/m2. V teplotnom rozsahu od 0 do 631 K (horná hranica zodpovedá Curieho bodu). Feromagnetizmus niklu je spôsobený štruktúrnymi vlastnosťami vonkajších elektrónových obalov jeho atómov. Nikel je súčasťou najdôležitejších magnetických materiálov a zliatin s minimálnym koeficientom tepelnej rozťažnosti (permalloy, monel metal, invar a pod.).
REZERVY A VÝROBA
 Nikel je v prírode pomerne bežný – jeho obsah v zemskej kôre je asi 0,01 % (hm.). V zemskej kôre sa nachádza len vo viazanej forme, železné meteority obsahujú prírodný nikel (až 8 %). Jeho obsah v ultramafických horninách je približne 200-krát vyšší ako v kyslých horninách (1,2 kg/t a 8 g/t). V ultramafických horninách je prevládajúce množstvo niklu spojené s olivínmi obsahujúcimi 0,13 - 0,41 % Ni.
Nikel je v prírode pomerne bežný – jeho obsah v zemskej kôre je asi 0,01 % (hm.). V zemskej kôre sa nachádza len vo viazanej forme, železné meteority obsahujú prírodný nikel (až 8 %). Jeho obsah v ultramafických horninách je približne 200-krát vyšší ako v kyslých horninách (1,2 kg/t a 8 g/t). V ultramafických horninách je prevládajúce množstvo niklu spojené s olivínmi obsahujúcimi 0,13 - 0,41 % Ni.
V rastlinách je v priemere 5·10−5 hmotnostných percent niklu, u morských živočíchov - 1,6·10−4, u suchozemských živočíchov - 1·10−6, v ľudskom tele - 1...2·10 −6.
Väčšina niklu sa získava z garnieritu a magnetického pyritu.
Kremičitanová ruda sa redukuje uhoľným prachom v rotačných rúrových peciach na železo-niklové pelety (5-8 % Ni), ktoré sa potom očistia od síry, kalcinujú a spracujú roztokom amoniaku. Po okyslení roztoku sa z neho elektrolyticky získava kov.
Karbonylová metóda (Mondova metóda): Najprv sa zo sulfidovej rudy získa medeno-niklový kamienok, cez ktorý sa pod vysokým tlakom vedie CO. Vzniká vysoko prchavý tetrakarbonylnikel, ktorého tepelným rozkladom vzniká obzvlášť čistý kov.
Aluminotermická metóda získavania niklu z oxidovej rudy: 3NiO + 2Al = 3Ni +Al 2 O 3
ORIGIN
 Ložiská sulfidických medenoniklových rúd sú spojené s lopolitovitými alebo doskovitými masívmi vrstvených gabroidov obmedzených na zóny hlbokých zlomov na starovekých štítoch a plošinách. Charakteristickým znakom ložísk medi a niklu na celom svete je konzistentné minerálne zloženie rúd: pyrhotit, pentlandit, chalkopyrit, magnetit; Okrem nich rudy obsahujú pyrit, kubanit, polydymit, nikelit, millerit, violarit, minerály skupiny platiny, ojedinele chromit, arzenidy niklu a kobaltu, galenit, sfalerit, bornit, mackinawit, wallerit, grafit a prírodné zlato.
Ložiská sulfidických medenoniklových rúd sú spojené s lopolitovitými alebo doskovitými masívmi vrstvených gabroidov obmedzených na zóny hlbokých zlomov na starovekých štítoch a plošinách. Charakteristickým znakom ložísk medi a niklu na celom svete je konzistentné minerálne zloženie rúd: pyrhotit, pentlandit, chalkopyrit, magnetit; Okrem nich rudy obsahujú pyrit, kubanit, polydymit, nikelit, millerit, violarit, minerály skupiny platiny, ojedinele chromit, arzenidy niklu a kobaltu, galenit, sfalerit, bornit, mackinawit, wallerit, grafit a prírodné zlato.
Exogénne ložiská silikátových niklových rúd sú všeobecne spojené s jedným alebo druhým typom serpentenitovej zvetrávacej kôry. Pri zvetrávaní dochádza k etapovému rozkladu minerálov, ako aj prenosu mobilných prvkov pomocou vody z horných častí kôry do spodných. Tam sa tieto prvky vyzrážajú vo forme sekundárnych minerálov.
Ložiská tohto typu obsahujú zásoby niklu, ktoré sú 3-krát väčšie ako jeho zásoby v sulfidových rudách a zásoby niektorých ložísk dosahujú 1 milión ton a viac niklu. Veľké zásoby silikátových rúd sú sústredené v Novej Kaledónii, na Filipínach, v Indonézii, Austrálii a ďalších krajinách. Priemerný obsah niklu v nich je 1,1-2%. Okrem toho rudy často obsahujú kobalt.
APLIKÁCIA
Prevažná väčšina niklu sa používa na výrobu zliatin s inými kovmi (fe, cr, cu atď.), ktoré sa vyznačujú vysokými mechanickými, antikoróznymi, magnetickými alebo elektrickými a termoelektrickými vlastnosťami. V súvislosti s rozvojom tryskovej techniky a vytváraním agregátov plynových turbín sú dôležité najmä žiaruvzdorné a žiaruvzdorné chrómniklové zliatiny. Zliatiny niklu sa používajú v konštrukciách jadrových reaktorov.
Značné množstvo niklu sa spotrebuje pri výrobe alkalických batérií a antikoróznych náterov. Kujný nikel v čistej forme sa používa na výrobu plechov, rúr atď. Používa sa aj v chemickom priemysle na výrobu špeciálnych chemických zariadení a ako katalyzátor mnohých chemických procesov. Nikel je veľmi vzácny kov a ak je to možné, mal by byť nahradený inými, lacnejšími a bežnejšími materiálmi.
Používa sa pri výrobe konzolových systémov (nikelid titánu) a protetiky. Široko používaný pri výrobe mincí v mnohých krajinách. V Spojených štátoch je 5-centová minca hovorovo známa ako nikel. Nikel sa používa aj na navíjanie strún hudobných nástrojov.
Nikel - Ni
KLASIFIKÁCIA
| Strunz (8. vydanie) | 1/A.08-10 |
| Nickel-Strunz (10. vydanie) | 1.AA.05 |
| Dana (7. vydanie) | 1.1.17.2 |
| Dana (8. vydanie) | 1.1.11.5 | Ahoj, CIM Ref | 1.61 |
Kov bol prvýkrát získaný v nečistej forme v roku 1751 švédskym chemikom A. Kronstedtom, ktorý tiež navrhol názov prvku. Oveľa čistejší kov získal v roku 1804 nemecký chemik I. Richter. Názov „nikel“ pochádza z minerálu kupfernikel (NiAs), známeho už v 17. storočí a často zavádzajúceho baníkov svojou vonkajšou podobnosťou s medenými rudami (nem. Kupfer – meď, Nikel – horský lieh, údajne podsúva hlušinu baníkom namiesto ruda). Od polovice 18. storočia sa nikel používal len ako zložka zliatin vzhľadovo podobných striebru. Široký rozvoj niklového priemyslu na konci 19. storočia súvisel s objavením veľkých ložísk niklových rúd v Novej Kaledónii a Kanade a objavením jeho „zušľachťovacieho“ účinku na vlastnosti ocelí.
Distribúcia niklu v prírode. Nikel je prvkom zemských hlbín (v ultrabázických horninách plášťa je to 0,2 % hmotnosti). Existuje hypotéza, že zemské jadro pozostáva z niklového železa; V súlade s tým sa priemerný obsah niklu v pôde ako celku odhaduje na približne 3 %. V zemskej kôre, kde je nikel 5,8·10 -3%, tiež gravituje smerom k hlbšej, takzvanej čadičovej schránke. Ni v zemskej kôre je satelitom Fe a Mg, čo sa vysvetľuje podobnosťou ich valencie (II) a iónových polomerov; Nikel je obsiahnutý v mineráloch dvojmocného železa a horčíka ako izomorfná nečistota. Vlastné minerály niklu sú známe ako 53; väčšina z nich vznikla pri vysokých teplotách a tlakoch, pri tuhnutí magmy alebo z horúcich vodných roztokov. Ložiská niklu sú spojené s procesmi v magme a zvetrávacej kôre. Priemyselné ložiská niklu (sulfidové rudy) sa zvyčajne skladajú z minerálov niklu a medi. Na zemskom povrchu, v biosfére, je nikel relatívne slabým migrantom. V povrchových vodách a živej hmote je ho relatívne málo. V oblastiach, kde prevládajú ultramafické horniny, sú pôda a rastliny obohatené o nikel.
Fyzikálne vlastnosti niklu. Za normálnych podmienok existuje nikel vo forme β-modifikácie, ktorá má plošne centrovanú kubickú mriežku (a = 3,5236 Á). Ale nikel, podrobený katódovému rozprašovaniu v atmosfére H2, tvorí a-modifikáciu, ktorá má šesťuholníkovú mriežku tesne zhutnenej (a = 2,65 Á, c = 4,32 Á), ktorá sa pri zahriatí nad 200 °C premení na kubickú mriežku. Kompaktný kubický nikel má hustotu 8,9 g/cm 3 (20 °C), atómový polomer 1,24 Á, iónové polomery: Ni 2+ 0,79 Å, Ni 3+ 0,72 Å; tpl 1453 °C; teplota varu asi 3000 °C; merná tepelná kapacita pri 20°C 0,440 kJ/(kg K); teplotný koeficient lineárnej rozťažnosti 13,3·10 -6 (0-100 °C); tepelná vodivosť pri 25 °C 90,1 W/(m K); tiež pri 500 °C 60,01 W/(m K). Merný elektrický odpor pri 20°C 68,4 nom m, t.j. 6,84 μΩ cm; teplotný koeficient elektrického odporu 6,8·10 -3 (0-100 °C). Nikel je tvárny a tvárny kov, možno ho použiť na výrobu veľmi tenkých plechov a rúrok. Pevnosť v ťahu 400-500 MN/m2 (t.j. 40-50 kgf/mm2); medza pružnosti 80 Mn/m2, medza klzu 120 Mn/m2; relatívne predĺženie 40 %; modul normálnej pružnosti 205 Gn/m2; Tvrdosť podľa Brinella 600-800 Mn/m2. V teplotnom rozsahu od 0 do 631 K (horná hranica zodpovedá Curieho bodu) je nikel feromagnetický. Feromagnetizmus niklu je spôsobený štruktúrnymi vlastnosťami vonkajších elektrónových obalov (3d 8 4s 2) jeho atómov. Nikel patrí spolu s Fe (3d 6 4s 2) a Co (3d 7 4s 2), tiež feromagnetmi, k prvkom s nedokončeným 3d elektrónovým obalom (prechodové 3d kovy). Elektróny nedokončeného obalu vytvárajú nekompenzovaný spinový magnetický moment, ktorého efektívna hodnota pre atómy niklu je 6 μ B, kde μ B je Bohrov magnetón. Kladná hodnota výmennej interakcie v kryštáloch niklu vedie k paralelnej orientácii atómových magnetických momentov, to znamená k feromagnetizmu. Z rovnakého dôvodu sú zliatiny a množstvo zlúčenín niklu (oxidy, halogenidy a iné) magneticky usporiadané (majú fero- alebo menej obyčajne ferimagnetickú štruktúru). Nikel je súčasťou najdôležitejších magnetických materiálov a zliatin s minimálnym koeficientom tepelnej rozťažnosti (permalloy, monel metal, invar a iné).
Chemické vlastnosti niklu. Chemicky je Ni podobný Fe a Co, ale aj Cu a ušľachtilým kovom. V zlúčeninách vykazuje premenlivú mocnosť (najčastejšie 2-valentné). Nikel je stredne aktívny kov. Absorbuje (najmä v jemne rozdrvenom stave) veľké množstvo plynov (H 2, CO a iné); Nasýtenie niklu plynmi zhoršuje jeho mechanické vlastnosti. Reakcia s kyslíkom začína pri 500 °C; V jemne rozptýlenom stave je nikel samozápalný a na vzduchu sa samovoľne vznieti. Z oxidov je najdôležitejší NiO - zelenkasté kryštály, prakticky nerozpustné vo vode (minerálny bunsenit). Hydroxid sa vyzráža z roztokov solí niklu po pridaní alkálií vo forme objemnej jablkovozelenej zrazeniny. Pri zahrievaní sa nikel spája s halogénmi za vzniku NiX2. Horením v sírových parách vzniká sulfid, ktorý má podobné zloženie ako Ni 3 S 2. Monosulfid NiS možno pripraviť zahrievaním NiO so sírou.
Nikel nereaguje s dusíkom ani pri vysokých teplotách (do 1400 °C). Rozpustnosť dusíka v tuhom nikle je približne 0,07 % hmotn. (pri 445 °C). Ni3N nitrid možno pripraviť prechodom NH3 cez NiF2, NiBr2 alebo kovový prášok pri 445 °C. Vplyvom pár fosforu pri vysokých teplotách vzniká fosfid Ni 3 P 2 vo forme šedej hmoty. V systéme Ni-As bola preukázaná existencia troch arzenidov: Ni 5 As 2, Ni 3 As (maucheritový minerál) a NiAs. Mnohé metalidy majú štruktúru nikel-arzenidového typu (v ktorej atómy As tvoria hustú hexagonálnu vrstvu, ktorej všetky oktaedrické dutiny sú obsadené atómami Ni). Nestabilný karbid Ni 3 C možno získať pomalou (stovky hodín) nauhličovaním (cementovaním) niklového prášku v atmosfére CO pri 300 °C. Nikel v kvapalnom stave rozpúšťa citeľné množstvo C, ktorý sa pri chladnutí vyzráža vo forme grafitu. Keď sa grafit uvoľní, nikel stráca svoju tvárnosť a schopnosť spracovania pod tlakom.
V napäťovej sérii je Ni napravo od Fe (ich normálne potenciály sú -0,44 V a -0,24 V), a preto sa v zriedených kyselinách rozpúšťa pomalšie ako Fe. Nikel je odolný voči vode. Organické kyseliny pôsobia na nikel až po dlhšom kontakte s ním. Kyselina sírová a chlorovodíková pomaly rozpúšťajú nikel; zriedený dusík - veľmi jednoduché; koncentrovaná HNO 3 pasivuje nikel, ale v menšej miere ako železo.
Pri interakcii s kyselinami vznikajú soli 2-mocného Ni. Takmer všetky Ni(II) soli a silné kyseliny sú vysoko rozpustné vo vode, ich roztoky majú kyslú reakciu v dôsledku hydrolýzy. Soli relatívne slabých kyselín, ako je kyselina uhličitá a kyselina fosforečná, sú ťažko rozpustné. Väčšina solí niklu sa pri zahrievaní (600-800 °C) rozkladá. Jedna z najčastejšie používaných solí, síran NiSO 4, kryštalizuje z roztokov vo forme smaragdovo zelených kryštálov NiSO 4 ·7H 2 O - síran nikelnatý. Silné alkálie nepôsobia na nikel, ale rozpúšťa sa v roztokoch amoniaku v prítomnosti (NH 4) 2 CO 3 za vzniku rozpustného amoniaku, sfarbeného intenzívne do modra; Väčšina z nich sa vyznačuje prítomnosťou komplexov 2+ a . Hydrometalurgické metódy získavania niklu z rúd sú založené na selektívnej tvorbe amoniaku. NaOCl a NaOBr sa vyzrážajú z roztokov Ni(II) solí, Ni(OH)hydroxid 3 je čierny. V komplexných zlúčeninách je Ni, na rozdiel od Co, zvyčajne 2-valentný. Na analytické stanovenie Ni sa používa komplexná zlúčenina Ni s dimetylglyoxímom (C 4 H 7 O 2 N) 2 Ni.
Pri zvýšených teplotách nikel interaguje s oxidmi dusíka, SO2 a NH3. Keď CO pri zahrievaní pôsobí na jemne mletý prášok, vytvára sa karbonyl Ni(CO)4. Tepelnou disociáciou karbonylu vzniká najčistejší nikel.
Príjem niklu. Asi 80 % niklu z jeho celkovej produkcie sa získava zo sulfidických medenoniklových rúd. Po selektívnom obohatení flotáciou sa z rudy oddelia koncentráty medi, niklu a pyrhotit. Koncentrát niklovej rudy zmiešaný s tavivami sa taví v elektrických šachtách alebo dozvukových peciach, aby sa oddelila odpadová hornina a extrahoval nikel do sulfidovej taveniny (kamene) obsahujúcej 10-15 % Ni. Elektrickému taveniu zvyčajne predchádza čiastočné oxidačné praženie a aglomerácia koncentrátu. Spolu s Ni prechádza do matovania časť Fe, Co a takmer všetka Cu a ušľachtilé kovy. Po oddelení Fe oxidáciou (vyfukovaním tekutého kamínku v konvertoroch) sa získa zliatina sulfidov Cu a Ni - kamienok, ktorý sa pomaly ochladzuje, jemne melie a posiela na flotáciu na oddelenie Cu a Ni. Niklový koncentrát sa vypáli vo fluidnom lôžku na NiO. Kov sa získava redukciou NiO v elektrických oblúkových peciach. Anódy sú odlievané z hrubého niklu a elektrolyticky rafinované. Obsah nečistôt v elektrolytickom nikle (trieda 110) je 0,01 %.
Na oddelenie Cu a Ni sa používa aj takzvaný karbonylový proces založený na reverzibilite reakcie: Ni + 4CO = Ni(CO) 4. Výroba karbonylu sa uskutočňuje pri 100-200 atm a pri 200-250 °C a jeho rozklad prebieha bez prístupu vzduchu pri atm. tlaku a asi 200 °C. Rozklad Ni(CO) 4 sa využíva aj na výrobu niklových povlakov a výrobu rôznych produktov (rozklad na zahriatej matrici).
V moderných „autogénnych“ procesoch sa tavenie uskutočňuje pomocou tepla uvoľneného počas oxidácie sulfidov vzduchom obohateným kyslíkom. To umožňuje eliminovať uhlíkaté palivá, získať plyny bohaté na SO 2 vhodné na výrobu kyseliny sírovej alebo elementárnej síry a tiež dramaticky zvýšiť účinnosť procesu. Najkompletnejšia a najsľubnejšia je oxidácia kvapalných sulfidov. Postupy založené na úprave niklových koncentrátov roztokmi kyselín alebo amoniaku v prítomnosti kyslíka pri zvýšených teplotách a tlaku (autoklávové procesy) sú čoraz bežnejšie. Typicky sa nikel prevedie do roztoku, z ktorého sa izoluje vo forme bohatého sulfidového koncentrátu alebo kovového prášku (redukciou vodíkom pod tlakom).
Z kremičitanových (oxidovaných) rúd možno nikel koncentrovať aj do kamínku zavedením taviva - sadry alebo pyritu - do taviacej vsádzky. Redukčno-sulfidačné tavenie sa zvyčajne vykonáva v šachtových peciach; výsledný mat obsahuje 16-20% Ni, 16-18% S, zvyšok je Fe. Technológia extrakcie niklu z matného kameňa je podobná tej, ktorá je opísaná vyššie, okrem toho, že operácia separácie Cu sa často vynecháva. Ak je obsah Co v oxidovaných rudách nízky, je vhodné ich podrobiť redukčnému taveniu na výrobu feronikelu, ktorý sa používa na výrobu ocele. Na extrakciu niklu z oxidovaných rúd sa využívajú aj hydrometalurgické metódy - čpavkové lúhovanie predredukovanej rudy, autoklávové lúhovanie kyselinou sírovou a iné.
Použitie niklu. Prevažná väčšina Ni sa používa na výrobu zliatin s inými kovmi (Fe, Cr, Cu a iné), ktoré sa vyznačujú vysokými mechanickými, antikoróznymi, magnetickými alebo elektrickými a termoelektrickými vlastnosťami. V súvislosti s rozvojom tryskovej techniky a vytváraním agregátov plynových turbín sú dôležité najmä žiaruvzdorné a žiaruvzdorné chrómniklové zliatiny. Zliatiny niklu sa používajú v konštrukciách jadrových reaktorov.
To znamená, že množstvo niklu sa spotrebuje na výrobu alkalických batérií a antikoróznych náterov. Kujný nikel v čistej forme sa používa na výrobu plechov, rúr atď. Používa sa tiež v chemickom priemysle na výrobu špeciálnych chemických zariadení a ako katalyzátor mnohých chemických procesov. Nikel je veľmi vzácny kov a ak je to možné, mal by byť nahradený inými, lacnejšími a bežnejšími materiálmi.
Spracovanie niklových rúd je sprevádzané uvoľňovaním toxických plynov obsahujúcich SO 2 a často As 2 O 3. CO používaný pri rafinácii niklu karbonylovou metódou je veľmi toxický; Ni(CO)4 je vysoko toxický a vysoko prchavý. Jeho zmes so vzduchom exploduje pri 60 °C. Kontrolné opatrenia: tesnosť zariadenia, zvýšená ventilácia.
Nikel je nevyhnutným stopovým prvkom v tele. Jeho priemerný obsah v rastlinách je 5,0·10 -5% suroviny, v tele suchozemských živočíchov 1,0·10 -6%, u morských živočíchov - 1,6·10 -4%. V tele zvierat sa nikel nachádza v pečeni, koži a endokrinných žľazách; sa hromadí v keratinizovaných tkanivách (najmä perie). Zistilo sa, že nikel aktivuje enzým arginázu a ovplyvňuje oxidačné procesy; v rastlinách sa zúčastňuje množstva enzymatických reakcií (karboxylácia, hydrolýza peptidových väzieb a iné). Na pôdach obohatených niklom sa jeho obsah v rastlinách môže zvýšiť 30-krát a viac, čo vedie k endemickým ochoreniam (u rastlín - škaredé formy, u zvierat - ochorenia očí spojené so zvýšenou akumuláciou niklu v rohovke: keratitída, keratokonjunktivitída).
Interakcie niklu v tele
Hlavným zdrojom niklu vstupujúceho do ľudského tela je jedlo a voda. Z potravy sa absorbuje až 10% niklu z vody sa absorbuje rýchlejšie a úplnejšie - absorpcia látky sa zvyšuje na 25%. Kyselina chlorovodíková už v žalúdku začína ovplyvňovať nikel, čím podporuje jeho vstrebávanie do krvi, zvyšná látka sa vstrebáva v tenkom čreve. Ďalej sa nikel spája so sérovými proteínmi v krvnej plazme (alfa1-glykoproteín, nikeloplazmín atď.) a krvou sa prenáša do orgánov. Takmer všetok zvyškový nikel sa vylučuje cez črevá stolicou, iba 5 % zvyškového niklu sa vylučuje močom a žlčou.
Napriek nízkej chemickej aktivite niklu má v tele pomerne aktívne interakčné reakcie, ktoré je užitočné vziať do úvahy pri kontrole absorpcie tejto látky. V prítomnosti vitamínu B12 nikel stimuluje kontraktilitu a rast svalových vlákien (a ak je tohto vitamínu v tele málo, nikel naopak svalový tonus znižuje. Prítomnosť vitamínu C zhoršuje vstrebávanie niklu. Tým, ovplyvňovaním vylučovania prebytočných steroidných hormónov, nikel údajne bráni zadržiavaniu sodíka a vody, odstraňuje opuchy a tiež zachováva vápnik v kostnom tkanive, čím bráni rozvoju osteoporózy. Ak telo pociťuje nedostatok železa, miesto tohto prvku je nahradené molekulami niklu Absorpcia niklu sa zvyšuje počas tehotenstva a dojčenia, čo sa vysvetľuje potrebou tohto chemického prvku na syntézu hormónov, ktoré sú zodpovedné za tehotenstvo a laktáciu.
Zinok, selén a síra v potravinách a bioaktívnych doplnkoch zhoršujú vstrebávanie niklu. Spolu s meďou a kobaltom sa nikel podieľa na syntéze červených krviniek a iných krvných prvkov.
Základné funkcie v tele

V ľudskom tele sa nikel koncentruje hlavne v hypofýze, pankrease a nadobličkách – najdôležitejších žľazách endokrinného systému, ktoré produkujú endorfín, rastový hormón a ďalšie hormóny, ktoré plnia nasledujúce funkcie:
- sú zodpovedné za nosenie a kŕmenie dieťaťa;
- stimulovať produkciu melanínu, kožného pigmentu, ktorý ju chráni pred UV žiarením;
- aktivovať štítnu žľazu;
- zlepšiť kontraktilitu svalov;
- pomoc pri tvorbe inzulínu.
Úloha niklu v hormónotvornej aktivite endokrinného systému sa stále skúma, existujú však dôkazy, že nikel upokojuje nervový systém a znižuje aktivitu adrenalínu. Obličky vďaka niklu zvyšujú produkciu hormónu erytropoetínu, ktorý je zodpovedný za tvorbu červených krviniek a zásobovanie všetkých tkanív kyslíkom. Úloha niklu pri regulácii akumulácie a vylučovania moču produkovaného nadobličkami nadbytku steroidných hormónov bola potvrdená. Vďaka tomu sa znižuje krvný tlak, reguluje sa hladina glukózy v krvi a urýchľuje sa regenerácia tkanív v tele.
Ďalším orgánom na ukladanie niklu je pečeň, kde sa prvok podieľa na syntéze pre telo nevyhnutných aminokyselín, ktoré sú súčasťou štruktúry bunkovej DNA a RNA, posilňujú imunitný systém, zlepšujú fungovanie srdce a cievy, bojujú proti zápalom a urýchľujú obnovu tkaniva po ňom, kontrolujú telesnú hmotnosť, zabraňujú nekontrolovanému deleniu buniek.
Nikel sa podieľa na oxidačných a redukčných reakciách rôznych organických zlúčenín dôležitých pre fungovanie organizmu, je nevyhnutný pre tvorbu niektorých enzýmov, bez ktorých sa vitamíny, tuky a sacharidy nedajú absorbovať.
Výhody niklu pre telo
Výhody niklu pre telo sú málo pochopené, ale keďže aktívne ovplyvňuje množstvo najdôležitejších procesov v orgánoch a systémoch, možno poukázať na tieto prospešné vlastnosti:
- znižuje prejavy arteriálnej hypertenzie;
- reguluje metabolizmus tukov a sacharidov, ovplyvňuje chudnutie;
- zmierňuje nervové vzrušenie;
- zvyšuje hemoglobín v krvi;
- zlepšuje absorpciu inzulínu;
- zvyšuje imunitu;
- posilňuje kardiovaskulárny systém.
Prípravky obsahujúce nikel sa aktívne používajú v trichológii - tento prvok zvyšuje prietok krvi v oblasti vlasových folikulov a zlepšuje ich zásobovanie kyslíkom, čo pomáha znižovať vypadávanie vlasov.
Úloha pri výskyte a priebehu rôznych chorôb
Je dokázaný vplyv niklu na aktiváciu inzulínu. Ak túto látku podáte ihneď po inzulíne pri diabetes mellitus, hypoglykemická aktivita lieku sa výrazne zvýši a môže sa užívať menej často. U starších ľudí sa nikel začína hromadiť v pľúcach a vzhľadom na pravdepodobné spojenie tejto látky s hormonálnou aktivitou tela vedci naznačujú vplyv niklu na aktivitu pľúcnych hormónov súvisiacu s vekom, čo môže zvýšiť prejavy bronchiálnej astmy.
Nadmerné hromadenie niklu v tele vyvoláva depigmentáciu kože – vitiligo. Vplyv niklu na produkciu histamínu v tele urobil z tohto kovu jeden z najznámejších alergénov: asi 15 % ľudí na svete je alergických na zlúčeniny niklu, ktoré sa používajú na výrobu šperkov, hodiniek, spojovacích materiálov a nitov na odevy – toto má za následok podráždenie a svrbivé vyrážky na koži.
Aké potraviny obsahujú nikel?

Štvrtina niklu, ktorý sa denne dostáva do nášho tela, pochádza z vody z vodovodu. Voda obsahuje najmä veľa tohto chemického prvku ráno, keď už dlho stojí v potrubí. Šampiónmi v obsahu niklu sú kakaový prášok (980 mcg/100 g hmotnosti výrobku), horká čokoláda (260 mcg) a mliečna čokoláda (120 mcg). Za dôvody takého vysokého obsahu niklu v týchto výrobkoch sa považuje používanie poniklovaných zariadení a nádob na skladovanie a spracovanie čokoládových surovín.
Nikel v niektorých potravinách (µg na 100 g)
| Obilniny | Strukoviny, orechy | Mäso, ryby | Zelenina, ovocie | ||||
| Kukuričná krupica | 80 | Kešu | 510 | Hovädzia pečeň | 63 | Špenát | 390 |
| Ovsené vločky | 50 | Sójové bôby | 304 | Údená makrela | 28 | Marhule | 32 |
| Ryža | 50 | Zelený hrášok | 250 | Šproty v oleji | 14 | Hruška | 18 |
| Pšenica | 40 | Fazuľa | 170 | Bravčové mäso | 12 | Hrozno | 16 |
| Žitný | 30 | Šošovica | 160 | Treska škvrnitá | 9 | Biela kapusta | 15 |
| Perlový jačmeň | 20 | Pistácie | 40 | Hovädzie mäso | 8 | Paradajky | 13 |
Rada lekára. Tí, ktorí dodržiavajú diétu založenú na rastlinných bielkovinách, musia vo svojom jedálnom lístku racionálne rozmiestniť strukoviny a obilniny bohaté na bielkoviny, aby sa nepredávkovali niklom
Alergici na nikel by sa mali snažiť vyhýbať potravinám s vysokým obsahom niklu vo svojej strave.
Ako uchovať nikel v potravinách
Výrobky s vysokým obsahom niklu (obilniny, strukoviny) by sa nemali skladovať otvorené na priamom slnku, pretože kov môže vytvárať rôzne oxidy, ktoré sa môžu hromadiť v tele. Na druhej strane nemôžete potraviny skladovať v poniklovaných nádobách dlhšie ako dva dni - zvyšuje sa riziko prenosu niklu do potravín a nadmerné hromadenie minerálu v orgánoch a tkanivách.
Minerálna stráviteľnosť
Alergici by tiež mali pamätať na to, že kofeínové nápoje a pivo obsahujú nikel, ktorý sa zle vstrebáva a môže zhoršiť podráždenie pokožky.
Vstrebávanie niklu sa výrazne zhoršuje, ak pijete čaj, kávu, mlieko, pomarančový džús spolu s výrobkami, ktoré ho obsahujú, alebo si jedlo dopĺňate ovocnými a bobuľovými dezertmi z citrusových plodov, kivi, čiernymi ríbezľami a inými výrobkami, ktoré obsahujú veľa askorbovej kyselina.
Kombinácia s inými živinami
Nikel ľahko interaguje s bielkovinami a organickými kyselinami (citrónová, jablčná, octová atď.), čím napomáha ich vstrebávaniu. Je dôležité kombinovať nikel s potravinami, ktoré sú bohaté na tuky a sacharidy. Bez niklu sa tuky dodávané so živinami nerozložia na mastné kyseliny a glycerol, ktoré sa ľahko vstrebávajú, a neuvoľní sa energia, ktorú telo potrebuje zo sacharidov.
Denné normy niklu

Biologická úloha niklu v ľudskom organizme ešte nie je presne stanovená, preto neexistujú vedecky podložené normy pre spotrebu tohto kovu a jeho potreby sú podložené väčšinou na základe pozorovaní. Denná norma niklu pre ľudí je stanovená v rozmedzí od 100 do 300 mcg. Potravou a vodou prijmeme každý deň asi 600 mcg niklu, ale neabsorbujeme viac ako štvrtinu prijatého množstva, takže pri vyváženej strave je nedostatok alebo nadbytok tejto látky zriedkavý.
Príčiny a dôsledky nedostatku niklu
Ak telo dostáva menej ako 50 mcg niklu denne, môže sa vyvinúť stav nedostatku. Príčinou nedostatku niklu môžu byť okrem nesprávnej výživy (napríklad strava založená len na ovocí alebo džúsoch, pohánke či káve) niektoré ochorenia žalúdka a čriev, ktoré zhoršujú vstrebávanie niklu, ťažká anémia, srdce choroba.
Rada lekára. Pri chronickom únavovom syndróme, pri fyzickom a psychickom vypätí, po infekčných ochoreniach potrebuje organizmus zvýšený prísun niklu z potravy
Pri arteriálnej hypertenzii, diabetes mellitus a niektorých dermatologických ochoreniach je potrebné po konzultácii s lekárom doplniť stravu o nikel. Pri manipulácii s niklom by mali byť obzvlášť opatrné tehotné a dojčiace ženy. Na jednej strane nikel podporuje otehotnenie a ovplyvňuje laktáciu, na druhej strane je to toxický prvok, preto akékoľvek doplnky stravy, vitamínové komplexy, dokonca aj zmeny jedálneho lístka v prospech potravín bohatých na nikel treba konzultovať s lekárom.
Medzi príznaky nedostatku niklu patrí svalová slabosť a celková letargia a nedostatok túžby po pohybe. Odolnosť tela voči vírusom a baktériám klesá, infekčné ochorenia sa často rozvíjajú a sú dlhé a ťažké. Ak sa opatrenia neprijmú po dlhú dobu, hladina hemoglobínu sa výrazne zníži, hladina cukru v krvi sa zvýši, srdcová činnosť sa naruší, vyvinú sa patológie pečene a objavia sa dermatózy.
Nadbytok niklu v tele
Nadmerná akumulácia niklu v tele sa vyskytuje oveľa častejšie ako stavy nedostatku a vyskytuje sa v dôsledku kombinácie dôvodov:
- neustále používanie poniklovaného riadu a skladovanie potravín v nich;
- jesť veľké množstvo potravín bohatých na nikel;
- zvýšený obsah niklu v zelenine a ovocí v dôsledku ich pestovania v pôdach a vodách kontaminovaných týmto prvkom;
- vysoký obsah niklu vo vode z vodovodu;
- zneužívanie konzervovaných potravín (obsahujú veľa niklu z plechovky);
- nosenie šperkov, hodiniek vyrobených zo zliatin niklu;
- nekvalitné zubné protézy alebo strojčeky s uvoľneným niklom;
- vdychovanie tabakového dymu, výfukových plynov;
- zneužívanie elektronických cigariet.
Predávkovanie niklom možno dosiahnuť vdychovaním pár alebo prachu so zlúčeninami tohto prvku v podmienkach priemyselnej výroby pri práci s liekmi, pretože nikel sa môže hromadiť v tele. Najnebezpečnejšie sú síran a chlorid nikelnatý - tieto zlúčeniny sa rozpúšťajú vo vode a rýchlo sa vstrebávajú.
Oxaláty, silikáty a fosforečnany niklu sú nerozpustné vo vode, a preto sú menej toxické.
Akútna otrava v dôsledku prebytku niklu sa môže vyskytnúť, keď sa do tela dostane jednotlivá dávka viac ako 50 mg látky. V tomto prípade sa objavuje bolesť v správnom hypochondriu, dýchavičnosť, nevoľnosť a bolesti hlavy.
Dôležité! Vysoká hladina niklu v krvi pri laboratórnom teste môže byť prvým príznakom rozvíjajúceho sa infarktu myokardu
Chronická intoxikácia niklom sa prejavuje:
- zápaly kože – keratitída, kontaktná dermatitída;
- vredy na rohovke očí;
- časté krvácanie z nosa;
- rinitída, ochorenia dýchacích ciest;
- nervové poruchy, podráždenosť a excitabilita;
- poruchy srdcového rytmu;
- tráviace problémy.
V pokročilých formách ohrozuje nadbytok niklu edém mozgu a pľúc, stukovatenie pečene, zlyhanie obličiek a rozvoj rakoviny pľúc a žalúdka.
Prvou pomocou pri akútnej otrave niklom môže byť podanie unitiolu (dithiolpropánsulfonát sodný), ktorý nikel pevne viaže a odstraňuje. Podľa indikácií sa používa symptomatická terapia a zo stravy sú vylúčené potraviny obsahujúce nikel.
Prípravky obsahujúce minerál
Ak nie je možné kompenzovať nedostatok niklu zo stravy, lekár môže odporučiť doplnky stravy alebo vitamínové komplexy obsahujúce nikel (napríklad Vitalgin, Vitrum). Tablety alebo kapsuly lieku sa zvyčajne užívajú raz denne s jedlom, ale dĺžku užívania a dávkovanie musí zvoliť lekár, pretože nikel je toxický kov s nepríjemnými vedľajšími účinkami.
nikel- tvárny strieborno-biely kov so silným leskom. Je ľahko prístupný fyzickému nárazu a lešteniu, ale vykazuje nízku chemickú aktivitu a podlieha oxidácii iba pri vystavení teplote.
Hmotu možno nazvať „kozmickou“, pretože prvé vzorky prišli ľudstvu doslova z neba. V dávnych dobách ľudia roztavili tento meteoritový kov na zbrane a talizmany.
Pôvod mena má pečať mágie, vraj zlý škriatok „Starý Nick“ pôsobil v baniach v Sasku a premieňal medenú rudu na nepoužiteľnú. Slovo „nikel“ vyjadrovalo pohŕdanie minerálom kupfernikel alebo „falošnou meďou“. Následne sa ukázalo, že baníci našli ložiská niklu, ktorý starí Číňania používali na výrobu luxusného tovaru.
V Starom a Novom svete sa používal na razenie peňazí, šperkov a dokončovacie práce.
Prvok bol objavený v čistej forme v roku 1751, čo nebolo veľmi šťastné, pretože Vtedy ešte panoval silný názor, že počet kovov by mal zodpovedať počtu planét slnečnej sústavy.
 Kov sa aktívne používa vo vojenskom priemysle, strojárstve a dokonca sa používa na výrobu drôtov pre podmorské káble. Bolo by ťažké čo i len vymenovať všetky oblasti priemyslu, vedy a techniky, kde je jej využitie relevantné. Dokonca sa pridáva do kozmetiky a chemikálií pre domácnosť a medicína používa jeho zliatiny na výrobu implantátov.
Kov sa aktívne používa vo vojenskom priemysle, strojárstve a dokonca sa používa na výrobu drôtov pre podmorské káble. Bolo by ťažké čo i len vymenovať všetky oblasti priemyslu, vedy a techniky, kde je jej využitie relevantné. Dokonca sa pridáva do kozmetiky a chemikálií pre domácnosť a medicína používa jeho zliatiny na výrobu implantátov.
Vedci sa domnievajú, že na našej planéte je veľa niklu a jeho približný obsah je asi 3% celej zemskej kôry.
Pôsobenie niklu
Účinok makroprvku na ľudské telo nebol úplne preskúmaný, ale funkcie, na ktorých sa zúčastňuje, sú dôležité samy osebe:
- podieľa sa na hematopoéze v kombinácii s meďou, železom a kobaltom;
- zvyšuje produktivitu inzulínu;
- podieľa sa na tvorbe a fungovaní nosičov genetickej informácie DNA a RNA, bielkovín;
- je dodávateľom kyslíka tkanivovým bunkám;
- s jeho účasťou sa aktivuje množstvo enzýmov;
- zlepšuje činnosť obličiek a hypofýzy;
- podporuje hormonálnu reguláciu;
- zvyšuje rast svalového tkaniva, ale iba v prítomnosti vitamínu B12, inak bude proces obrátený;
- znižuje krvný tlak.

Všetky tieto procesy sa môžu vyskytnúť v dôsledku skutočnosti, že prvok sa hromadí v hlavných orgánoch ľudského tela: mozgu, obličkách, pečeni, pľúcach, svaloch, koži, pankrease a štítnej žľaze. Najväčšie množstvo sa ho nachádza v hypofýze a žľazách, ktoré sú zodpovedné za metabolické procesy v tele. Tu dochádza k syntéze základných vitamínov, hormónov a iných prospešných látok.
Je zaujímavé, že s vekom sa môže koncentrácia prvku v pľúcach zvyšovať.
Prvok sa z tela vylučuje najmä výkalmi a oveľa menej potením a žlčou.
Denná norma
Denná norma makroživiny sa podľa rôznych zdrojov pohybuje od 60 do 300 mcg. Naše telo je schopné absorbovať väčšinu z potravy, takže nedostatok látky je pomerne zriedkavý jav.
Potreba navyše silne závisí od množstva príjmu železa – priamo úmerne stúpa a naopak. To platí najmä pre ženy počas tehotenstva.
Nedostatok niklu v tele
- Nedostatok makronutrientu sa môže negatívne prejaviť, ak telo dlhodobo prijíma menej ako 50 mcg denne, čo môže spôsobiť negatívne následky v podobe dermatitídy. Podľa klinických experimentov sú možné aj nasledujúce procesy:
- porušenie hladín glukózy a hemoglobínu;
- zmeny kostného tkaniva, ich rast a regenerácia;
- narušenie metabolizmu vápnika, železa a vitamínu B12;

zmena bunkovej štruktúry a membrány.
Stráviteľnosť sa výrazne znižuje pri konzumácii potravín s obsahom kyseliny askorbovej, ako aj pri pití kávy, čaju a mlieka. Na zvýšenie niklu v tele by ste nemali používať lieky sami, pretože výsledky môžu byť katastrofálne. Prvok v potravinách je absolútne netoxický, čo sa o ňom v liekoch povedať nedá.
Nemali by ste riskovať, aby ste sa vyhli možným mutačným procesom v bunkách a vzniku nádorov.
Nadbytok niklu a následky otravy ním
Nadbytok makroživiny je oveľa bežnejší ako nedostatok. Dôvodom sú domáce a priemyselné faktory, kde sa používa vo vode rozpustný chlorid a síran nikelnatý. V tele sa tiež môže hromadiť niklový prach, čo je typické pre priemyselné spracovanie kovov. V každodennom živote je možné nadbytok prvku získať použitím šperkov nízkej kvality, zubných protéz a riadu. Je pravda, že v tomto prípade je prebytok stále zanedbateľný.
Za toxickú dávku sa považuje konzumácia viac ako 40 mg denne.
Otrava niklom má negatívne dôsledky:

Otravy môžu byť dosť vážne a dokonca smrteľné už za hodinu a pol. Napríklad karbonylové zlúčeniny niklu sú klasifikované ako trieda nebezpečnosti 1, čo naznačuje ich extrémne poškodenie ľudského tela.
Existujú však aj iné, dosť nebezpečné choroby, ktoré môžu vzniknúť v dôsledku toxických účinkov zlúčenín niklu - anémia, pľúcny a cerebrálny edém, tachykardia, alergie. Dokonca je možný vznik nádorov kože, obličiek a pľúc. Na tomto pozadí vyzerá všeobecná nadmerná excitácia nervového systému ako menšia nepríjemnosť. Ale nepridá to nič dobré. Pracovať v špecializovaných odvetviach počas tehotenstva je pre ženy jednoducho nebezpečné, pretože... plod dostáva plnú zásobu niklu vďaka úplnej priepustnosti placenty a to zase môže viesť k samovoľným potratom a vývojovým chybám.
Najčastejším negatívnym účinkom niklu na telo je alergia, najmä nežné pohlavie je náchylné na nosenie doplnkov a šperkov, často pochybnej kvality a výroby. Vyjadruje sa vo forme kontaktnej dermatitídy - vyrážka, začervenanie, svrbenie.
Čo obsahuje tento prvok?
Potravinárske výrobky obsahujúce nikel sú veľmi rozmanité a úplne dostupné. Nakoniec sa aspoň jeden prvok zľutoval a rozhodol sa, že sa v čokoláde nahromadí vo veľkom množstve! Bohaté naň sú aj kakaové bôby, orechy, čaj, strukoviny, obilniny, obilniny, pohánka, cibuľa, petržlen, mrkva, huby, marhule a čierne ríbezle. Dávajte pozor na pôvod týchto produktov, pretože rastliny pestované na pozemkoch „znečistených“ niklom môžu byť týmto prvkom presýtené.
 Živel je možné zásobovať aj pitnou vodou, najmä ráno vo veľkých množstvách, pretože voda cez noc vo vodovode stagnuje a koncentrácia sa môže zvýšiť.
Živel je možné zásobovať aj pitnou vodou, najmä ráno vo veľkých množstvách, pretože voda cez noc vo vodovode stagnuje a koncentrácia sa môže zvýšiť.
Hoci produkty živočíšneho pôvodu nemôžu súťažiť o vedúce postavenie v bohatstve niklu, morské ryby a iné morské plody, mäso, pečeň, vajcia a mliečne výrobky môžu stále obohatiť našu stravu.
Pri zostavovaní jedálneho lístka vezmite do úvahy skutočnosť, že vitamín C, čaj, mlieko a káva znižujú schopnosť tela absorbovať prvok. Ale absencia vápnika a horčíka má opačný efekt.
Indikácie na použitie
Indikácie na použitie makroživín sú už od 19. storočia najmä pri liečbe kožných ochorení. Dnes lieky s obsahom niklu úspešne bojujú proti psoriáze. Nikel sa používa aj ako pomocná zložka pri veľkých krvných stratách na stimuláciu syntézy červených krviniek vo forme subkutánnych injekcií.
O objave sa dlho diskutovalo: súčasníci tomu verili nikel- nejde o nezávislý kov, ale o zliatinu už známych kovov s arzénom a sírou. Kronstedt trval na individualite niklu a ako „fyzikálny dôkaz“ uviedol najmä zelenú farbu jeho zlúčenín a ľahkú interakciu tohto „polokovu“ so sírou. Kronstedt musel bojovať nielen s fyzikálno-chemickými, ale aj s astrologickými argumentmi svojich odporcov. "Počet kovov už prevyšuje počet planét nachádzajúcich sa v slnečnom kruhu," napísal Kronstedt, "preto sa teraz netreba báť znásobenia počtu kovov."
Ale Kronstedt zomrel v roku 1765 bez toho, aby čakal na uznanie svojho objavu. A dokonca 10 rokov po jeho smrti bolo vo Francúzskej encyklopédii, najvyššom súbore vedomostí tej doby, vytlačené: „Zdá sa, že je potrebné vykonať ďalšie experimenty, aby nás presvedčili, či tento „niklový“ chrobák, ktorého p. Kronstedt hovorí o špeciálnom polokove, existuje, alebo by sa mal skôr považovať za zlúčeninu železa, arzénu, bizmutu, kobaltu a dokonca aj medi so sírou.
V roku 1775 publikoval Kronstedtov krajan, chemik a metalurg T. Bergman svoj výskum, ktorý mnohých presvedčil, že nikel je skutočne novým kovom. Debata ale definitívne utíchla až začiatkom 19. storočia, keď sa niekoľkým významným chemikom po prvý raz podarilo izolovať čistý nikel. Bol medzi nimi aj J. L. Proust, autor zákona o stálosti zloženia chemických zlúčenín; Je zaujímavé, že Proust považoval zvláštnu sladkastú chuť roztoku síranu nikelnatého, výrazne odlišnú od nepríjemnej chuti síranu meďnatého, za dôležitý argument v prospech individuality niklu. Ďalší francúzsky chemik L. J. Tenard konečne objasnil magnetické vlastnosti niklu (na ich jedinečnosť upozornil už Bergman).
Polstoročie výskumného úsilia zhrnul Jeremiah Richter, ktorý je v histórii chémie známejší ako jeden zo zakladateľov stechiometrie. Na získanie čistého niklu Richter po vypálení NiAs cupferniklu na vzduchu (na odstránenie väčšiny arzénu), jeho redukcii uhlím a rozpustení guľôčok v kyseline, vykonal 32 rekryštalizácií síranu nikelnatého a potom z týchto kryštálov získal čistý kov. Nikel získaný týmto „veľmi náročným spôsobom“ opísal Richter v roku 1804 v článku „O absolútne čistom nikle, ušľachtilom kove, jeho výrobe a špeciálnych vlastnostiach“.
Richterov článok vstúpil do histórie prvku č. 28 ako prorocký: naznačoval takmer všetky charakteristické črty niklu, ktoré z neho urobili jeden z najdôležitejších kovov modernej techniky - vysokú odolnosť proti korózii, tepelnú odolnosť, vysokú ťažnosť a kujnosť, magnetické vlastnosti. Tieto vlastnosti určovali cesty, po ktorých nikel smeroval človek.
Kovový nikel...
Klenotníci prišli s prvým využitím niklu. Pokojný, ľahký lesk niklu (pamätajte na Majakovského: „Nalial som lunárny nikel na dlažobné kocky“) vo vzduchu nezmizne. Okrem toho je nikel pomerne ľahko spracovateľný. Preto ho začali používať na výrobu šperkov, riadu a tvrdých mincí.
Ale prvok č.28 toto veľmi bezvýznamné pole pôsobnosti nedostal hneď, pretože nikel, ktorý hutníci tavili, sa vôbec nepodobal ušľachtilému kovu, ktorý opísal Richter. Bol krehký a prakticky nevhodný na spracovanie.
Neskôr sa ukázalo, že na úplné zničenie mechanických vlastností niklu stačí nepatrná (podľa noriem spred sto rokov) sírová nečistota - iba 0,03%; To sa deje v dôsledku skutočnosti, že najtenší film krehkého sulfidu niklu oddeľuje zrná kovu a narúša jeho štruktúru. Približne rovnaký vplyv na vlastnosti tohto kovu má aj kyslík.
Problém získavania kujného niklu vyriešil jeden objav. Pridaním horčíka do roztaveného kovu pred odlievaním sa nikel zbaví nečistôt: horčík aktívne viaže a „preberá“ síru a kyslík. Tento objav bol urobený ešte v 70. rokoch minulého storočia a odvtedy začal dopyt po nikle rásť.
Čoskoro sa ukázalo, že prvok č. 28 nie je len dekoratívny kov (hoci niklovanie sa používa už asi sto rokov ako prostriedok na ochranu iných kovov pred koróziou a na dekoratívne účely). Nikel sa ukázal byť jedným z najsľubnejších materiálov na výrobu chemických zariadení, ktoré musia odolávať korozívnemu pôsobeniu koncentrovaných soľaniek, horúcich zásad, roztavených solí, fluóru, chlóru, brómu a iných agresívnych prostredí. Tento kov si zachováva chemickú pasivitu aj pri zahrievaní; tepelná odolnosť vydláždila cestu niklu v tryskovej technológii.
Dizajnéri elektrických vákuových zariadení videli v nikle unikátny súbor vlastností. Nie je náhoda, že viac ako tri štvrtiny všetkého kovu spotrebovaného elektrickou vákuovou technológiou je čistý nikel; Vyrábajú sa z neho držiaky drôtov, priechodky, mriežky, anódy, sitá, jadrá pre oxidové katódy a množstvo ďalších dielov.
Tu sa spolu s koróziou a tepelnou odolnosťou niklu, jeho ťažnosťou a pevnosťou veľmi cení nízky tlak pár: pri prevádzkovej teplote cca 750°C je objem elektrónky nasýtený nevýznamným množstvom niklu – cca. 10-12 g, čo neporušuje hlboké vákuum.
Magnetické vlastnosti niklu
Magnetické vlastnosti niklu sú pozoruhodné v mnohých ohľadoch. V roku 1842 J. P. Joule opísal zväčšenie dĺžky oceľových tyčí pri magnetizácii. Po 35 rokoch sa fyzici dostali k chemickým príbuzným železa - kobaltu a niklu. A potom sa ukázalo, že kobaltové tyče sa tiež predlžujú v magnetickom poli, ale tento pozoruhodný efekt sa nenachádza v nikle. O pár rokov neskôr (v roku 1882) sa ukázalo, že nikel nielenže nepredlžuje, ale naopak, dokonca sa v magnetickom poli skracuje. Tento jav sa nazýval magnetostrikcia. Jeho podstata spočíva v tom, že pri pôsobení vonkajšieho magnetického poľa sa náhodne umiestnené kovové mikromagnety (domény) zarovnajú v jednom smere, čím sa deformuje kryštálová mriežka. Účinok je reverzibilný: mechanické namáhanie kovu mení jeho magnetické vlastnosti.
Preto sa mechanické vibrácie vo feromagnetických materiáloch rozpadajú oveľa rýchlejšie ako v neferomagnetických materiáloch: energia vibrácií sa vynakladá na zmenu stavu magnetizácie. Pochopenie podstaty tohto „magnetomechanického tlmenia“ umožnilo vytvoriť zliatiny odolné voči únave pre lopatky turbín a mnohé ďalšie diely podliehajúce vibráciám.
Ale možno je ešte dôležitejšia iná oblasť použitia magnetomechanických javov: zdrojom ultrazvuku sa stáva niklová tyč v striedavom magnetickom poli dostatočnej frekvencie. Rezonančným kývaním takejto tyče (na tento účel je zvolená vhodná dĺžka) sa dosiahne amplitúda kmitov, ktorá je pre ultrazvukovú technológiu kolosálna - 0,01% dĺžky tyče.
Niklové magnetostriktory sa okrem iného používali na pokovovanie niklom v ultrazvukovom poli: vďaka ultrazvuku sa získajú extrémne husté a lesklé povlaky a rýchlosť ich aplikácie môže byť oveľa vyššia ako bez sonikácie. Takto si „nikel pomáha“.
Nikel bol nájdený v železných meteoritoch. „Hmota prírodného železa vážiaca 71 viedenských libier, ktorá 26. mája 1751 o šiestej hodine popoludní spadla do vzduchu pred očami niekoľkých očitých svedkov pri obci Grasina v Chorvátsku a bola zakopaná tri siahy do zeme. na nedávno zoranom poli.“
Ultrazvuk má mnoho ďalších využití. Zdá sa však, že nikto neštudoval účinky rýchlo sa meniaceho magnetického poľa na reakcie zahŕňajúce kovový nikel: povrchová pulzácia vyvolaná magnetostrikciou by mala významný vplyv na chemickú interakciu, takže štúdium reakcie „znejúceho“ kovu môže odhaliť nové a neočakávané účinky.
Nikel a jeho zliatiny
Prejdime teraz k zliatinám niklu. Ale je lepšie povedať, vráťme sa: koniec koncov, história používania niklu sa začala zliatinami: niektoré - železo-nikel - človek dostal v hotovej forme, iné - meď-nikel - naučil sa taviť z prírodných rúd, nie a predsa vedieť, aké kovy sú v nich zahrnuté.
A teraz priemysel používa niekoľko tisíc zliatin, ktoré zahŕňajú nikel, hoci v našej dobe kombinácie železo - nikel a meď - nikel, ktoré nám poskytuje samotná príroda, zostávajú základom pre veľkú väčšinu zliatin obsahujúcich nikel. Pravdepodobne však najdôležitejšou vecou nie je množstvo a rozmanitosť týchto zliatin, ale skutočnosť, že v nich človek dokázal posilniť a rozvinúť vlastnosti niklu, ktoré potrebujeme.
Je napríklad známe, že tuhé roztoky sú pevnejšie a tvrdšie ako ich zložky, ale zachovávajú si svoju plasticitu. Preto kovové materiály, ktoré sú predmetom spracovania kovaním, valcovaním, ťahaním, razením atď., vznikajú na základe systémov, ktorých komponenty medzi sebou tvoria pevné riešenia. Presne také sú zliatiny niklu a medi: oba kovy sú úplne miešateľné v akomkoľvek pomere, a to ako v tekutom stave, tak aj pri stuhnutí taveniny. Odtiaľ pochádzajú vynikajúce mechanické vlastnosti zliatin medi a niklu, ktoré poznali starovekí metalurgovia.
Predchodcom mnohých druhov týchto zliatin je „pakt-hong“ (alebo „pekfong“), ktorý sa tavil v Číne, možno ešte pred naším letopočtom, a prežil dodnes. Pozostáva z medi, niklu (20 %) a zinku, pričom zinok hrá v podstate rovnakú úlohu ako horčík pri príprave tvárneho niklu. Táto zliatina sa v Európe začala v malých množstvách vyrábať v prvej polovici 19. storočia. pod názvami Argentan, nemecké striebro, nikel striebro (nové striebro) a množstvo ďalších a takmer všetky tieto názvy zdôrazňovali krásny strieborný vzhľad zliatiny. Nikel má zaujímavú „bieliacu schopnosť“: už 20% z neho úplne zhasne červenú farbu medi.
„Nové striebro“ úspešne konkurovalo starému a získalo si obľubu medzi klenotníkmi. Používal sa aj na razenie mincí. V roku 1850 Švajčiarsko vydalo prvé niklové strieborné mince a čoskoro ich nasledovali takmer všetky krajiny. Američania dokonca nazývajú svoje nikly „nikly“. Rozsah tejto aplikácie zliatin medi a niklu je obrovský: stĺp „niklových“ mincí, ktoré boli na svete vyrobené za niečo vyše 100 rokov, by dosiahol Mesiac!
V súčasnosti sa nikel striebro a jemu príbuzný kupronikel (nikel striebro neobsahuje zinok, ale obsahuje asi 1% mangánu) používa nielen a nie tak na nahradenie striebra, ale na technické účely: kupronikel je najodolnejší (zo všetkých známych zliatin !) proti nárazu alebo prúdeniu, korózii. Je to výborný materiál pre kohútiky, ventily a najmä trubice kondenzátora.
Ale mladšia zliatina medi a niklu je dieťaťom náhody a vynaliezavosti. Na začiatku 20. stor. komplikácie nastali pri spracovaní bohatých kanadských rúd, ktoré obsahovali dvakrát viac niklu ako medi; oddelenie týchto dvoch kovov bolo pre hutníkov tvrdým orieškom. Plukovník Ambrose Monel, vtedajší prezident International Nickel Company, prišiel s odvážnou myšlienkou – neoddeľovať meď a nikel, ale spájať ich do „prírodnej zliatiny“. Inžinieri implementovali túto myšlienku - a výsledkom bol slávny Monel kov - jedna z najdôležitejších zliatin v chemickom inžinierstve. Teraz bolo vytvorených veľa druhov kovu Monel, ktoré sa líšia povahou a množstvom legujúcich prísad, ale základ je vo všetkých prípadoch rovnaký - 60-70% niklu a 28-30% medi. Vysoká chemická odolnosť, vynikajúce mechanické vlastnosti a porovnateľná lacnosť (stále sa taví bez predbežnej separácie medi a niklu) preslávili kov Monel medzi chemikmi, staviteľmi lodí, textilnými robotníkmi, ropnými robotníkmi a dokonca aj parfumérmi.
Ak je monelový kov „prírodnou zliatinou“ sulfidových rúd medi a niklu, potom je feronickel prírodným produktom tavenia oxidovaných niklových rúd. Rozdiel je v tom, že v závislosti od podmienok tavenia sa pomer niklu a železa v tomto produkte môže značne meniť (väčšina železa sa premieňa na trosku). Feronickel rôzneho zloženia sa potom používa ako medziprodukt na výrobu mnohých druhov ocele a iných zliatin železa a niklu.
Widmanstättova štruktúra. V roku 1808 dostal riaditeľ Priemyselného múzea vo Viedni Alois von Wndmanstätten od svojho priateľa vzorky železných meteoritov, vyleštil ich a vyleptal kyselinou dusičnou. Objavujú sa pôvabné leptané línie odrážajúce charakteristickú štruktúru zliatiny
Existuje veľké množstvo takýchto zliatin. Konštrukčné niklové a nehrdzavejúce chrómniklové ocele sú každému dobre známe. Spotrebúvajú takmer polovicu všetkého niklu vyťaženého ľuďmi. Inconel je „aristokratický príbuzný“ nehrdzavejúcich ocelí, v ktorých už takmer žiadne železo nezostáva, ide o zliatinu (presnejšie o skupinu zliatin na báze niklu a chrómu s prídavkom titánu a ďalších prvkov. Inconel sa stal jednou z nich; hlavným materiálom v raketovej technike je najdôležitejšia z odporových zliatin nichrom (20 % Cr, 80 % Ni), základ väčšiny elektrických vykurovacích zariadení, od domácich elektrických sporákov až po výkonné priemyselné pece Menej známy je elinvar (45 %. Ni, 55% Fe, legujúce prísady - Cr, Mo, W), ktorý si zachováva stálu elasticitu pri rôznych teplotách, a platinit (49% Ni, 51% Fe), ten však v mnohých prípadoch neobsahuje nahrádza ho podobne ako platinu, dá sa prispájkovať do skla a spoj nepraskne, keďže koeficienty tepelnej rozťažnosti skla a platinitu sú rovnaké blízko nule.
Špeciálnu triedu tvoria magnetické zliatiny. Azda najväčšiu zásluhu tu má permalloy FeNi 3 - zliatina s fenomenálnou magnetickou permeabilitou, ktorá spôsobila revolúciu v slaboprúdovej technológii. Permalloy jadrá sa nachádzajú v každom telefóne a tenké permalloy filmy sú hlavným prvkom počítačových úložných zariadení.
Motor americkej rakety Atlas, pracujúci pri 3200°C, odoláva tejto teplote vďaka stovkám malých niklových trubičiek s hrúbkou len 0,3 mm, ktoré tvoria steny spaľovacej komory. Cez tieto rúrky prechádza tekuté palivo, ktoré ochladzuje steny a zároveň sa ohrieva.