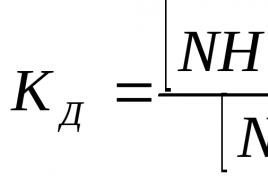Reakcje wymiany jonowej. Dysocjacja elektrolityczna
Dysocjacja elektrolityczna - Jest to proces rozkładu cząsteczek elektrolitu na jony pod działaniem cząsteczek polarnego rozpuszczalnika.
ElektrolitySą to substancje, których stopione lub wodne roztwory przewodzą prąd elektryczny. Należą do nich roztwory kwasów, stopów i roztworów zasad i soli. Nieelektrolity Są to substancje, które nie przewodzą prądu elektrycznego. Należą do nich wiele substancji organicznych.
Nazywa się elektrolity, które prawie całkowicie dysocjują na jony silny; nazywane są elektrolity, które częściowo dysocjują na jony słaby.W celu ilościowej oceny kompletności dysocjacji wprowadza się pojęcie stopnia dysocjacji. Stopień dysocjacji elektrolit nazywany jest stosunkiem liczby cząsteczek rozłożonych na jony do całkowitej liczby cząsteczek w roztworze.
Zwykle stopień dysocjacji ( α ) są wyrażone w ułamkach jednostki lub%:
gdzie n - liczba cząstek podlegających dysocjacji elektrolitycznej;
n 0 - całkowita liczba cząstek w roztworze.
Silne elektrolity - prawie wszystkie sole, zasady rozpuszczalne ( NaOH, KOH, Ba(O) 2 i inne), kwasy nieorganiczne ( H. 2 WIĘC 4 , HCl, HNO 3 , HBr, CZEŚĆ itd) .
Słabe elektrolity - nierozpuszczalne zasady i NH 4 O, kwasy nieorganiczne ( H. 2 WSPÓŁ 3, , H. 2 S, HNO 2, H. 3 PO 4 i inne), kwasy organiczne i wodę H. 2 O.
Silne elektrolity dysocjują prawie całkowicie na jony (czyli proces dysocjacji jest nieodwracalny) i w jednym kroku:
HC1 \u003d H. + + Cl – H. 2 WIĘC 4 \u003d 2H + + SO 4 2–
Słabe elektrolity dysocjują częściowo (tj. Proces dysocjacji jest odwracalny) i stopniowo . Na przykład w przypadku kwasów wielozasadowych na każdym etapie pobierany jest jeden jon wodorowy:
1.H 2 WIĘC 3 ⇄ H. + + HSO 3 - 2. Hso 3 - ⇄ H. + + SO 3 2-
Tak więc liczba etapów kwasów wielozasadowych zależy od zasadowości kwasu (liczby jonów wodorowych), a liczbę etapów zasad polikwasowych określa kwasowość zasady (lub liczba grup hydroksylowych): NH 4
O
⇄
NH 4
+
+
O –
.
Proces dysocjacji elektrolitycznej kończy się ustaleniem stanu równowagi chemicznej w układzie, który charakteryzuje się stałą równowagi: 
Stała równowagi procesu dysocjacji elektrolitycznej nazywana jest stałą dysocjacji - DO re ... Stała dysocjacji zależy od rodzaju elektrolitu, rodzaju rozpuszczalnika i temperatury, ale nie zależy od stężenia elektrolitu.
pomiędzy DO re i α istnieje zależność ilościowa:
 (13)
(13)
Relacja (13) nazywana jest prawem rozwodnienia Ostwalda: stopień dysocjacji słabego elektrolitu wzrasta wraz z rozcieńczeniem roztworu.
Dla słabych elektrolitów, gdy α 1, DO re = α 2 OD.
Woda jest słabym elektrolitem, więc dysocjuje odwracalnie:
H. 2 O ⇄ H. + + O – ∆ H. \u003d + 56,5 kJ / mol
Stała dysocjacji wody: 
Stopień dysocjacji wody jest bardzo niski (jest to bardzo słaby elektrolit). Ponieważ woda jest obecna w dużym nadmiarze, jej stężenie można uznać za stałe i takie jest  następnie
następnie
DO re [ H. 2 O] = [ H. + ]∙[ O - ] = 55,6∙1,8∙10 -16 = 10 -14
[ H. + ]∙[ O - ] = 10 -14 = K. W - iloczyn jonowy wody
Ponieważ stężenia kationów wodoru i jonów wodorotlenkowych w wodzie są równe, to: [
H. +
]
= [
O -
]
=
 .
.
Rozpuszczanie innych substancji (kwasów, zasad, soli) w wodzie zmienia stężenie jonów H. + lub ON – , a ich iloczyn zawsze pozostaje stały i równy 10-14 przy T \u003d 25 0 С.Stężenie jonów H. + może służyć jako miara kwasowości lub zasadowości roztworu. Zwykle do tego celu używa się pH: pH = - lg[ H. + ]. W ten sposób, wartość PH Jest logarytmem dziesiętnym stężenia jonów wodoru, przyjmowanym z przeciwnym znakiem.
W zależności od stężenia jonów wodorowych wyróżnia się trzy media.
W neutralnyśrodowisko [ H. + ] = [ O - ]= 10 -7 mol / L, pH \u003d -lg 10 -7 = 7 ... To środowisko jest typowe zarówno dla czystej wody, jak i neutralnych roztworów. W kwaśny rozwiązania [ H. + ] > 10 -7 mol / l, pH< 7 ... W środowisku kwaśnym pH różni się w obrębie 0 < рН < 7 ... W alkaliczny środowiskach [ H. + ] < [ОН – ] i [ H. + ] < 10 -7 mol / l, W konsekwencji, pH\u003e 7... Zakres zmian pH: 7 < рН < 14 .
Reakcje wymiany jonów (RIO) Czy reakcje między jonami zachodzą w wodnych roztworach elektrolitów. Charakterystyczna cecha reakcji metabolicznych: pierwiastki tworzące reagenty nie zmieniają swojego stopnia utlenienia. Reakcje wymiany jonowej są reakcjami nieodwracalnymi i przebiegają opatrzony: 1) tworzenie się substancji słabo rozpuszczalnej, 2) uwalnianie się substancji gazowej, 3) tworzenie się słabego elektrolitu.
W trakcie RIO przeciwnie naładowane jony są wiązane i usuwane ze sfery reakcyjnej. Istota reakcji wymiany jonowej jest wyrażona za pomocą równań jonowych, które w odróżnieniu od molekularnych pokazują prawdziwych uczestników reakcji. Przy sporządzaniu równań jonowych należy kierować się faktem, że substancje słabo zdysocjowane, słabo rozpuszczalne (wytrącone) i gazowe są zapisywane w postaci molekularnej. Silne rozpuszczalne elektrolity są rejestrowane jako jony. Dlatego przy pisaniu równań jonowych konieczne jest skorzystanie z tabeli rozpuszczalności soli i zasad w wodzie.
Hydroliza- jest to proces interakcji jonów soli z cząsteczkami wody, prowadzący do powstania związków nisko dysocjujących; jest szczególnym przypadkiem reakcji wymiany jonowej. Powstałe sole poddaje się hydrolizie:
słaby kwas i mocna zasada ( NACH 3 GRUCHAĆ, Na 2 WSPÓŁ 3 , Na 2 S, );
słaba zasada i mocny kwas ( NH 4 Cl, FeCl 3 , AlCl 3 ,);
słaba zasada i słaby kwas ( NH 4 CN, NH 4 CH 3 GRUCHAĆ).
Sole utworzone przez mocny kwas i mocną zasadę nie ulegają hydrolizie: Na 2 WIĘC 4 , BaCl 2 , NaCl, NaJ itp.
Hydroliza soli zwiększa stężenie jonów H. + lub ON – ... Prowadzi to do przesunięcia równowagi jonowej wody i, w zależności od charakteru soli, nadaje roztworowi środowisko kwaśne lub zasadowe (patrz przykłady rozwiązywania problemów).
Wzory obliczeniowe.
1. Obliczyć normalne stężenie roztworu kwasu (próba nr 1) lub roztworu alkalicznego (próba nr 2) ze wzoru prawa równoważników dla roztworów:
2. Obliczyć masę kwasu (próba nr 1) lub zasady (próba nr 2) zawartej w 10 ml odpowiedniego roztworu ze wzoru o normalnym stężeniu:
3. Obliczyć masę wody (rozpuszczalnika) w 10 ml roztworu, przyjmując gęstość roztworu równą 1:
4. Na podstawie uzyskanych danych obliczyć określone stężenia według odpowiednich wzorów.
Praca laboratoryjna nr 5
Cel: badać warunki przebiegu reakcji wymiany jonowej oraz zasady pisania reakcji wymiany jonowej w formach molekularnych i jonowo-molekularnych.
Część teoretyczna.
Dysocjacja elektrolityczna nazywa się częściowym lub całkowitym rozpadem cząsteczek elektrolitu na jony pod działaniem cząsteczek polarnego rozpuszczalnika. Dysocjacja zachodzi w wyniku złożonej fizykochemicznej interakcji cząsteczek elektrolitu z cząsteczkami polarnego rozpuszczalnika. Oddziaływanie jonów z cząsteczkami polarnego rozpuszczalnika nazywane jest solwatacją (w przypadku roztworów wodnych - hydratacją) jonów. W roztworach elektrolitów powstają jony solwatowane.
Elektrolity przewodzą prąd elektryczny, ponieważ roztwory zawierają naładowane cząstki: kationy i aniony.
Proces dysocjacji jest ilościowo scharakteryzowany przez stopień dysocjacji elektrolitycznej α. Stopień dysocjacji to stosunek liczby cząsteczek rozpadających się na jony n do całkowitej liczby cząsteczek N substancji rozpuszczonej:
Stopień dysocjacji jest wyrażony jako procent lub ułamek jednostki.
Elektrolity dzieli się na trzy grupy: a) mocne (α\u003e 30%), b) średnie (3<α<30%), в) слабые (α<3%).
Literatura edukacyjna zawiera tabele stopni dysocjacji kwasów, zasad i soli. Stopień dysocjacji zależy od rodzaju substancji rozpuszczonej i rozpuszczalników, temperatury, stężenia i obecności podobnych jonów w roztworze. W przypadku słabych elektrolitów stopień dysocjacji w znacznym stopniu zależy od stężenia: im niższe stężenie roztworu, tym większy stopień dysocjacji elektrolitycznej.
O wiele wygodniej jest scharakteryzować zdolność elektrolitów do dysocjacji do roztworu stała dysocjacji K , która nie zależy od stężenia roztworu. Stała dysocjacji K jest stałą równowagi odwracalnego procesu dysocjacji słabego elektrolitu - kwasu lub zasady. Stała dysocjacji kwasów nazywana jest również stałą kwasowości, a stała zasadowa nazywana jest stałą zasadowości. Wartości stałych dysocjacji słabych elektrolitów podano w tabelach dla warunków standardowych.
Stałą dysocjacji (zasadowość) wyraża stosunek iloczynu stężeń równowagowych jonów w roztworze danego słabego elektrolitu do stężenia niezdysocjowanych cząsteczek:
![]()
Stała dysocjacji jest miarą względnej siły słabych elektrolitów: im mniejsza, tym słabszy elektrolit. Zachodzi zależność między stałą a stopniem dysocjacji słabego elektrolitu binarnego prawo hodowlane Ostwalda:
![]()
Z punktu widzenia dysocjacji elektrolitycznej kwasy nazywane są elektrolitami, które w roztworach wodnych tworzą dodatnio naładowane jony wodoru i aniony reszt kwasowych. Jony wodoru są charakterystyczne dla kwasów i determinują ich właściwości. Kwasy będące silnymi elektrolitami: azotanowy HNO 3, chlorowodorek HCl, bromowodór HBr, jodowodorowy HJ, siarkowy H 2 SO 4, mangan HMnO 4 i inne.
Elektrolitów słabych jest znacznie więcej niż mocnych. Słabe elektrolity to kwasy: siarkowy H 2 SO 3, fluorowodorowy HF, węglowy H 2 CO 3, siarkowodór H 2 S, octowy CH 3 COOH, itp. Wielozasadowe kwasy dysocjują stopniowo. Przykłady dysocjacji kwasu:
HCl \u003d H + + Cl -
CH 3 COOH CH 3 COO - + H +
Etap I: H 2 SO 3 H + + HSО 3 -
lub H 2 SO 3 2H + + SO 3 2-,
II stopień: HSО 3 - H + + SO 3 2 -
Z punktu widzenia dysocjacji elektrolitycznej zasady nazywane są elektrolitami, które w roztworach wodnych tworzą ujemnie naładowane jony OH - wodorotlenkowe i kationy metali. Jony wodorotlenkowe określają ogólne właściwości zasad. Zasady o wartościowości kationowej większej niż jeden dysocjują stopniowo. Silne elektrolity to zasady, w których kationami są metale alkaliczne i metale ziem alkalicznych, z wyjątkiem Be (OH) 2 i Mg (OH) 2.
Zasadniczo zasady to słabe elektrolity, zwłaszcza te utworzone przez metale amfoteryczne. Amfoteryczne wodorotlenki dysocjują jako zasady w środowisku kwaśnym i jako kwasy w środowisku zasadowym. Przykłady dysocjacji zasad i wodorotlenków amfoterycznych:
NaOH \u003d Na + + OH -
1 ul. Fe (OH) 2 FeOH + + OH -
II art. FeOH + Fe 2+ + OH - lub Fe (OH) 2 Fe 2+ + 2OH -
Zn 2+ + 2OH - Zn (OH) 2 H 2 ZnО 2 2H + + ZnO 2 2-
Sole to elektrolity, które dysocjują w wodzie na dodatnie jony metali i ujemne jony pozostałości kwasowej.Wszystkie sole, które są dobrze rozpuszczalne w wodzie, są silnymi elektrolitami. Przykłady dysocjacji soli normalnych (średnich), kwaśnych, zasadowych, złożonych i podwójnych:
KBr \u003d K + + Br -; K 3 \u003d 3 K + + 3-;
NaHCO 3 \u003d Na + + HCO 3 -; KAl (SO 4) 2 \u003d K + + Al 3+ + 2SO 4 2-.
AlOHCl2 \u003d AlOH 2+ + 2Cl -;
Badanie różnych reakcji, głównie w środowiskach niewodnych, doprowadziło do stworzenia bardziej ogólnych koncepcji kwasów i zasad. Najważniejsza ze współczesnych teorii kwasów i zasad należy do teorii protonów, zgodnie z którą donorem protonów jest kwas, czyli cząsteczka (cząsteczka lub jon) zdolna do oddania jonu wodorowego - protonu, a zasadą jest akceptor protonów, tj. cząsteczka (cząsteczka lub jon) zdolna do przyłączenia protonu. Na przykład w reakcji:
HC1 + NH 3 \u003d NH 4 + + Cl -
jon C1 - jest zasadą sprzężoną z kwasem HCl, a jon NH4 + jest kwasem sprzężonym z zasadą NH3. Reakcje w roztworach elektrolitów zachodzą między jonami, na które rozkładają się cząsteczki substancji rozpuszczonych. Reakcje są rejestrowane w trzech formach: molekularnej, w pełni jonowo-molekularnej i skróconej jonowo-cząsteczkowej. Silne elektrolity rejestrowane są w postaci jonów, elektrolitów średnich i słabych, osadów oraz gazów - w postaci cząsteczek. Istotę reakcji odzwierciedla skrócone równanie molekularno-jonowe, w którym wskazane są tylko cząstki, które bezpośrednio wchodzą w reakcję, a jony i cząsteczki, których stężenie nie zmienia się znacząco, nie są wskazane. Reakcje między elektrolitami przebiegają w kierunku tworzenia się gazu, osadu lub słabiej
elektrolit.
Przykład reakcji w roztworach elektrolitów: neutralizacja słabą zasadą (wodorotlenkiem amonu) mocnego kwasu azotowego. Równanie reakcji molekularnej:
HNO 3 + NH 4 OH \u003d NH 4 NO 3 + H 2 O.
W tej reakcji mocnymi elektrolitami jest kwas azotowy i powstająca w ten sposób sól saletry amonowej, którą piszemy w postaci jonów, a słabymi elektrolitami są wodorotlenek amonu i woda, którą piszemy w postaci cząsteczek. Kompletne równanie jonowo-molekularne to:
H + + NO 3 - + NH 4 OH \u003d NH 4 + + NO 3 - + H 2 O.
Jak widać tylko NO 3 - jony nie ulegają zmianom w trakcie reakcji, wyłączając je, zapisujemy skrócone równanie jonowo-molekularne:
H + + NH 4 OH \u003d NH 4 + + H 2 O.
Część praktyczna
Jonowe - reakcje wymiany molekularnej
Przeprowadzaj reakcje między roztworami elektrolitów zgodnie z zadaniem. Aby to zrobić, wlej 7-8 kropli jednego odczynnika do probówki i dodaj 7-8 kropli innego odczynnika. Obserwuj oznaki reakcji: wytrącanie, wydzielanie się gazu lub zmianę zapachu (wskazujące na tworzenie się substancji o niskim stopniu dysocjacji).
Następnie, zgodnie z zaobserwowanymi objawami, klasyfikuj reakcję jako jeden z 3 typów:
1) reakcje wymiany jonowej z utworzeniem słabo rozpuszczalnej substancji (osad);
2) reakcje wymiany jonowej z wydzielaniem gazu;
3) reakcje wymiany jonowej z tworzeniem słabego elektrolitu.
Zapisz każdą reakcję w 3 formach:
a) molekularne,
b) pełne jonowe - molekularne,
c) zredukowana jonowo - molekularna.
Wyciągnij wnioski dotyczące kierunku reakcji wymiany jonowej.
Lista zadań:
| 1. CH 3 COONa + H 2 SO 4 2. NaNO 2 + H 2 SO 4 3. MgCl 2 + Na 3 PO 4 4. NH 4 Cl + KOH 5. Na 2 CO 3 + HCl 6. Na 2 CO 3 + Ba (NO 3) 2 7. (CH 3 COO) 2 Pb + HCl 8. Hg (NO 3) 2 + NaOH 9. H 2 SO 4 + BaCl 2 10. NaCl + Pb (NO 3) 2 11. NiSO 4 + KOH 12. NaNO 2 + HCl 13. Bi (NO 3) 3 + KOH 14. Na 2 S + CdCl 2 15. Bi (NO 3) 3 + Na 2 S 16. CoSO 4 + KOH 17. CuSO 4 + KOH 18. Na 2 CO 3 + HNO 3 19. K 2 CrO 4 + CuSO 4 20. K 2 CrO 4 + MnSO 4 21. K 2 CrO 4 + NiSO 4 22. K 2 CO 3 + MnSO 4 23. Na 2 SO 3 + HCl | 24. Hg (NO 3) 2 + Na 2 S 25. NiSO 4 + NH 4 OH 26. NiSO 4 + NH 4 OH g 27. AlCl 3 + KOH 28. FeCl 3 + Na 3 PO 4 29. K 2 CrO 4 + Ba (NO 3) 2 30. NaNO 2 + HNO 3 31. MgCl 2 + NaOH 32. CuSO 4 + NH 4 OH 33. CuSO 4 + NH 4 OH g 34. AlCl 3 + KOH g 35. Pb (NO 3 ) 2 + KI 36. CH 3 GOTOWANIE + HCl 37. Al 2 (SO 4) 3 + NaOH 38. Al 2 (SO 4) 3 + NaOH g 39. CoSO 4 + Na 2 S 40. Pb (NO 3) 2 + Na 3 PO 4 41. Na 3 PO 4 + CuSO 4 42. CH 3 GOTOWANIE + HNO 3 43. CH 3 COOH + KOH 44. CoSO 4 + NH 4 OH 45. CoSO 4 + NH 4 OH g 46. Hg (NO 3 ) 2 + KI | 47. Hg (NO 3) 2 + KI g 48. CdCl 2 + NH 4 OH 49. CdCl 2 + NH 4 OH g 50. NaHCO 3 + HNO 3 51. ZnSO 4 + BaCl 2 52. ZnSO 4 + KOH 53. ZnSO 4 + KOH g 54. (CH 3 COO) 2 Pb + H 2 SO 4 55. NaHCO 3 + H 2 SO 4 56. (NH 4) 2 SO 4 + KOH 57. K 2 CO 3 + H 2 SO 4 58 . (NH 4) 2 SO 4 + NaOH 59. K 2 CO 3 + HCl 60. CrCl 3 + KOH 61. CrCl 3 + KOH g 62. ZnCl 2 + NaOH 63. ZnCl 2 + NaOH g 64. MnSO 4 + KOH 65. MnSO 4 + Na 3 PO 4 66. Na 2 SO 3 + H 2 SO 4 67. K 2 CO 3 + CH 3 COOH 68. Na 2 CO 3 + CH 3 COOH 69. NaHCO 3 + CH 3 COOH |
Praca laboratoryjna nr 6
DYSOCJACJA ELEKTROLITYCZNA
ELEKTROLITY I NIEELEKROLITY
Teoria dysocjacji elektrolitycznej
(S. Arrhenius, 1887)
Po rozpuszczeniu w wodzie (lub stopieniu) elektrolity rozkładają się na jony naładowane dodatnio i ujemnie (ulegają dysocjacji elektrolitycznej).
Pod wpływem prądu elektrycznego kationy (+) przechodzą do katody (-), a aniony (-) do anody (+).
Dysocjacja elektrolityczna jest procesem odwracalnym (reakcja odwrotna nazywana jest molaryzacją).
Stopień dysocjacji elektrolitycznej (a) zależy z rodzaju elektrolitu i rozpuszczalnika, temperatury i stężenia. Pokazuje stosunek liczby cząsteczek rozpadających się na jony (n) do całkowitej liczby cząsteczek wprowadzonych do roztworu (N).
a \u003d n / N 0< a < 1
Mechanizm dysocjacji elektrolitycznej substancji jonowych
Podczas rozpuszczania związków z wiązaniami jonowymi (np. NaCl) proces hydratacji rozpoczyna się od ustawienia dipoli wody wokół wszystkich grzbietów i powierzchni kryształów soli.
Zorientowane wokół jonów sieci krystalicznej cząsteczki wody tworzą z nimi wiązania wodoru lub wiązania donor-akceptor. W tym procesie uwalniana jest duża ilość energii, zwanej energią hydratacji.
Energia hydratacji, której wartość jest porównywalna z energią sieci krystalicznej, jest wykorzystywana do niszczenia sieci krystalicznej. W tym przypadku uwodnione jony przechodzą warstwa po warstwie do rozpuszczalnika i mieszając się z cząsteczkami tworzą roztwór.
Mechanizm dysocjacji elektrolitycznej substancji polarnych
Substancje, których cząsteczki powstają zgodnie z rodzajem polarnego wiązania kowalencyjnego (cząsteczki polarne) dysocjują w podobny sposób. Wokół każdej polarnej cząsteczki materii (np. HCl), dipole wody są zorientowane w określony sposób. W wyniku interakcji z dipolami wody polarna cząsteczka staje się jeszcze bardziej spolaryzowana i zamienia się w cząsteczkę jonową, po czym łatwo tworzą się wolne jony uwodnione.
Elektrolity i nieelektrolity
Dysocjacja elektrolityczna substancji z utworzeniem wolnych jonów wyjaśnia przewodnictwo elektryczne roztworów.
Proces dysocjacji elektrolitycznej jest zwykle zapisywany w postaci diagramu, bez ujawniania jego mechanizmu i pomijania rozpuszczalnika (H 2 O), chociaż jest głównym współpracownikiem.
CaCl 2 «Ca 2+ + 2Cl -
KAl (SO 4) 2 "K + + Al 3+ + 2SO 4 2-
HNO 3 "H + + NO 3 -
Ba (OH) 2 «Ba 2+ + 2OH -
Z elektroobojętności cząsteczek wynika, że \u200b\u200bcałkowity ładunek kationów i anionów powinien wynosić zero.
Na przykład dla
Al 2 (SO 4) 3 –– 2 (+3) + 3 (-2) \u003d +6 - 6 \u003d 0
KCr (SO 4) 2 –– 1 (+1) + 3 (+3) + 2 (-2) \u003d +1 + 3 - 4 \u003d 0
Silne elektrolity
Są to substancje, które po rozpuszczeniu w wodzie prawie całkowicie rozkładają się na jony. Z reguły do \u200b\u200bsilnych elektrolitów zalicza się substancje z wiązaniami jonowymi lub silnie polarnymi: wszystkie łatwo rozpuszczalne sole, mocne kwasy (HCl, HBr, HI, HClO 4, H 2 SO 4, HNO 3) i mocne zasady (LiOH, NaOH, KOH, RbOH, CsOH, Ba (OH) 2, Sr (OH) 2, Ca (OH) 2).
W roztworze silnego elektrolitu substancja rozpuszczona występuje głównie w postaci jonów (kationów i anionów); niezdysocjowane cząsteczki są praktycznie nieobecne.
Słabe elektrolity
Substancje, które częściowo dysocjują na jony. Roztwory słabych elektrolitów wraz z jonami zawierają niezdysocjowane cząsteczki. Słabe elektrolity nie mogą dawać wysokiego stężenia jonów w roztworze.
Słabe elektrolity obejmują:
prawie wszystkie kwasy organiczne (CH 3 COOH, C 2 H 5 COOH itp.);
niektóre kwasy nieorganiczne (H 2 CO 3, H 2 S itp.);
prawie wszystkie sole, zasady i wodorotlenek amonu, które są słabo rozpuszczalne w wodzie(Ca 3 (PO 4) 2; Cu (OH) 2; Al (OH) 3; NH 4 OH);
woda.
Słabo (lub prawie nie przewodzą) prąd elektryczny.
CH 3 COOH "CH 3 COO - + H +
Cu (OH) 2 «[CuOH] + + OH - (pierwszy stopień)
[CuOH] + "Cu 2+ + OH - (drugi stopień)
H 2 CO 3 «H + + HCO - (pierwszy stopień)
HCO 3 - "H + + CO 3 2- (drugi stopień)
Nieelektrolity
Substancje, roztwory wodne i stopione substancje, które nie przewodzą prądu elektrycznego. Zawierają kowalencyjne wiązania niepolarne lub o niskiej polarności, które nie rozpadają się na jony.
Gazy, ciała stałe (niemetale), związki organiczne (sacharoza, benzyna, alkohol) nie przewodzą prądu elektrycznego.
REAKCJE JONOWE. HYDROLIZA
Reakcje jonowe w roztworze
Reakcje wymiany jonowej to reakcje między jonami powstałe w wyniku dysocjacji elektrolitów.
Zasady sporządzania równań reakcji jonowych
Związki nierozpuszczalne w wodzie (proste substancje, tlenki, niektóre kwasy, zasady i sole) nie ulegają dysocjacji.
W reakcjach stosuje się roztwory substancji, dlatego nawet słabo rozpuszczalne substancje występują w roztworach w postaci jonów.
Jeśli w wyniku reakcji utworzy się słabo rozpuszczalna substancja, wówczas podczas pisania równania jonowego uważa się ją za nierozpuszczalną.
Suma ładunków elektrycznych jonów po lewej i po prawej stronie równania powinna być taka sama.
Procedura sporządzania równań reakcji jonowych
Napisz równanie reakcji molekularnej
MgCl 2 + 2AgNO 3 ® 2AgCl + Mg (NO 3) 2
Określić rozpuszczalność każdej z substancji za pomocą tabeli rozpuszczalności
LEKCJA 9 10 klasa (pierwszy rok studiów)
Teoria dysocjacji elektrolitycznej. Plan reakcji wymiany jonów
1. Elektrolity i nieelektrolity.
2. Teoria dysocjacji elektrolitycznej (TED) S.A. Arrhenius.
3. Mechanizm dysocjacji elektrolitycznej elektrolitów z jonowymi i kowalencyjnymi wiązaniami polarnymi.
4. Stopień dysocjacji.
5. Kwasy, zasady, wodorotlenki amfoteryczne, sole z punktu widzenia TED.
6. Wartość elektrolitów dla organizmów żywych.
7. Dysocjacja wody. Iloczyn jonowy wody. Wskaźnik wodoru. Media wodne roztwory elektrolitów. Wskaźniki.
8. Reakcje wymiany jonowej i warunki ich przebiegu.
W zależności od zdolności do przewodzenia prądu elektrycznego w roztworze wodnym lub stopie, wszystkie substancje można podzielić na elektrolity i nieelektrolity.
Elektrolity - są to substancje, roztwory lub stopione substancje przewodzące prąd elektryczny; elektrolity (kwasy, sole, zasady) mają jonowe lub polarne wiązania kowalencyjne.
Nieelektrolity - są to substancje, roztwory lub wytopy, które nie przewodzą prądu elektrycznego; w cząsteczkach nieelektrolitów (substancje organiczne, gazy, woda) wiązania są kowalencyjne niepolarne lub niskopolaryzacyjne.
Aby wyjaśnić przewodnictwo elektryczne roztworów i stopów elektrolitów, Arrhenius w 1887 stworzył teoria dysocjacji elektrolitycznej, których główne przepisy są następujące.
1. Cząsteczki elektrolitu w roztworze lub stopie ulegają dysocjacji (rozpadowi na jony). Proces rozkładu cząsteczek elektrolitu na jony w roztworze lub stopie nazywany jest dysocjacją elektrolityczną. Jonasza Czy cząsteczki mają ładunek. Jony dodatnio naładowane - kationyujemnie naładowany - aniony... Właściwości jonów różnią się od właściwości odpowiadających im atomów obojętnych, co tłumaczy się różną strukturą elektronową tych cząstek.
2. W roztworze lub stopie jony poruszają się chaotycznie. Jednak gdy prąd elektryczny przepływa przez roztwór lub stop, ruch jonów zostaje uporządkowany: kationy przemieszczają się do katody (elektroda naładowana ujemnie), a aniony do anody (elektroda naładowana dodatnio).
3. Dysocjacja jest procesem odwracalnym. Równocześnie z dysocjacją idzie stowarzyszenie - proces tworzenia cząsteczek z jonów.
4. Całkowita suma ładunków kationów w roztworze lub stopie jest równa całkowitej sumie ładunków anionów i ma przeciwny znak; rozwiązanie jest generalnie obojętne elektrycznie.
Główną przyczyną dysocjacji w roztworach z rozpuszczalnikiem polarnym jest solwatacja jonów (w przypadku roztworów wodnych hydratacja). Dysocjacja związków jonowych w roztworze wodnym przebiega całkowicie (KCl, LiNO 3, Ba (OH) 2 itd.). Elektrolity z polarnym wiązaniem kowalencyjnym mogą dysocjować częściowo lub całkowicie, w zależności od polaryzacji wiązania (H 2 SO 4, HNO 3, HI itp.). W roztworze wodnym powstają uwodnione jony, ale dla uproszczenia równania przedstawiają jony bez cząsteczek wody:

Niektóre elektrolity dysocjują całkowicie, inne częściowo. Aby scharakteryzować dysocjację, wprowadzono pojęcie stopień dysocjacji elektrolitycznej ... Ilość przedstawia stosunek liczby zdysocjowanych cząsteczek n do liczby rozpuszczonych cząsteczek N elektrolit w roztworze:
= n/N.
Stopień dysocjacji wzrasta wraz z rozcieńczeniem roztworu i wzrostem temperatury roztworu. W zależności od stopnia dysocjacji elektrolity dzieli się na mocne, średnio mocne i słabe. Silne elektrolity prawie całkowicie dysocjują w roztworze, ich stopień dysocjacji przekracza 30% i dąży do 100%. Elektrolity średnie obejmują elektrolity, których stopień dysocjacji waha się od 3% do 30%. Stopień dysocjacji słabych elektrolitów jest mniejszy niż 3%. Silne elektrolity obejmują sole, mocne kwasy, zasady. Słabe - słabe kwasy, nierozpuszczalne zasady, wodorotlenek amonu, woda.
Z punktu widzenia teorii dysocjacji elektrolitycznej można zdefiniować substancje różnych klas.
Kwasy - są to elektrolity, które podczas dysocjacji tworzą kationy wodoru i aniony reszt kwasowych. Liczba etapów dysocjacji zależy od zasadowości kwasu, na przykład:
HCl H + + Cl -,
H 2 CO 3 H + + HCO 3 - 2H + + CO 3 2–.
Podwaliny Czy elektrolity dysocjują na kationy metali i aniony grup hydroksylowych. Liczba etapów dysocjacji zależy od kwasowości zasady, na przykład:
NaOH Na + + 2OH -,
Ca (OH) 2 CaOH + + OH - Ca 2+ + 2OH -.
Wodorotlenki amfoteryczne Są słabymi elektrolitami, które po dysocjacji tworzą zarówno kationy wodorowe, jak i aniony grup hydroksylowych, na przykład:
Zn (OH) 2 ZnOH + + OH - Zn 2+ + 2OH -,
H 2 ZnO 2 H + + HZnO 2 - 2H + + ZnO 2 2–.
Sole średnie Czy elektrolity dysocjują na kationy metali i aniony reszt kwasowych, na przykład:
Na 2 SO 4 2Na + + SO 4 2–.
Kwaśne sole Czy elektrolity dysocjują na kationy metali i złożone aniony, które zawierają atomy wodoru i resztę kwasu, na przykład:
NaHCO 3 Na + + HCO 3 -.
Sole zasadowe Czy elektrolity dysocjują na aniony reszt kwasowych i złożone kationy składające się z atomów metali i grup hydroksylowych, na przykład:
Сu (OH) Сl CuОН + + Сl -.
Złożone sole Czy elektrolity tworzą podczas dysocjacji złożone jony złożone, które są dość stabilne w roztworach wodnych, na przykład:
K 3 3K + + 3–.
Elektrolity są integralną częścią płynów i tkanek organizmów żywych. Do prawidłowego przebiegu procesów fizjologicznych i biochemicznych potrzebne są sód, potas, wapń, magnez, kationy wodorowe, aniony chloru, jony siarczanowe, jony wodorowęglanowe, jony wodorotlenkowe itp. Stężenia tych jonów w organizmie człowieka są różne. Na przykład stężenia jonów sodu i chloru są bardzo znaczące i są codziennie uzupełniane. Stężenia jonów wodorowych i jonów wodorotlenkowych są bardzo małe, ale odgrywają dużą rolę w procesach życiowych, przyczyniając się do prawidłowego funkcjonowania enzymów, metabolizmu, trawienia itp.
Dysocjacja wody.
Wykładnik wodoru
Woda jest słabym elektrolitem amfoterycznym. Równanie dysocjacji wody to:
H 2 O H + + OH -
2H 2 O H 3 O + + OH -.
Stężenie protonów i jonów wodorotlenkowych w wodzie jest takie samo i wynosi 10–7 mol / l przy 25 ° С.
Iloczyn stężeń jonów wodorowych i jonów wodorotlenkowych to tzw iloczyn jonowy wody a przy 25 ° С 10-14.
Środowisko dowolnego roztworu wodnego można scharakteryzować poprzez stężenie jonów H + lub OH -. Rozróżnij roztwory obojętne, kwaśne i zasadowe.
W neutralnym środowisku rozwiązania:
10-7 mol / l,
w kwaśnym roztworze:
\u003e, czyli \u003e 10–7 mol / l,
w roztworze alkalicznym:
\u003e, czyli \u003e 10–7 mol / l.
Aby scharakteryzować roztwór roztworu, wygodnie jest użyć wartości pH (tabela 1, patrz str. 14). Wykładnik wodoru Czy ujemny logarytm dziesiętny stężenia jonów wodorowych:
pH \u003d –lg.
W trakcie lekcji przestudiujemy temat „Dysocjacja elektrolityczna. Reakcje wymiany jonów ”. Rozważ teorię dysocjacji elektrolitycznej i zapoznaj się z definicją elektrolitów. Zapoznajmy się z fizyczną i chemiczną teorią roztworów. Rozważmy w świetle teorii dysocjacji elektrolitycznej oznaczanie zasad, kwasów i soli, a także nauczmy się układać równania reakcji wymiany jonowej i poznajmy warunki ich nieodwracalności.
Temat: Roztwory i ich stężenie, układy rozproszone, dysocjacja elektrolityczna
Lekcja: Dysocjacja elektrolityczna. Reakcje wymiany jonów
1. Fizyczna i chemiczna teoria rozwiązań
Już u zarania badań zjawisk elektrycznych naukowcy zauważyli, że nie tylko metale, ale także roztwory mogą przewodzić prąd. Ale nie wszyscy. Tak więc wodne roztwory chlorku sodu i innych soli, roztwory mocnych kwasów i zasad dobrze przewodzą prąd. Dużo gorzej przewodzą roztwory kwasu octowego, dwutlenku węgla i dwutlenku siarki. Ale roztwory alkoholu, cukru i większości innych związków organicznych w ogóle nie przewodzą prądu.
Prąd elektryczny to ukierunkowany ruch swobodnie naładowanych cząstek... W metalach ruch ten jest wykonywany przez stosunkowo swobodne elektrony, gaz elektronowy. Ale nie tylko metale mogą przewodzić prąd elektryczny.
Elektrolity - są to substancje, roztwory lub stopione substancje przewodzące prąd elektryczny.
Nieelektrolity - są to substancje, których roztwory lub stopione nie przewodzą prądu elektrycznego.
Aby opisać przewodnictwo elektryczne niektórych rozwiązań, konieczne jest zrozumienie, czym jest rozwiązanie. Pod koniec XIX wieku istniały 2 główne teorie rozwiązań:
· Fizyczne. Zgodnie z tą teorią rozwiązanie - jest to czysto mechaniczna mieszanina składników i nie ma w niej interakcji między cząstkami. Dobrze opisała właściwości elektrolitów, ale miała pewne trudności z opisem roztworów elektrolitów.
· Chemiczny. Zgodnie z tą teorią po rozpuszczeniu zachodzi reakcja chemiczna między substancją rozpuszczoną a rozpuszczalnikiem. Potwierdza to obecność efektu termicznego po rozpuszczeniu, a także zmiana koloru. Na przykład, gdy rozpuszcza się biały bezwodny siarczan miedzi, tworzy się nasycony niebieski roztwór.
Prawda jest między tymi dwoma skrajnymi punktami. Mianowicie, w roztworach zachodzi zarówno proces chemiczny, jak i fizyczny.
Postać: 1. Svante Arrhenius
W 1887 roku szwedzki fizyk - chemik Svante Arrhenius (rys. 1) badając przewodnictwo elektryczne roztworów wodnych zasugerował, że w takich roztworach substancje rozkładają się na naładowane cząstki - jony, które mogą przemieszczać się do elektrod - ujemnie naładowaną katodę i dodatnio naładowaną anodę.
To jest przyczyna prądu elektrycznego w rozwiązaniach. Proces ten nazywa się dysocjacją elektrolityczną (tłumaczenie dosłowne - rozszczepianie, rozkład pod wpływem elektryczności). Ta nazwa sugeruje również, że dysocjacja zachodzi pod wpływem prądu elektrycznego. Dalsze badania wykazały, że tak nie jest: jony są tylko nośnikami ładunku w roztworze i istnieją w nim niezależnie od tego, czy prąd przepływa przez roztwór, czy nie. Przy aktywnym udziale Svante Arrheniusa sformułowano teorię dysocjacji elektrolitycznej, która często nosi imię tego naukowca. Główną ideą tej teorii jest to, że elektrolity pod działaniem rozpuszczalnika samorzutnie rozkładają się na jony. I to właśnie te jony są nośnikami ładunku i odpowiadają za przewodnictwo elektryczne roztworu.
2. Podstawowe założenia teorii dysocjacji elektrolitycznej
1. Elektrolity w roztworach pod działaniem rozpuszczalnika samorzutnie rozkładają się na jony. Ten proces nazywa się dysocjacja elektrolityczna. Dysocjacja może również mieć miejsce, gdy topią się stałe elektrolity.
2. Jony różnią się od atomów składem i właściwościami. W roztworach wodnych jony są w stanie uwodnionym. Jony w stanie uwodnionym różnią się właściwościami od jonów w stanie gazowym substancji. Wyjaśnia się to następująco: kationy i aniony są już początkowo obecne w związkach jonowych. Po rozpuszczeniu cząsteczka wody zaczyna zbliżać się do naładowanych jonów: bieguna dodatniego - do jonu ujemnego, biegun ujemny - na pozytywne. Jony nazywane są uwodnionymi (ryc. 2).
3. W roztworach lub stopach elektrolitów jony poruszają się chaotycznie, ale gdy przepływa prąd elektryczny, jony poruszają się w kierunku: kationy w kierunku katody, aniony - do anody.
3. Zasady, kwasy, sole w świetle teorii dysocjacji elektrolitycznej
W świetle teorii dysocjacji elektrolitycznej jako elektrolity można zdefiniować zasady, kwasy i sole.
Podwaliny- są to elektrolity, w wyniku dysocjacji których w roztworach wodnych powstaje tylko jeden rodzaj anionów: anion wodorotlenkowy: OH-.
NaOH ↔ Na + + OH−
Dysocjacja zasad zawierających kilka grup hydroksylowych zachodzi stopniowo:
Ba (OH) 2 ↔ Ba (OH) + + OH− Pierwszy stopień
Ba (OH) + ↔ Ba2 + + 2OH− Drugi stopień
Ba (OH) 2 ↔ Ba2 + + 2 OH− Równanie ogólne
Kwasy - są to elektrolity, w wyniku dysocjacji których w roztworach wodnych powstaje tylko jeden rodzaj kationów: H +. To uwodniony proton nazywany jest jonem wodorowym i oznaczony jako H3O +, ale dla uproszczenia zapisano H +.
HNO3 ↔ H + + NO3−
Kwasy wielozasadowe dysocjują w etapach:
H3PO4 ↔ H + + H2PO4- Pierwszy stopień
H2PO4- ↔ H + + HPO42- Drugi stopień
HPO42-↔ H + + PO43- Trzeci etap
H3PO4 ↔ 3H + + PO43-Równanie sumy
Sól - są to elektrolity, które w roztworach wodnych dysocjują na kationy metali i aniony reszt kwasowych.
Na2SO4 ↔ 2Na + + SO42−
Sole średnie - są to elektrolity dysocjujące w roztworach wodnych na kationy metali lub kationy amonowe i aniony reszt kwasowych.
Sole zasadowe - są to elektrolity dysocjujące w roztworach wodnych na kationy metali, aniony wodorotlenkowe i aniony pozostałości kwasowych.
Kwaśne sole - są to elektrolity dysocjujące w roztworach wodnych na kationy metali, kationy wodorowe i aniony reszt kwasowych.
Sole podwójne - są to elektrolity dysocjujące w roztworach wodnych na kationy kilku metali i aniony pozostałości kwasowych.
KAl (SO4) 2 ↔ K + + Al3 + + 2SO42
Sole mieszane - są to elektrolity dysocjujące w roztworach wodnych na kationy metali i aniony kilku reszt kwasowych
4. Elektrolity mocne i słabe
Dysocjacja elektrolityczna w różnym stopniu - proces jest odwracalny. Ale po rozpuszczeniu niektórych związków równowaga dysocjacji jest w dużym stopniu przesunięta w kierunku zdysocjowanej postaci. W roztworach takich elektrolitów dysocjacja przebiega prawie nieodwracalnie. Dlatego podczas pisania równań dysocjacji takich substancji zapisywany jest znak równości lub prosta strzałka, co wskazuje, że reakcja jest prawie nieodwracalna. Takie substancje nazywane są silnyelektrolity.
Słaby nazywane są elektrolity, w których następuje nieznaczna dysocjacja. Pisząc, używaj znaku odwracalności. Patka. 1.
Aby określić ilościowo moc elektrolitu, wprowadzono koncepcję stopień elektrolitycznydysocjacja.
Siłę elektrolitu można również scharakteryzować za pomocą chemiczne stałe równowagi dysocjacja. Nazywa się to stałą dysocjacji.
Czynniki wpływające na stopień dysocjacji elektrolitycznej:
Charakter elektrolitu
Stężenie elektrolitu w roztworze
· Temperatura
Wraz ze wzrostem temperatury i rozcieńczeniem roztworu wzrasta stopień dysocjacji elektrolitycznej. Dlatego moc elektrolitu można oszacować tylko poprzez porównanie ich w tych samych warunkach. Jako standard przyjmuje się T \u003d 180 ° C ic \u003d 0,1 mol / L.
5. Reakcje wymiany jonów
Istotę reakcji w roztworach elektrolitów wyraża równanie jonowe. Uwzględnia fakt, że w jednym roztworze elektrolity występują w postaci jonów. Słabe elektrolity i nierozsocjowalne substancje są rejestrowane w postaci zdysocjowanej na jony. Rozpuszczalność elektrolitu w wodzie nie może służyć jako miara jego mocy. Wiele soli nierozpuszczalnych w wodzie to mocne elektrolity, ale stężenie jonów w roztworze jest bardzo niskie właśnie ze względu na ich małą rozpuszczalność. Dlatego pisząc równania reakcji z udziałem takich substancji, zwykle pisze się je w formie niezdysocjowanej .
Reakcje w roztworach elektrolitów przebiegają w kierunku wiązania jonów.
Istnieje kilka form wiązania jonów:
1. Tworzenie się osadów
2. Ewolucja gazu
3. Tworzenie słabego elektrolitu.
· 1. Tworzenie się osadów:
BaCl2 + Na2CO3 → BaCO3 ↓ + 2NaCl.
Ba2 ++ 2Cl - + 2Na ++ CO32- → BaCO3 ↓ + 2Na ++ 2Cl- pełne równanie jonowe
Ba2 + + CO32- → BaCO3 ↓ skrócone równanie jonowe.
Skrócone równanie jonowe pokazuje, że gdy jakikolwiek rozpuszczalny związek zawierający jon Ba2 + oddziałuje ze związkiem zawierającym anion węglanowy CO32-, w wyniku powstaje nierozpuszczalny osad BaCO3 ↓.
· 2. Ewolucja gazu:
Na2CO3 + H2SO4 → Na2SO4 + H2O + CO2 &