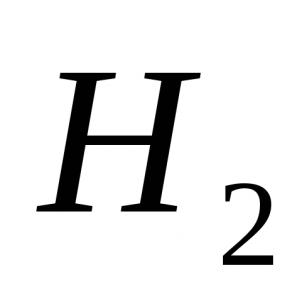Урок по составлению овр. Конспект урока на тему "Окислительно-восстановительные реакции" (11 класс)
Степень окисления
Окислительно-восстановительные свойства веществ
Виды реакций окисления-восстановления
Направление окислительно-восстановительных реакций
К окислительно-восстановительным реакциям относятся такие, которые сопровождающиеся перемещением электронов от одних частиц к другим. При рассмотрении закономерностей протекания окислительно-восстановительных реакций используется понятие степени окисления.
1. Степень окисления
Понятие степени окисления введено для характеристики состояния элементов в соединениях. Под степенью окисления понимается условный заряд атома в соединении, вычисленный исходя из предположения, что соединение состоит из ионов . Степень окисления обозначается арабской цифрой со знаком плюс при смещении электронов от данного атома к другому атому и цифрой со знаком минус при смещении электронов в обратном направлении. Цифру со знаком “+” или “-“ ставят над символом элемента. Степень окисления указывает состояние окисления атома и представляет собой всего лишь удобную форму для учета переноса электронов: ее не следует рассматривать ни как эффективный заряд атома в молекуле (например, в молекуле LiF эффективные заряды Li и F равны соответственно + 0,89 и -0,89, тогда как степени окисления +1 и -1), ни как валентность элемента (например, в соединениях CH 4 , CH 3 OH, HCOOH, CO 2 валентность углерода равна 4, а степени окисления соответственно равны -4, -2, +2, +4). Численные значения валентности и степени окисления могут совпадать по абсолютной величине лишь при образовании соединений с ионной структурой.
При определении степени окисления используют следующие правила:
Атомы элементов, находящихся в свободном состоянии или в виде молекул простых веществ, имеют степень окисления, равную нулю, например Fe, Cu, H 2 , N 2 и т.п.
Степень окисления элемента в виде одноатомного иона в соединении, имеющем ионное строение, равна заряду данного иона,
1 -1 +2 -2 +3 -1
например, NaCl , Cu S, AlF 3 .
Водород в большинстве соединений имеет степень окисления +1, за исключением гидридов металлов (NaH, LiH), в которых степень окисления водорода равна -1.
Наиболее распространенная степень окисления кислорода в соединениях -2 , за исключением пероксидов (Na 2 O 2 , Н 2 О 2), в которых степень окисления кислорода равна –1 и F 2 O, в котором степень окисления кислорода равна +2.
Для элементов с непостоянной степенью окисления ее значение можно рассчитать, зная формулу соединения и учитывая, что алгебраическая сумма степеней окисления всех элементов в нейтральной молекуле равна нулю. В сложном ионе эта сумма равна заряду иона. Например, степень окисления атома хлора в молекуле HClO 4 , вычисленная исходя из суммарного заряда молекулы = 0, где х – степень окисления атома хлора), равна +7. Степень окисления атома серы в ионе (SO 4) 2- [х + 4(-2) = -2] равна +6.
2. Окислительно-восстановительные свойства веществ
Любая окислительно-восстановительная реакция состоит из процессов окисления и восстановления. Окисление - это процесс отдачи электронов атомом, ионом или молекулой реагента. Вещества, которые отдают свои электроны в процессе реакции и при этом окисляются, называют восстановителями.
Восстановление – это процесс принятия электронов атомом, ионом или молекулой реагента.
Вещества, которые принимают электроны и при этом восстанавливаются, называют окислителями.
Реакции окисления-восстановления всегда протекают как единый процесс, называемый окислительно-восстановительной реакцией. Например, при взаимодействии металлического цинка с ионами меди восстановитель (Zn) отдает свои электроны окислителю – ионам меди (Cu 2+):
Zn + Cu 2+ Zn 2+ + Cu
Медь выделяется на поверхности цинка, а ионы цинка переходят в раствор.
Окислительно-восстановительные свойства элементов связаны со строением их атомов и определяются положением в периодической системе Д.И. Менделеева. Восстановительная способность элемента обусловлена слабой связью валентных электронов с ядром. Атомы металлов, содержащие на внешнем энергетическом уровне небольшое число электронов склонны к их отдаче, т.е. легко окисляются, играя роль восстановителей. Самые сильные восстановители – наиболее активные металлы.
Критерием окислительно-восстановительной активности элементов может служить величина их относительной электроотрицательности : чем она выше, тем сильнее выражена окислительная способность элемента, и чем ниже, тем ярче проявляется его восстановительная активность. Атомы неметаллов (например, F, O) обладают высоким значением сродства к электрону и относительной электроотрицательности, они легко принимают электроны, т.е. являются окислителями.
Окислительно-восстановительные свойства элемента зависят от степени его окисления. У одного и того же элемента различают низшую, высшую и промежуточные степени окисления.
В качестве примера рассмотрим серу S и ее соединения H 2 S, SO 2 и SO 3 . Связь между электронной структурой атома серы и его окислительно-восстановительными свойствами в этих соединениях наглядно представлена в таблице 3.1.
В молекуле H 2 S атом серы имеет устойчивую октетную конфигурацию внешнего энергетического уровня 3s 2 3p 6 и поэтому не может больше присоединять электроны, но может их отдавать.
Состояние атома, в котором он не может больше принимать электроны, называется низшей степенью окисления.
В низшей степени окисления атом теряет окислительную способность и может быть только восстановителем.
Таблица.1.
|
Формула вещества |
Электронная формула |
Окислительно-восстановительные свойства |
|
|
|
1s 2 2s 2 2p 6 3s 2 3p 6 |
|
|
|
|
1s 2 2s 2 2p 6 3s 2 3p 4 |
окислитель |
восстановитель |
|
|
1s 2 2s 2 2p 6 3s 2 3p o |
окислитель |
|
|
|
1s 2 2s 2 2p 6 3s o 3p 0 |
окислитель |
|
В молекуле SO 3 все внешние электроны атома серы смещены к атомам кислорода. Следовательно, в этом случае атом серы может только принимать электроны, проявляя окислительные свойства.
Состояние атома, в котором он отдал все валентные электроны, называется высшей степенью окисления. Атом, находящийся в высшей степени окисления, может быть только окислителем.
В молекуле SO 2 и элементарной сере S атом серы находится в промежуточных степенях окисления , т.е., имея валентные электроны, атом может их отдавать, но, не имея завершенного р - подуровня, может и принимать электроны до его завершения.
Атом элемента, имеющий промежуточную степень окисления, может проявлять как окислительные, так и восстановительные свойства, что определяется его ролью в конкретной реакции.
Так,
например роль сульфит - аниона SO в следующих реакциях различна:
в следующих реакциях различна:
5Na 2 SO 3 +2KMnO 4 + 3H 2 SO 4 2MnSO 4 + 5Na 2 SO 4 + K 2 SO 4 + 3H 2 O (1)
H 2 SO 3 + 2 H 2 S 3 S + 3 H 2 O (2)
В
реакции (1) сульфит-анион SO в присутствии сильного окислителяKMnO 4
играет роль восстановителя; в реакции
(2) сульфит-анион SO
в присутствии сильного окислителяKMnO 4
играет роль восстановителя; в реакции
(2) сульфит-анион SO -
окислитель, так как H 2 S
может проявлять только восстановительные
свойства.
-
окислитель, так как H 2 S
может проявлять только восстановительные
свойства.
Таким образом, среди сложных веществ восстановителями могут быть:
1. Простые вещества, атомы которых обладают низкими значениями энергии ионизации и электроотрицательности (в частности, металлы).
2. Сложные вещества, содержащие атомы в низших степенях окисления:
HCl ,H 2 S ,N H 3
Na 2 S O 3 , Fe Cl 2 , Sn (NO 3) 2 .
Окислителями могут быть:
1. Простые вещества, атомы которых обладают высокими значениями сродства к электрону и электроотрицательности - неметаллы.
2. Сложные вещества, содержащие атомы в высших степенях окисления: +7 +6 +7
KMn O 4 , K 2 Cr 2 O 7 , HClO 4 .
3. Сложные вещества, содержащие атомы в промежуточных степенях окисления:
Na 2 S O 3 , Mn O 2 , Mn SO 4 .
Размер: px
Начинать показ со страницы:
Транскрипт
1 Опорный конспект. Тема «Окислительно восстановительные реакции ОВР» Окислительновосстановительныминазываются реакции, обусловленные перераспределением электронов между взаимодействующими химическими частицами, в результате которых изменяются степени окисления включенных в их состав атомов. Степень окисления элемента в соединении это: А) условный заряд, приписываемый атому при допущении, что все связи построены по ионному типу; Б) заряд, который возник бы на атоме, если бы электронные пары, которыми он связан с другими атомами, были бы смещены к более электроотрицательному атому.!!! Значение степени окисления ставится над символом химического элемента. Правила определения степеней окисления: 1) Сумма степеней окисления всех атомов в соединении равна нулю (принцип электронейтральности). 2) Сумма степеней окисления элементов в ионе равна заряду иона. 3) Степень окисления элемента в простом веществе равна нулю. 4) Степень окисления однозарядного иона равна заряду иона. 5) Водород в соединениях с неметаллами имеет степень окисления +1(кроме бора и кремния), с металлами, бором и кремнием степень окисления водорода равна 1. 6) Кислород в оксидах, как правило, имеет степень окисления 2. В пероксидах его степень окисления равна 1 (H 2 O 2, Na 2 O 2), в соединении с фтором (+2) OF 2,в супероксидах (1/2), в озонидах (1/3). 7) Высшая (положительная) степень окисления элемента равна номеру группы периодической системы, в которой расположен элемент. Исключения: элементы 1Б группы (Cu, Ag, Au) и VIII Б группы (кроме осмия), кислород, фтор. 8) Низшая (отрицательная) степень окисления характерна для неметаллов и равна номеру группы периодической системы минус 8. К ОВР относятся реакции: *замещения, *соединения, *разложения. Различают следующие типы ОВР: *межмолекулярные изменяются степени окисления атомов, находящихся в разных молекулах, *внутримолекулярные окислитель и восстановитель находятся в одном и том же веществе (чаще всего это реакции термического разложения), *диспропорционирования (дисмутации) или самоокисления самовосстановления функции окислителя и восстановителя выполняют атомы одного и того же элемента в соединении.
2 Упражнение 1. Определите степени окисления элементов в соединениях: ФОСФОРА: НРО 3, Н 3 РО 3, Н 3 РО 4, Н 4 Р 2 О 7, Са 3 (РО 4) 2, РН 3, РН 4 +, РО 3. СЕРЫ: H 2 S, FeS, FeS 2, As 2 S 3, H 2 SO 3, H 2 SO 4, Na 2 S 2 O 3, SO 4, Ag 2 S, H 2 SO 5, SO 2, K 2 SO 3. АЗОТА: N 2 O, NO 2, N 2, NH 3, Ca 3 N 2, N 2 H 4, NH 4 NO 3, CH 3 NH 2, C 6 H 5 NO 2, C 6 H 5 NH 2, NO 2 NO 3. КИСЛОРОДА: К 2 О, КО 3, Н 2 О 2, О 3, О 2, ОF 2. УГЛЕРОДА: СО, СО 2, СН 4, СН 3 СООН, С 2 Н 5 ОН, СН 3 СОСН 3, НСО 3 Н2СО 3, СН 2 О. МАРГАНЦА: MnSO 4, MnO 2, K 2 MnO 4, KMnO 4, Mn 2 O 7, MnO 4. ХРОМА: Cr 2 O 3, K 2 Cr 2 O 7, K 2 CrO 4, Na 2 CrO 2, Na 3 , Cr 2 (SO 4) 3. Упражнение 2. Какие из перечисленных явлений представляют собой окислительно восстановительный процесс? Вариант 1 Вариант 2 Вариант 3 1 Почернение серебряных предметов Образование озона в воздухе при грозе Перевод негашеной извести в гашеную 2 Ржавление железа во влажном воздухе Синтез аммиака Электролиз расплава поваренной соли 3 Сгорание бензина в двигателе Горение древесины Поглощение влаги Р 2 О 5 4 Выделение газа при прокаливании мела 5 Выделение газа при растворении цинка в соляной кислоте Скисание молока Улетучивание газообразных продуктов при прокаливании нашатыря Разогревание раствора при разбавлении серной кислоты Горение свечи Любая ОВР двусторонний процесс, состоящий из полуреакций окисления и восстановления. Восстановитель (е) степень окисления увеличивается. («Отдал электрон, Обзавелся кислородом, Окислился») Окислитель (+е) степень окисления уменьшается. (Взял, Восстановился) // Восстановитель это тот, Кто электроны отдает, Сам отдает грабителю Злодеюокислителю//. При составлении уравнений ОВР необходимо соблюдение двух важнейших правил:
3 1. Правило электронного баланса: Число электронов, отданных вокислительнойполуреакции, должно быть равно числу электронов, принимаемых в полуреакции восстановления. 2. Правило постоянства суммы зарядов: Сумма всех зарядов в левой части уравнения равна сумме всех зарядов в правой части уравнения. В настоящее время чаще всего используется 2 метода нахождения стехиометрических коэффициентов: 1. Метод электронного баланса. Используется для описания гетерогенных процессов. 2. Метод полуреакций или ионно электронный метод. Используется для описания реакций, протекающих в водных растворах, где совмещаются процессы перноса электронов и ионный обмен. Второй метод имеет ряд неоспоримых достоинств: * Нет необходимости определять степени окисления атомов отдельных элементов, что особенно существенно в случае реакций, протекающих с участием органических веществ. * Продукты реакции легко определяются в процессе уравнивания. * Формулы воды, кислоты или щелочи указывают среду и даны для правильного определения продуктов реакции. В процессе уравнивания они могут переходить из одной части уравнения в другую и даже исчезать. Следует отметить, что для успешного протекания ОВР часто приходится регулировать рн среды. В этом случае в окислительно восстановительные пары реагирующих веществ вводят вспомогательные вещества, создающие необходимую среду: для рн 7 серную кислоту, для рн 7 гидроксиды натрия или калия. В водных растворах в окислительно восстановительных процессах активное участие принимают ионы воды: Н + и ОН Запомните следующие правила: *Восстановление: На один атом кислорода, уходящего из частицы окислителя, в кислой среде затрачивается два иона Н + и образуется одна молекула воды; в нейтральной и щелочной среде затрачивается одна молекула воды и образуется два иона ОН. *Окисление: На один атом кислорода, присоединяющегося к частице восстановителя, затрачивается в кислой и нейтральной среде одна молекула воды и образуется два иона Н +; в щелочной среде затрачивается два иона ОН и образуется одна молекула воды. Например: Таблица 1. рн Восстановление Окисление < 7 MnO 4 + 8H + + 5e Mn H 2 O SO H 2 O 2e SO 4 + 2H + = 7 MnO 4 +2Н 2 О + 3e MnO 2 + 4ОН SO H 2 O 2e SO 4 + 2H +
4 > 7 MnO 4 + e MnO 4 SO 3 + 2OH 2e SO 4 + H 2 O Упражнение 3. Составьте уравнения полуреакций окисления или восстановления с учетом кислотности среды: Таблица 2. Кислая среда рн < 7 Нейтральная рн = 7 Щелочная рн > 7 1 NO 3 NO 2 NO 2 NO 3 CrO 2 CrO 4 2 MnO 4 Mn 2+ MnO 4 MnO 2 Al AlO 2 3 Cr 3+ Cr 2 O 7 SO 3 SO 4 NO 3 N 2 Упражнение 4. Составьте уравнения полуреакций восстановления нитратиона (NO 3) в кислой среде до: а) NО 2, б) NО, в) N 2 О, г) NН 4 +. Упражнение 5. Даны схемы переходов: 1) SO 2 S, 2) CaCO 3 Ca(HCO 3) 2, 3) Cr 2 O 3 CrO 3, 4) H 2 O 2 O 2, 5) Cr 2 O 7 CrO 4 Какому процессу соответствует каждый переход: а) окислительному, б) восстановительному, в) обменному? Алгоритм подбора коэффициентов в уравнениях реакций методом электронно ионного баланса рассмотрим на примере следующего уравнения химической реакции: H 2 O 2 + K 2 Cr 2 O 7 + H 2 SO 4 = 1. Записать схемы двух неполных полуреакций: перехода окислителя в его восстановленную форму и восстановителя в его окисленную форму: Cr 2 O 7 Cr 3+ окислитель H 2 O 2 O 2 восстановитель 2. Подвести материальный баланс. Для этого уравнять число атомов всех элементов, кроме кислорода и водорода: Cr 2 O 7 2Cr 3+ H 2 O 2 O 2 После этого числа атомов кислорода и водорода уравнять в зависимости от среды, в которой протекает реакция. Cr 2 O H + 2Cr H 2 O H 2 O 2 O 2 + 2H + 3. Подвести баланс зарядов. Суммарный заряд слева и справа уравнивается прибавлением или вычитанием электронов в левой части схем. Cr 2 O H + + 6e 2Cr H 2 O H 2 O 2 2e O 2 + 2H + 4. К схемам полуреакций подобрать коэффициенты так, чтобы число отданных электронов было равно числу принятых. Cr 2 O H + + 6e 2Cr H 2 O 1 H 2 O 2 2e O 2 + 2H + 3
5 5. Сложить схемы полуреакций с учетом подобранных коэффициентов: Cr 2 O H + + 3H 2 O 2 2Cr H 2 O + 3O 2 + 6H + 6. Сократить «подобные» члены: Cr 2 O H + + 3H 2 O 2 2Cr H 2 O + 3O 2 7. К каждому иону подобрать противоионы в нужном количестве с учетом исходных веществ. Точно такие же ионы и в таком же количестве добавить в правую часть уравнения: Cr 2 O H + + 3H 2 O 2 2Cr H 2 O + 3O 2 2K + + 4SO 4 2K + + 4SO 4 8. Записать формулы веществ в молекулярной форме. В правой части уравнения прежде всего соединяются ионы, дающие малорастворимые или малодиссоциирующие вещества. Остальные ионы комбинируются произвольно 3H 2 O 2 + K 2 Cr 2 O 7 + 4H 2 SO 4 =Cr 2 (SO 4) 3 +3O 2 + K 2 SO H 2 O Упражнение 6. Составьте уравнения окислительновосстановительных реакций между перманганатом калия и сульфитом калия в кислой, нейтральной и щелочной средах, используя приведенные в таблице 1 полуреакции окисления и восстановления. Переходные металлы в низшей степени окисления (ионы Sn 2+,Fe 2+, Cu +,Hg 2 2+ и др.), взаимодействуя с окислителями, способны повышать свою степень окисления, например: 5FeCl 2 + KMnO HCl= 5 FeCl 3 + MnCl 2 + KCl + 4 H 2 O Упражнение 7. Допишите схемы аналогичных реакций; стехиометрические коэффициенты подберите ионноэлектронным методом. а) FeSO 4 + HNO 3 (конц.) = Fe(NO 3) 3 + NO 2 + б)sncl 2 + Cl 2 = SnCl 4 В кислой среде хромат переходит в дихромат: 2K 2 CrO 4 + H 2 SO 4 = K 2 Cr 2 O 7 + K 2 SO 4 + H 2 O Далее происходит восстановление дихромат иона до Cr 3+ : Cr 2 O H + + 6e 2Cr H 2 O Упражнение 8. Составьте уравнения окислительновосстановительных реакций и расставьте коэффициенты методом полуреакций. а) K 2 Cr 2 O 7 + SO 2 + H 2 SO 4 = Cr 2 (SO 4) 3 + K 2 SO 4 + H 2 O б) K 2 Cr 2 O 7 + KNO 2 + H 2 SO 4 = KNO 3 + в) К 2 Cr 2 O 7 + KI + H 2 SO 4 = I 2 + В окислительновосстановительных реакциях пероксид водорода может быть как окислителем: H 2 O 2 + 2H + + 2e 2H 2 O
6 H 2 O 2 + 2e 2OH, так и восстановителем: H 2 O 2 + 2OH 2e O 2 + 2H 2 O H 2 O 2 2e O 2 + 2H + Упражнение 9. Подберите методом электронноионных полуреакций стехиометрические коэффициенты в уравнениях реакций, протекающих с участием пероксида водорода. Укажите, в каких из них пероксид водорода окислитель, а в каких восстановитель? а) H 2 O 2 + PbS = PbSO H 2 O б) H 2 O 2 + NiS + CH 3 COOH = S + Ni(CH 3 COO) 2 + H 2 O в) H 2 O 2 + KMnO 4 + H 2 SO 4 = O 2 + MnSO 4 + K 2 SO 4 + H 2 O Очень сильным окислителем является персульфат аммония (NH 4) 2 S 2 О 8.При составлении уравнений можно считать, что персульфат разлагается, выделяя атомарный кислород, играющий роль окислителя: (NH 4) 2 S 2 О 8 + H 2 O = (NH 4) 2 SO 4 + H 2 SO 4 + [ O] S 2 O 8 + 2e = 2SO 4 Упражнение 10. Методом полуреакций расставьте коэффициенты в следующих уравнениях окислительновосстановительного процесса с участием персульфата аммония, калия и натрия: а) (NH 4) 2 S 2 O 8 + Mn(NO 3) 2 + H 2 O = HMnO 4 + (NH 4) 2 SO 4 + H 2 SO 4 б) K 2 S 2 O 8 + Mn(NO 3) 2 + H 2 O = HMnO 4 + HNO 3 + KHSO 4 в) Na 2 S 2 O 8 + CrCl 3 + NaOH = Na 2 SO 4 + Na 2 CrO 4 +? Эквивалентным числом окислителя (восстановителя) Zназывается такое его количество, которое, восстанавливаясь (окисляясь), присоединяет (высвобождает) 1 моль электронов. Молярная масса эквивалента окислителя (восстановителя) равна молярной массе, деленной на эквивалентное число: Мэ(Х) = М(Х)/ Z, г/моль Упражнение 11. Вычислите эквивалентное число и молярную массу эквивалента серной кислоты в предлагаемых реакциях: а) Zn + H 2 SO 4 (разб.) = ZnSO 4 + Н 2 б) 2HBr + H 2 SO 4 (конц.) = Br 2 + SO H 2 O в) 8HI + H 2 SO 4 (конц.) = 4I 2 + H 2 S + 4 H 2 O Упражнение 12. Предложены схемы окислительно восстановительных реакций. Методом ионно электронного баланса расставьте стехиометрические коэффициенты, рассчитайте эквивалентное число и молярные массы эквивалента окислителя и восстановителя: 1. KMnO 4 + NO +H 2 SO 4 = HNO 3 + MnSO 4 + K 2 SO 4 +KNO 3 + H 2 O 2. PbO 2 + Cr(NO 3) 3 + H 2 O = Pb(NO 3) 2 + H 2 Cr 2 O 7 3. FeSO 4 + K 2 Cr 2 O 7 + H 2 SO 4 = Cr 2 (SO 4) 3 + K 2 SO 4 + Fe 2 (SO 4) 3 + H 2 O 4. KNO 2 + K 2 CrO 4 + KOH + H 2 O = KNO 3 + K 3 5. KMnO 4 + P + H 2 SO 4 = H 3 PO 4 + K 2 SO 4 + MnSO 4
7 6. KClO 3 + KJ + H 2 SO 4 = KCl + J 2 + K 2 SO 4 7. KMnO 4 + SO 2 + H 2 O = H 2 SO 4 + MnSO 4 + K 2 SO 4 8. KJ + H 2 SO 4 = J 2 + KHSO 4 + H 2 S + H 2 O 9. KMnO 4 + Na 2 SO 3 + H 2 SO 4 = K 2 SO 4 + MnSO 4 + H 2 O 10. Bi 2 (SO 4) 3 + Cl 2 + NaOH = NaBiO 3 + NaCl + H 2 O 11. K 2 Cr 2 O 7 + Na 2 SO 3 + H 2 SO 4 = Na 2 SO 4 + K 2 SO 4 + Cr 2 (SO 4) 3 + H 2 O 12. CuS + HNO 3 = Cu(NO 3) 2 + H 2 SO 4 + NO 2 + H 2 O 13. CuS + HNO 3 = Cu(NO 3) 2 + S + NO + H 2 O 14. KMnO 4 + H 2 O 2 + H 2 SO 4 = O 2 + MnSO 4 + K 2 SO 4 + H 2 O 15. Si + K 2 Cr 2 O 7 + H 2 SO 4 = Cr 2 (SO 4) 3 + H 2 SiO 3 + K 2 SO 4 + H 2 O 16. KMnO 4 + KJ + H 2 SO 4 = MnSO 4 + K 2 SO 4 + J 2 + H 2 O 17. Au + H 2 SeO 4 = Au 2 (SeO 4) 3 + SeO 2 + H 2 O 18. K 2 Cr 2 O 7 + H 2 S + H 2 SO 4 = Cr 2 (SO 4) 3 + K 2 SO4 + S + H 2 O 19. MnO + PbO 2 + HNO 3 = HMnO 4 + Pb(NO 3) 2 + H 2 O 20. P + HNO 3 + H 2 O = H 3 PO 4 + NO 21. N 2 H 4 + KMnO 4 + H 2 SO 4 = N 2 + K 2 SO 4 + MnSO 4 + H 2 O 22. K 2 Cr 2 O 7 + HCl = KCl + CrCl 3 + Cl 2 + H 2 O 23. NaH + K 2 Cr 2 O 7 + H 2 SO 4 = Na 2 SO 4 + Cr 2 (SO 4) 3 + K 2 SO 4 + H 2 + H 2 O 24. NaAsO 2 + J 2 + NaOH = Na 3 AsO 4 + NaJ + H 2 O 25. NaBiO 3 + MnSO 4 + H 2 SO 4 = HMnO4 + Bi 2 (SO 4) 3 + Na 2 SO 4 + H 2 O 26. Na 2 FeO 4 + MnSO 4 + H 2 SO 4 = HMnO 4 + Fe 2 (SO 4) 3 + Na 2 SO 4 + H 2 O 27. Zn + H 3 AsO 3 + HCl = ZnCl 2 + AsH 3 + H 2 O 28. MnO 2 + KNO 2 + H 2 SO 4 = MnSO 4 + KNO 3 + H 2 O 29. KJO 3 + KJ + H 2 SO 4 = J 2 + K 2 SO 4 + H 2 O 30. Br 2 + Cl 2 + KOH = KCl + KBrO 3 + H 2 O Константа равновесия ОВР помогает судить не только о направлении, но и о глубине протекания процесса. Для любых ОВР константа равновесия может быть вычислена, если известны окислительно восстановительные потенциалы полуреакций окисления и восстановления: lgk = (E 0 0 ox E red) 0,059 n, где К константа равновесия окислительно восстановительной реакции, Е 0 (ox) и Е 0 (red) нормальные потенциалы окислителя и восстановителя, n количество ионов, принимающих участие в полуреакциях окисления или восстановления (эквивалентное число). Зная константу равновесия, можно рассчитать полноту протекания реакции, не прибегая к эксперименту. Допустим, необходимо рассчитать глубину протекания реакции: Sn + Pb(CH 3 COO) 2 Pb + Sn(CH 3 COO) 2. Найдем в справочнике значения стандартных потенциалов полуреакций: E 0 (Pb/Pb 2+) = 0,126 B; E 0 (Sn/Sn 2+) = 0,136 B [ 0,126 (0,136)]2 0,059 lgk = 0, 339 K = / = 10 0,339 = 2,2
8 Это означает, что равновесие в рассматриваемой системе наступит тогда, когда концентрация ионов свинца в растворе будет в 2,2 раза меньше концентрации ионов олова. То есть на 1 моль ионов свинца должно приходиться 2,2 моль ионов олова. Следовательно, реакция протекает обратимо. (Sn 2) 2,2 100 (2,2 1) 69% Упражнение 13. Вычислите константу равновесия для реакции: 5FeCl 2 + KMnO 4 +4H 2 SO 4 = Fe 2 (SO 4) 3 + 3FeCl 3 + MnSO 4 + KCl + 4H 2 O, если стандартные потенциалы полуреакций равны: E 0 (MnO4 + 8H +) / (Mn H 2 O) = 1,52 B ; E 0 (Fe 2+ / Fe 3+) = 0,77 B. На величину константы равновесия большое влияние оказывает срeда реакции. Существует правило для создания реакционной среды, необходимой для оптимального течения процесса: Если в результате ОВР накапливаются катионы водорода, то создают щелочную среду, а если анионы гидроксила кислую. Упражнение 14. В какую сторону сместится равновесие при увеличении рн раствора: Na 2 SO 3 + Br 2 + H 2 O Na 2 SO HBr 3 K 2 MnO H 2 O MnO 2 2KMnO KOH? Константа равновесия позволяет предсказать возможность растворения вещества. Рассмотрим, возможно ли растворение сульфида меди в азотной кислоте? 3CuS + 2 HNO HNO 3 3 S + 3 Cu(NO 3) NO + 4 H 2 O 3CuS + 2NO H + 3 S + 3 Cu NO + 4H 2 O E 0 1(NO 3 + 4H + / NO + 2H 2 O) = 0,96 B Вычислим окислительновосстановительный потенциал реакции (Е 0 2) CuS Cu 2+ + S, S 2e S. Е 0 2 = Е 0 (S /S) + 0,059/2 lg 1/, гдее 0 (S /S) = 0,51В При = 1 моль/л, концентрацию над осадком сульфида меди можно вычислить из величины произведения растворимости. ПР(CuS) = 3, следовательно, = ПР(CuS) / = 3, тогда Е 0 2 = 0,51 + 0,059/2 lg 1 / 3, = +0,63 В Число ионов, участвующих в окислительновосстановительной реакции равно 6, следовательно, Lg К = (0,96 0,63)6 / 0,059 = 33 и К = 33, то есть CuS хорошо растворим в азотной кислоте. Зависимость окислительновосстановительных потенциалов от рн среды можно рассчитать по формуле Нернста с учетом концентрации ионов водорода:
9 E E 0 0,059 [ Ox][ H ] lg n m, Где m коэффициeнт при концентрации ионов водорода в уравнении полуреакции, например: MnO 4 + 5e + 8 H + Mn 2+ 4 H 2 O; _ ,059 [ MnO4 ][ H ] E E (MnO4 / Mn) lg. 2 5 [ Mn ] Изменяя концентрацию ионов водорода, можно корректировать (уменьшать или увеличивать) окислительновосстановительный потенциал. Это дает возможность целенаправленно и селективно использовать тот или иной окислитель. Упражнение 15. Рассчитайте окислительновосстановительный потенциал системы SO 4 /SO 3, если раствор содержит 0,001 моль/л ионов SO 4, 0,05 моль/л ионов SO 3, 2,9 моль/л ионов водорода, а стандартный окислительновосстановительный потенциал системы H 2 SO 3 + H 2 O SO H + равен 0,20 В. Равновесие большинства окислительновосстановительных реакций можно смещать путем изменения рн среды. Особенно это касается реакций, у которых разница потенциалов окислителя и восстановителя невелика. Рассмотрим, например, возможно ли взаимодействие хлоридиона с дихроматионом в кислой среде? Для этого составим ионноэлектронные уравнения полуреакций: Сr 2 O H + + 6e 2 Cr H 2 O; E 0 = 1,33 B; Cl 2 + 2e 2 Cl ; E 0 = 1,36 B. Так как потенциал второй полуреакции выше, чем первой, в стандартных условиях в прямом направлении реакция не идет. Однако, если к одномолярному раствору дихромата калия добавить более концентрированный, чем 1 М, раствор соляной кислоты, начинается реакция выделения хлора: ,059 [ Cr2O7 ][ H ] E (Cr2O7[ / 2Cr) E (Cr2O7 / 2 Cr) lg [ Cr ] При концентрациях дихроматиона 1 моль/л, а концентрации соляной кислоты 3 моль/л получим следующее значение потенциала: ,059 3 E (Cr 2O7 / Cr) 1,33 lg 1,39 В. 6 1 Таким образом, увеличив концентрацию водородных ионов, удалось осуществить реакцию в нужном направлении. Найдите, какова концентрация ионов водорода в системе Сr 2 O H + + 6e 2 Cr H 2 O, если окислительновосстановительный потенциал равен 1,33, а концентрации дихромат и хром (3)ионов равны, соответственно, 1 и 10 6 моль/л?
10 Проверочные задания 1. Групповая самостоятельная работа 1. Даны элементарные ионы: F, H +, H, Cu +, Cu 2+, Fe 2+, S, S 2, Sn 2+, Mg 2+, Mn 2+, Cl. Какие из них способны проявлять: а) только функцию окислителя; б) только функцию восстановителя; в) двойственную функцию? 2. Данысоединения: NO 2, HNO 3, SO 2, H 2 S 2 O 7, MnO 2, HBrO, Cl 2 O 7, CrO 3, K 2 MnO 4, H 2 SO 5, H 2 O 2,NH 3, N 2 H 4, H 2, HI. Какие из них способны проявлять: а) только функцию окислителя; б) только функцию восстановителя; в) двойственную функцию? 3. Данысложныеионы: SO 4, NO 3, NO 2, NH 4 +, NO 2,ClO, ClO 4, MnO 4, MnO 4, AlH 4. Какие из них способны проявлять: а) только функцию окислителя; б) только функцию восстановителя; в) двойственную функцию? 4. Даны соединения: KClO 2, HCl, HNO 2, KNO 3, H 2 S, ClO 2, H 3 PO 3, H 3 PO 4, MnO 2, Br 2. Какие из них способны к реакциям диспропорционирования? 5.Даны неполные схемы полуреакций: * MnO 4.. = MnO 4 ; * Cr 2 O H + = 2Cr H 2 O; * 2NO H + = N 2 O + 5 H 2 O; * Pt 0 +..= Pt +4: * H 2 O OH = O H 2 O, * SO OH = SO 4 + H 2 O. Какой процесс, окисление или восстановление, отражает каждая схема? Укажите число отданных или принятых в каждой схеме электронов. 6. Даны схемы полуреакций. Определите тип процесса: окисление или восстановление. Допишите схемы реакций, если процесс протекает в кислой среде: * NO 3 NO; * SO 4 H 2 S; * MnO 2 MnO 4 ; * Cr 3+ Cr 2 O Используя метод полуреакций, допишите правые части уравнений окислительно восстановительных процессов: * КMnO 4 + K 2 S + H 2 SO 4 K 2 SO 4 + * КMnO 4 + K 2 S + H 2 O K 2 SO 4 + * КMnO 4 + K 2 S + KOH K 2 SO 4 + * K 2 Cr 2 O 7 + KI + H 2 SO 4 I 2 + Cr 2 (SO 4) 3 +
11 3. Тестовые задания 1.Степень окисления атома в соединении это А)Число его валентных электронов, Б) Условный заряд при условии, что все связи ионные. В)Число электронов, недостающее до завершения внешнего слоя. Г)Число электронных пар, связывающих атом с соседними атомами. 2. Какой из данных элементарных ионов способен проявлять только функцию окислителя? А) Н +, Б) Н, В)I, Г)Cu + 3. Какой из данных элементарных ионов способен проявлять только функцию восстановителя? А)Ca 2+, Б) Fe 2+, В) H +, Г) Au 4. Какой из данных сложных ионов способен проявлять только функцию окислителя? А)CrO 4, Б) NH + 4. В)AlH 4, Г)S 2 O 3 5. Какой из данных сложных ионов способен проявлять только функцию восстановителя? А) MnO 4, Б) PO 3 4, В) 4, Г) SiO 4 6. Какое из соединений обладают двойственной функцией? А) H 4 P 2 O 7, Б) NH 4 NO 3, В) Na 2 Cr 2 O 7, Г) KClO 4 7. Какое из приведенных соединений способно к реакции диспропорционирования? А) KClO 4, Б) Br 2, В) KMnO 4, Г) NH 3 8. В каком соединении хлор проявляет степень окисления +1? А)Cl 2 O, Б) CH 3 Cl, В) CaCl 2, Г) SOCl 2 9. В каком соединении степень окисления углерода равна нулю? А) CH 3 CH 2 OH, Б) CH 3 COOH, В) (CH 3) 2 CO, Г) CH 3 CH Среди данных процессов укажите окислительные процессы. А) H 2 O 2 H 2 O, Б)MnO 4 MnO 4, В) NH + 4 NO 3, Г)H 2 O 2 O Среди данных процессов укажите восстановительные процессы. А) H 2 O 2 H 2 O, Б)MnO 4 MnO 4, В) NH + 4 NO 3, Г)H 2 O 2 O Какие схемы не отражают протекание ОВР? А) Cr 2 O 7 + H 2 O 2CrO 4 + 2H +, Б)Zn + 2H + Zn 2+ + H 2, В) CO 3 + H 2 O +CO 2 2HCO 3, Г) Fe 2+ + NO 3 + 2H + Fe 3+ + NO 2 + H 2 O 13. Какие из процессов относятся к ОВР? А) Образование озона во время грозы, Б) Скисание молока, В) Обжиг пирита (FeS 2) при производстве серной кислоты, Г) Оседание взвешенных примесей при добавлении к сточным водам Al 2 (SO 4) В какой среде протекает процесс восстановления перманганат иона по схеме: MnO 4 MnO 2? А) Кислой, Б) Щелочной, В) Нейтральной, Г) Среда не играет существенной роли 15. В какой среде протекает процесс восстановления перманганат иона по схеме: MnO 4 Mn 2+? А) Кислой, Б) Щелочной, В) Нейтральной, Г) Среда не играет существенной роли
12 16. В какой среде протекает процесс восстановления перманганат иона по схеме:mno 4 MnO 4? А) Кислой, Б) Щелочной, В) Нейтральной, Г) Среда не играет существенной роли 17. Какие вещества не могут выделяться при взаимодействии разбавленной азотной кислоты с активными металлами? А) NO 2, Б) H 2, В) N 2, Г) NO 18. Какую функцию выполняет пероксид водорода в окислительно восстановительном процессе, если продуктами реакции являютсямолекулярный кислород? А)Окислителя, Б) Восстановителя, В) Реакционной среды, Г) Растворителя 19. Какую функцию выполняет пероксид водорода в окислительно восстановительном процессе, если продуктами реакции являются вода? А)Растворителя, Б) Восстановителя, В) Реакционной среды, Г) Окислителя 20. Чему равен фактор эквивалентности химической частицы в процессеокисления? А) Наименьшему общему кратному для числа отданных и принятых электронов, Б) Величине, обратной числу отданных электронов, В) Величине, обратной числу принятых электронов, Г) Величине, обратной наименьшему общему кратному для числа отданных и принятых электронов. 21. Чему равен фактор эквивалентности химической частицы в процессе восстановления? А) Наименьшему общему кратному для числа отданных и принятых электронов, Б) Величине, обратной числу отданных электронов, В) Величине, обратной числу принятых электронов, Г) Величине, обратной наименьшему общему кратному для числа отданных и принятых электронов. 22. Как называются окислительно восстановительные реакции, в ходе которых атомы одного и того же элемента являются и окислителем, и восстановителем? А) Реакции самоокисления самовосстановления. Б) Реакции дисмутации. В) Внутримолекулярные реакции. Г) Реакции диспропорционирования. 23. Какие из предлагаемых схем превращений соответствуют внутримолекулярным окислительно восстановительным реакциям? А) NH 4 NO 3 N 2 O + H 2 O Б) Cl 2 + NaOH Na 2 ClO 3 + NaCl В) S + NaOH Na 2 SO 3 + Na 2 S Г) (NH 4) 2 Cr 2 O 7 N 2 + Cr 2 O 3 + H 2 O 24. Оцените правильность следующих суждений: 1) 1)Водород в соединениях с неметаллами имеет степень окисления +1(кроме бора и кремния), с металлами, бором и кремнием степень окисления водорода равна 1. 2) Кислород в оксидах, как правило, имеет степень окисления 2. В пероксидах его степень окисления равна 1 (H 2 O 2, Na 2 O 2), в соединении с фтором (+2) OF 2, в супероксидах (1/2), в озонидах (1/3). А) Верны оба суждения. Б) Неверны оба суждения. В) Верно только первое суждение. Г) Верно только второе суждение.
13 25.Оцените правильность следующих суждений: 1) условный заряд, приписываемый атому при допущении, что все связи построены по ионному типу; 2) заряд, который возник бы на атоме, если бы электронные пары, которыми он связан с другими атомами, были бы смещены к более электроотрицательному атому. А) Верны оба суждения. Б) Неверны оба суждения. В) Верно толькопервое суждение. Г) Верно только второе суждение. 26. Какие правила необходимо соблюдать при подборе коэффициентов в окислительно восстановительных реакциях? А) Правило рычага. Б) Правило постоянства суммы зарядов. В) Правило аддитивности. Г) Правило электронного баланса. 27. Какие из предлагаемых схем превращений соответствуют окислительно восстановительным реакциям диспропорционирования? А) NH 4 NO 3 N 2 O + H 2 O Б) Cl 2 + NaOH Na 2 ClO 3 + NaCl В) S + NaOH Na 2 SO 3 + Na 2 S Г) (NH 4) 2 Cr 2 O 7 N 2 + Cr 2 O 3 + H 2 O 28. Степень окисления +4 сера проявляет в соединениях: А) MgSБ) SO 2 В) K 2 SO 3 Г) S Какой из ионов проявляет только восстановительные свойства? А) JO 3 Б) JO В) J2 Г) 30. Какая реакция ошибочна? А) H 2 SO 4 +2Ag Ag 2 SO 4 + H 2 Б) 2H 2 S+4Ag+ O 2 2AgS+ 2H 2 O В) 2H 2 SO 4 + 2Ag Ag 2 SO 4 +SO 2 +2H 2 O Г) 2AgNO 3 + K 2 SO 4 Ag 2 SO 4 + 2KNO 3 Расстановка коэффициентов в схемах окислительно восстановительных реакций, протекающих в водных растворах, ионноэлектронным методом 31. KMnO 4 + NO +H 2 SO 4 = HNO 3 + MnSO 4 + K 2 SO 4 + KNO 3 + H 2 O 32. PbO 2 + Cr(NO 3) 3 + H 2 O = Pb(NO 3) 2 + H 2 Cr 2 O FeSO 4 + K 2 Cr 2 O 7 + H 2 SO 4 = Cr 2 (SO 4) 3 + K 2 SO 4 + Fe 2 (SO 4) 3 + H 2 O 34. KNO 2 + K 2 CrO 4 + KOH + H 2 O = KNO 3 + K 3 35. KMnO 4 + P + H 2 SO 4 = H 3 PO 4 + K 2 SO 4 + MnSO KClO 3 + KJ + H 2 SO 4 = KCl + J 2 + K 2 SO KMnO 4 + SO 2 + H 2 O = H 2 SO 4 + MnSO 4 + K 2 SO KJ + H 2 SO 4 = J 2 + KHSO 4 + H 2 S + H 2 O 39. KMnO 4 + K 2 SO 3 + H 2 SO 4 = K 2 SO 4 + MnSO 4 + H 2 O 40. Bi 2 (SO 4) 3 + Cl 2 + NaOH = NaBiO 3 + NaCl + H 2 O 41. K 2 Cr 2 O 7 + Na 2 SO 3 + H 2 SO 4 = Na 2 SO 4 + K 2 SO 4 + Cr 2 (SO 4) 3 + H 2 O 42. CuS + HNO 3 = Cu(NO 3) 2 + H 2 SO 4 + NO 2 + H 2 O 43. CuS + HNO 3 = Cu(NO 3) 2 + S + NO + H 2 O
14 44. KMnO 4 + H 2 O 2 + H 2 SO 4 = O 2 + MnSO 4 + K 2 SO 4 + H 2 O 45. Si + K 2 Cr 2 O 7 + H 2 SO 4 = Cr 2 (SO 4) 3 + H 2 SiO 3 + K 2 SO 4 + H 2 O 46. KMnO 4 + KJ + H 2 SO 4 = MnSO 4 + K 2 SO 4 + J 2 + H 2 O 47. Au + H 2 SeO 4 = Au 2 (SeO 4) 3 + SeO 2 + H 2 O 48. K 2 Cr 2 O 7 + H 2 S + H 2 SO 4 = Cr 2 (SO 4) 3 + K 2 SO4 + S + H 2 O 49. MnO + PbO 2 + HNO 3 = HMnO 4 + Pb(NO 3) 2 + H 2 O 50. P + HNO 3 + H 2 O = H 3 PO 4 + NO 51. N 2 H 4 + KMnO 4 + H 2 SO 4 = N 2 + K 2 SO 4 + MnSO 4 + H 2 O 52. K 2 Cr 2 O 7 + HCl = KCl + CrCl 3 + Cl 2 + H 2 O 53. NaH + K 2 Cr 2 O 7 + H 2 SO 4 = Na 2 SO 4 + Cr 2 (SO 4) 3 + K 2 SO 4 + H 2 + H 2 O 54. NaAsO 2 + J 2 + NaOH = Na 3 AsO 4 + NaJ + H 2 O 55. NaBiO 3 + MnSO 4 + H 2 SO 4 = HMnO4 + Bi 2 (SO 4) 3 + Na 2 SO 4 + H 2 O 56. Na 2 FeO 4 + MnSO 4 + H 2 SO 4 = HMnO 4 + Fe 2 (SO 4) 3 + Na 2 SO 4 + H 2 O 57. Zn + H 3 AsO 3 + HCl = ZnCl 2 + AsH 3 + H 2 O 58. MnO 2 + KNO 2 + H 2 SO 4 = MnSO 4 + KNO 3 + H 2 O 59. KJO 3 + KJ + H 2 SO 4 = J 2 + K 2 SO 4 + H 2 O 60. Br 2 + Cl 2 + KOH = KCl + KBrO 3 + H 2 O
Важнейшие окислители и восстановители Весьма важным является определение самой возможности протекания ОВР, а также установление продуктов реакции. В связи с этим следует отметить, что направление протекания
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ ОСНОВЫ ЭЛЕТРОХИМИИ правильный ответ подчеркнут) 1 Какие вещества относятся к сильным восстановителям: А) оксид марганца IV), оксид углерода IV) и оксид кремния IV);
26. Задачи повышенного уровня сложности (ЧАСТЬ С) 1. Окислительно-восстановительные реакции Окислительно-восстановительными называются реакции, сопровождающиеся изменением степеней окисления атомов в молекулах
РАЗДЕЛ 5 ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ Химические реакции, протекающие с изменением степеней окисления атомов нескольких элементов реагирующих веществ, называются окислительно-восстановительными.
Методические указания Подготовлены профессором Литвиновой Т.Н. Тема: «Окислительно-восстановительные реакции» В природе, в живых организмах, химической промышленности имеют огромное значение окислительно-восстановительные
ХИМИЯ Лекция 07 Окислительно-восстановительные реакции Е.А. Ананьева, к.х.н., доцент, кафедра «Общая Химия» НИЯУ МИФИ Окислительно-восстановительные реакции (ОВР) Окислительно-восстановительные реакции
Лабораторная работа 10. Изучение закономерностей протекания окислительно-восстановительных реакций. Цель работы: Изучение окислительно-восстановительных свойств соединений, освоение методики составления
ХИМИЯ Лекция 06 Окислительно-восстановительные Е.А. Ананьева, к.х.н., доцент, кафедра «Общая Химия» НИЯУ МИФИ (ОВР) (ОВР) Основные понятия При определении степени окисления атома в соединении ВАЖНО
14. Окислительно-восстановительные реакции. Электролиз 14.1. Окислители и восстановители Окислительно-восстановительные реакции протекают с одновременным повышением и понижением степеней окисления элементов
Федеральное агентство по образованию ГОУ ВПО «Уральский государственный технический университет УПИ» А. В. Нечаев Химия Задания для самостоятельной работы по теме «Окислительно-восстановительные реакции»
ЗАНЯТИЕ 6 ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ ТЕОРЕТИЧЕСКАЯ ЧАСТЬ Реакции, протекающие с изменением степени окисления элементов, называются окислительно-восстановительными. Таблица 1 Основные понятия
Перманганат калия как окислитель. KMnO 4 + восстановители в кислой среде Mn +2 в нейтральной среде Mn +4 в щелочной среде Mn +6 (соль той кислоты, которая участвует в реакции) MnSO 4, MnCl 2 MnO 2 Манганат
О. В. Архангельская, И. А. Тюльков., МГУ. Трудная задача. Начнем по порядку. Для подбора коэффициентов в уравнениях окислительно-восстановительных реакциях существуют два метода: электронного баланса электронно-ионного
Министерство образования и науки Российской Федерации Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «Комсомольский-на-Амуре государственный технический
5. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ Окислительно-восстановительными называются химические реакции, сопровождающиеся изменением степени окисления атомов элементов. Окисление процесс отдачи электронов,
1 Окислительно-восстановительные реакции Теоретические предпосылки: Все химические реакции можно разбить на две группы. В реакциях первой группы окисленность всех элементов, входящих в состав реагирующих
ЗАДАНИЯ для 2 этапа Олимпиады «Первые шаги в медицину» по химии ФИО КЛАСС ШКОЛА АДРЕС, ТЕЛЕФОН Вариант 3 (60 баллов) Часть 1 (12 баллов) При выполнении заданий этой части в бланке ответов 1 под номером
Организация подготовки к ЕГЭ по химии: окислительно-восстановительные реакции Лидия Ивановна Асанова к.п.н., доцент кафедры естественнонаучного образования ГБОУ ДПО «Нижегородский институт развития образования»
Лабораторная работа 2* Влияние рн на величину Red-Ox потенциалов. Построение диаграмм E Red-Ox - ph. Краткая теория: Величина окислительно-восстановительного потенциала в природных водах отражает равновесное
Тема «Окислительно-восстановительные реакции» Цели: образовательные: Закрепить знания учащихся об основных положениях теории окислениявосстановления, важнейших окислителях и восстановителях; Совершенствовать
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ (ОВР). ОСНОВНЫЕ ПОНЯТИЯ Задание 5. Сущность ОВР. Окислитель и восстановитель Определи с.о. атомов в реагентах и продуктах реакций. Окислительно-восстановительные
В2 Электроотрицательность. Степень окисления и валентность химических элементов. Реакции окислительно-восстановительные. Коррозия металлов и способы защиты от нее. С1 Реакции окислительно-восстановительные.
1. Какой из перечисленных элементов является наиболее типичным неметаллом? 1) Кислород 2) Сера 3) Селен 4) Теллур 2. Какой из перечисленных элементов имеет наибольшую электроотрицательность? 1) Натрий
Химические свойства солей (средних) ВОПРОС 12 Соли это сложные вещества состоящие из атомов металлов и кислотных остатков Примеры: Na 2 CO 3 карбонат натрия; FeCl 3 хлорид железа (III); Al 2 (SO 4) 3
Окислительно-восстановительные реакции Кузнецова А.А., доцент кафедры ООД Окисление, восстановление Степень окисления Окислители, восстановители Правила определения степени окисления Типы окислительно-восстановительных
3 ВОПРОСЫ ДЛЯ САМОПОДГОТОВКИ 1. Дайте понятие степени окисления (с. о.)? 2. Как определить с.о. для элементов, входящих в состав молекул или сложных ионов? Приведите примеры. 3. Какие реакции относятся
Негребецкий 2008 2010 Лекция 6 Окислительновосстановительные реакции. Основы электрохимии ВАЖНЕЙШИЕ ПОНЯТИЯ ОВР. Основы электрохимии 6.1 Негребецкий 2008 2010 1. Окислительно-восстановительные реакции
1. Взаимосвязь различных классов неорганических веществ При решении задач такого типа особо отметим: 1. Большинство реакций в предлагаемой цепочке превращений окислительно-восстановительные реакции. Поэтому
МУНИЦИПАЛЬНОЕ БЮДЖЕТНОЕ ОБЩЕОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ «КЕЛЬЧИЮРСКАЯ СРЕДНЯЯ ОБЩЕОБРАЗОВАТЕЛЬНАЯ ШКОЛА» «КЕЛЬЧИЮРСА ШÖР ШКОЛА» МУНИЦИПАЛЬНÖЙ СЬÖМКУД ВЕЛÖДАН УЧРЕЖДЕНИЕ СОГЛАСОВАНО УТВЕРЖДАЮ Заместитель
1. Какая реакция соответствует краткому ионному уравнению Н + + ОН - = Н 2 О? 1) ZnCl 2 + 2NaOH = Zn(OH) 2 + 2NaCl, 2) H 2 SO 4 + CuSO 4 = CuSO 4 + 2H 2 O, 3) NaOH + HNO 3 = NaNO 3 + H 2 O 4) H 2 SO 4
Министерство образования и науки Российской Федерации Государственное образовательное учреждение высшего профессионального образования «САНКТ-ПЕТЕРБУРГСКИЙ ГОСУДАРСТВЕННЫЙ МОРСКОЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ»
1 раздел 1. Периодическая система и периодический закон Д.И. Менделеева. Строение периодической системы: группы, подгруппы, периоды, ряды. Изменение свойств элементов и их соединений в пределах группы
C1 Химия. 11 класс. Вариант ХИ1060 1 Критерии оценивания заданий с развёрнутым ответом Используя метод электронного баланса, составьте уравнение реакции: Cu 2 O + = SO 2 + + H 2 O Определите окислитель
Уравнения окислительновосстановительных реакций Тема 4 Роль окислительновосстановительных реакций Определение Окислительно-восстановительные реакции протекают с одновременным повышением и понижением степеней
ФЕЛЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ Государственное образовательное учреждение высшего профессионального образования УХТИНСКИЙ ГОСУДАРСТВЕННЫЙ ТЕХНИЧЕСКИЙ УНИВЕРСИТЕТ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ РЕАКЦИИ
Задания 9 класса 1. Положительную степень окисления азот проявляет в соединении: 1. NO 3. Na 3 N 2. NH 3 4. N 2 H 4 2. Металлический натрий не реагирует с: 1. HCl 2. O 2 3. К основным оксидам относится:
1. Чему равен заряд ядра атома углерода? 1) 0 2) +6 3) +12 4) -1 2. Что общего в атомах 12 6С и 11 6С? 1) Массовое число 2) Число протонов 3) Число нейтронов 4) Радиоактивные свойства Входные тесты по
Шифр Часть 1 Часть 2 С1 С2 С3 С4 С5 С6 Ʃ Итоговый балл Итоговый балл (из 100 баллов) (из 10 баллов) Вступительная работа для поступающих в 10 ФХ и ХБ классы Решение (правильные ответы выделены жирным шрифтом)_
Федеральное агентство по образованию Государственное образовательное учреждение высшего профессионального образования Владимирский государственный университет Н.А. ОРЛИН, В.А. КУЗУРМАН ОБЩАЯ И НЕОРГАНИЧЕСКАЯ
1. Чему равен заряд ядра атома азота? 1) +5 2) -3 3) +3 4) +7 2. Что общего в атомах 35 17Сl и 37 17Сl? 1) Массовое число 2) Число протонов 3) Число нейтронов 4) Радиоактивные свойства Входные тесты по
Частное образовательное учреждение среднего профессионального образования «Краснодарский техникум управления, информатизации и сервиса» Методическая разработка практического занятия по химии по теме «Окислительно-восстановительные
Электроотрицательность. и валентность химических элементов. Окислительно-восстановительные реакции. Коррозия металлов и способы защиты от неё. 1. Установите соответствие между формулой вещества и степенью
ХИМИЯ, 11 класс Вариант 1, Ноябрь 2010 Краевая диагностическая работа по ХИМИИ ВАРИАНТ 1 При выполнении заданий А1 А8 в бланке ответов 1 под номером выполняемого задания поставьте знак «х» в клеточку,
Вариант 1 1. Составьте молекулярные и ионно-молекулярные уравнения реакций, протекающих до образования средних солей, между веществами: а) нитрат цинка + гидроксид калия; б) гидроксид кальция + серная
Как быстро расставить коэффициенты в уравнениях окислительно-восстановительных реакций 33 Д. И. Мычко, кандидат химических наук, доцент кафедры неорганической химии БГУ В средней школе меня, как и всех
Степень окисления 12 В отличие от валентности, для степени окисления обязательно надо указывать знак (+ или). При этом степень окисления по величине далеко не всегда равна валентности. Например в молекуле
1. Основные свойства проявляет внешний оксид элемента: 1) серы 2) азота 3) бария 4) углерода 2. Какая из формул соответствует выражению степени диссоциации электролитов: 1) α = n\n 2) V m = V\n 3) n =
МЕТОДИКА ПРЕПОДАВАНИЯ ХИМИИ В 9 КЛАССАХ ОБЩЕОБРАЗОВАТЕЛЬНЫХ ШКОЛ (II ЧЕТВЕРТЬ). Учитель химии ГОУ СОШ 102 ЮЗАО г. Москва (округ Академический) Н.В.Андреева. ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫЕ ПРОЦЕССЫ. Необходимо
ХИМИЯ Контрольный срез по химии для 8 класса (итоговое тестирование) 1 вариант 1. Сколько электронов находится на внешнем уровне элемента с порядковым номером 11? 1) 1 2) 3 3) 8 4) 11 2. На данном рисунке
ЗАДАНИЕ 2 Примеры решения задач Пример 1. Укажите, какие химические процессы лежат в основе получения фосфорной кислоты. Напишите уравнения реакций получения H 3 РO 4. Термический способ получения фосфорной
Самостоятельная работа учащихся 9б, 10аб, 11а классов по химии в период карантина. класс Тема для самостоятельного изучения Отчет о проделанной работе 9б 25 Аммиак. письменно ответить на 1. Строение молекулы
Уравнения окислительновосстановительных реакций Тема 4 Определение Окислительно-восстановительные реакции протекают с одновременным повышением и понижением степеней окисления элементов и сопровождаются
Тест по химии 11 класс (базовый уровень) Тест «Типы химических реакций (химия 11 класс, базовый уровень) Вариант 1 1. Закончить уравнения реакций и указать их тип: а) Al 2 O 3 +HCl, б) Na 2 O + H 2 O,
Окислительно-восстановительные реакции Степень окисления это условный заряд атомов химического элемента в соединении, вычисленный на основе предположения, что все соединения состоят только из ионов. Окислительно-восстановительные
1. Чему равен заряд ядра атома кислорода? 1) 2 2) +6 3) +7 4) +8 2. Что общего в атомах 1 1Н, 2 1Н, 3 1Н? 1) Массовое число 2) Число протонов 3) Число нейтронов 4) Радиоактивные свойства Входные тесты
МКОУ ХМР СОШ с. Елизарово соединения АЗОТА Учитель химии: Касьянова И.А. Азот образует с водородом несколько прочных соединений, из которых важнейшим является аммиак. Электронная формула молекулы аммиака
26 Ключ к варианту 1 1. Напишите электронные формулы атомов алюминия и серы. Определите степени окисления атома серы в следующих соединениях: А1 2 S 3, А1 2 (SO 4) 3, Na 2 SO 3, Na 2 S 2 O 3, S 8. Al:
1 Во сколько раз уменьшится концентрация ОН в 0,1 н растворе NH OH при прибавлении к нему твердого NH Cl до концентрации 1 моль/л Вывести формулу для вычисления рн раствора слабой одноосновной кислоты
«Водородный показатель. Реакции обмена. Гидролиз солей» 1. Рассчитайте концентрацию ионов , если концентрация ионов водорода в растворе составляет = 1 10 8 моль/л. 2. Составьте уравнения реакций
МИНОБРНАУКИ РОССИИ Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования «Ухтинский государственный технический университет» (УГТУ) Химия Окислительно-восстановительные
6. Общая характеристика металлов главных подгрупп I-III групп Металлы это химические элементы, атомы которых легко отдают электроны внешнего (а некоторые и предвнешнего) электронного слоя, превращаясь
ЗАДАНИЕ 3 Примеры решения задач Пример 1. В четырех пробирках без надписей находятся растворы следующих веществ: сульфата натрия, карбоната натрия, нитрата натрия и йодида натрия. Покажите, с помощью каких
Отложенные задания (180) В окислительно-восстановительной реакции Cu+HNO 3 (разб) Cu(NO 3) 2 +NO+H 2 O коэффициент перед окислителем 1) 8 2) 10 3) 6 4) 4 В уравнении реакции полного сгорания сероводорода
Пример 1 Примеры решения задач Исходя из степени окисления брома в соединениях: КBr, Br, BrF, BrO, HBrO, определите, какое из веществ может быть только окислителем, какое только восстановителем, а какое
Вопросы к промежуточной аттестации по химии в 8-9 классах на 2012-2013 учебный год Учебник Г.Е, Рудзитис, Ф.Г.Фельдман «Химия 8 класс», «Химия 9 класс» Москва 2009 1. Периодический закон и периодическая
Подготовка к ЕГЭ по химии Окислительновосстановительные реакции МБОУ гимназия «Лаборатория Салахова» О.Г. Степаненко Место окислительно восстановительных реакций в КИМ ЕГЭ 2015 года по ХИМИИ 1 Часть1 Строение
Рассмотрите приведённые ниже схемы уравнений реакций. В чём их существенное отличие? Изменились ли степени окисления элементов в этих реакциях?
В первом уравнении степени окисления элементов не изменились, а во втором изменились – у меди и железа .
Вторая реакция относится к окислительно-восстановительным.
Реакции, в результате которых изменяются степени окисления элементов, входящих в состав реагирующих веществ и продуктов реакции, называют окислительно-восстановительными реакциями (ОВР).
СОСТАВЛЕНИЕ УРАВНЕНИЙ ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНЫХ РЕАКЦИЙ.
Существуют два метода составления окислительно - восстановительных
реакций - метод электронного баланса и метод полуреакций. Здесь мы рассмотрим
метод электронного баланса .
В этом методе сравнивают степени окисления атомов в исходных веществах и в
продуктах реакции, при этом руководствуемся правилом: число
электронов, отданных восстановителем, должно равняться числу электронов,
присоединённых окислителем.
Для составления уравнения надо знать формулы реагирующих веществ и продуктов
реакции. Рассмотрим этот метод на примере.
|
Расставить коэффициенты в реакции, схема которой: HCl + MnO 2 = Cl 2 + MnCl 2 + H 2 O |
|
Алгоритм расстановки коэффициентов |
|
1.Указываем
степени окисления химических элементов. Подчёркнуты химические элементы, в которых изменились степени окисления. |
|
2.Составляем электронные уравнения, в которых указываем число отданных и принятых электронов. За
вертикальной чертой ставим число электронов, перешедших при окислительном и
восстановительном процессах. Находим наименьшее общее кратное (взято в
красный кружок). Делим это число на число перемещённых электронов и получаем
коэффициенты (взяты в синий кружок). Значит, перед марганцем будет стоять
коэффициент-1, который мы не пишем, и перед Cl 2 тоже -1. |
|
Рассмотрим более сложное уравнение: |
|
H 2 S + KMnO 4 + H 2 SO 4 =S + MnSO 4 + K 2 SO 4 + H 2 O |
|
Расставляем степени окисления химических элементов: |
|
Электронные уравнения примут следующий вид Перед серой со степенями окисления -2 и 0 ставим коэффициент 5, перед соединениями марганца -2, уравниваем число атомов других химических элементов и получаем окончательное уравнение реакции |
Основные положения теории окислительно-восстановительных реакций
1. Окислением называется процесс отдачи электронов атомом, молекулой или ионом .
Например:
Al – 3e - = Al 3+
Fe 2+ - e - = Fe 3+
H 2 – 2e - = 2H +
2Cl - - 2e - = Cl 2
При окислении степень окисления повышается .
2. Восстановлением называется процесс присоединения электронов атомом, молекулой или ионом .
Например:
S + 2е - = S 2-
Сl 2 + 2е- = 2Сl -
Fe 3+ + e - = Fe 2+
При восстановлении степень окисления понижается .
3. Атомы, молекулы или ионы, отдающие электроны называются восстановителями . Во время реакции они окисляются .
Атомы, молекулы или ионы, присоединяющие электроны, называются окислителями . Во время реакции они восстанавливаются .
Так как атомы, молекулы и ионы входят в состав определенных веществ,то и эти вещества соответственно называются восстановителями или окислителями .
4. Окислительно-восстановительные реакции представляют собой единство двух противоположных процессов - окисления и восстановления.
Число электронов, отдаваемых восстановителем, равно числу электронов, присоединяемых окислителем .
ТРЕНАЖЁРЫ
Тренажёр №1 Окислительно-восстановительные реакции
Тренажёр №2 Метод электронного баланса
Тренажёр №3 Тест «Окислительно-восстановительные реакции»
ЗАДАНИЯ ДЛЯ ЗАКРЕПЛЕНИЯ
№1. Определите степень окисления атомов химических элементов по формулам их соединений: H 2 S , O 2 , NH 3 , HNO 3 , Fe , K 2 Cr 2 O 7
№2. Определите, что происходит со степенью окисления серы при следующих переходах:
А) H 2 S → SO 2 → SO 3
Б) SO 2 → H 2 SO 3 → Na 2 SO 3
Какой можно сделать вывод после выполнения второй генетической цепочки?
На какие группы можно классифицировать химические реакции по изменения степени окисления атомов химических элементов?
№3. Расставьте коэффициенты в УХР методом электронного баланса, укажите процессы окисления (восстановления), окислитель (восстановитель); запишите реакции в полном и ионном виде:
А) Zn + HCl = H 2 + ZnCl 2
Б) Fe + CuSO 4 = FeSO 4 + Cu
№4.
Данысхемыуравненийреакций:
СuS + HNO 3 (разбавленная) = Cu(NO 3) 2 +
S + NO + H 2 O
K + H 2 O = KOH + H 2
Расставьте коэффициенты в реакциях используя метод электронного баланса.
Укажите вещество - окислитель и вещество - восстановитель.
МОУ «Средняя общеобразовательная школа №9 с углубленным изучением английского языка» Ново – Савиновского района г. Казани
Конспект урока по химии
в 9 классе
«Составление уравнений
Работу выполнила
учитель химии и естествознания
Чекункова Елена Владимировна
Казань, 2011
Конспект урока по химии в 9 классе
Тема урока: « Составление уравнений
окислительно – восстановительных реакций»
Цель урока: продолжить формирование понятий «степень окисления», «окислитель», «восстановитель», «окислительно – восстановительные реакции», «метод электронного баланса»; познакомить учащихся с заданиями ГИА и ЕГЭ, рассматривающих данные вопросы; познакомить учащихся с особенностями протекания окислительно-восстановительных реакций в различных средах.
Образовательные задачи:
-
повторить основные понятия об окислении и восстановлении, степени окисления, окислителях и восстановителях, рассмотреть сущность окислительно-восстановительных реакций;
- выработать умения по составлению уравнений химических реакций, протекающих в различных средах методом электронного баланса
.
Развивающие задачи :
Способствовать формированию и развитию познавательного интереса учащихся к предмету;
- способствовать развитию речи учащихся;
-
формирование умения анализировать, сопоставлять, и обобщать знания по теме;
- способствовать овладению учащимися всеми видами памяти.
Воспитательные задачи:
Воспитание осознанной потребности в знаниях;
- совершенствовать умение выслушивать мнение каждого члена коллектива, делать самостоятельные выводы;
- развитие любознательности.
Тип урока: комбинированный (словесно – наглядно – практический).
Место данного урока в теме: второй урок в теме «Окислительно-восстановительные реакции» в разделе «Химия в задачах» при изучении элективного курса «Химия-9».
Методическое оснащение урока:
1. Материально-техническая база:
- кабинет химии, персональный компьютер, медиапроектор.
2. Дидактическое обеспечение:
- рабочая тетрадь учащихся;
- презентация в Power Point ;
- материалы для контроля знаний учащихся.
План урока:
Актуализация знаний;
Объяснение новой темы;
Закрепление изученного материала;
Запись домашнего задания.
Ход урока:
1 . Актуализация знаний.
1.1 Беседа по материалам прошлого урока.
Вопросы к беседе:
Какие реакции называются окислительно- восстановительными? (идущие с изменением степеней окисления атомов);
Что такое окисление? (процесс отдачи электронов атомом, ионом или молекулой);
Какой процесс называется восстановлением? (процесс принятия электронов атомом, ионом или молекулой);
Как называются вещества, отдающие электроны? (…восстановителями);
Как называются вещества, принимающие электроны? (…окислителями);
Что такое «степень окисления»? (СЭ – это условный заряд атома в соединении, вычисленный исходя из предположения, что оно состоит только из ионов);
Что происходит со степенью окисления элемента в процессе
его восстановления? (степень окисления понижается);
8)Что происходит со степенью окисления элемента в процессе
его окисления? (степень окисления повышается);
9)Как классифицируются ОВР? (ОВР бывают внутримолекулярные, межмолекулярные, реакции диспропорционирования);
10) Какой элемент в ПС является самым сильным окислителем?, восстановителем? (фтор; франций);
11) Какие элементы в ПС имеют постоянные степени окисления и какие конкретно? (щелочные металлы+1; щелочноземельные металлы+2; цинк+2; алюминий+3);
12) Приведите примеры соединений, содержащих в своем составе атомы серы, которые будут проявлять: а) только окислительные, б) только восстановительные; в) и окислительные, и восстановительные свойства? (H 2 SO 4 ; H 2 S ; H 2 SO 3 ) .
Учитель: окислительно-восстановительные реакции и вся теория, которую мы с вами повторили и обобщили, имеют место в заданиях ГИА (В3) и ЕГЭ(А27, В2, С1). Давайте решим сначала задания из ГИА, а затем перейдем к заданиям ЕГЭ, и вы убедитесь, что теоретическая основа, которую мы с вами закладываем на наших уроках сейчас, помогут вам в будущем ответить на вопросы изучаемой темы при сдаче ЕГЭ.
Итак, внимание на экран: работа с заданиями слайдов 7 – 12.
Используются задания из вариантов ГИА и ЕГЭ, разработанных сотрудниками ФИПИ.
Ответьте, пожалуйста, на следующий вопрос: какой элемент по окислительным свойствам стоит на втором месте после фтора? (Ответ учащихся: кислород, и далее, галогены. Причем, окислительные свойства галогенов уменьшаются от хлора к иоду).
Важно так же знать, что помимо кислорода сильными окислительными свойствами обладают соединения, в которых есть кислород. Мы с вами сегодня знакомимся с сильнейшим окислителем – перманганатом калия, формула которого… KMnO 4
Объяснение нового материала.
Перманганат калия является сильным окислителем за счет иона MnO 4 2- , в котором марганец находится в высшей степени окисления +7. Именно поэтому марганец может только восстанавливаться в результате ОВР. И восстанавливаться до конкретных продуктов. (слайд 14)
Наша с вами задача сегодня научиться предугадывать продукты ОВР, в которых принимает участие KMnO 4 .
Рассмотрим сначала восстановление перманганата калия в кислой среде.
(слайд 15)
KMnO 4 + KI + H 2 SO 4
Существует алгоритм по составлению таких реакций. Давайте им воспользуемся…
Сначала проставляют степени окисления элементов:
KMn +7 O 4 + KI -1 + H 2 S +6 O 4
Затем рассуждают, какие элементы и как будут изменять степень окисления. Воспользуемся схемой. Так как реакция протекает в кислой среде, ион MnO 4 2- будет переходить в ион Mn 2+ , понижая степень окисления. Значит, нужно найти элемент, который способен повысить степень окисления. Таким ионом является ион I - .
Mn +7 + 5e- Mn +2 2 пр . восст . окислитель
2I -1 - 2e- I 2 0 5 пр . окисл . восст-ль
Составляем электронный баланс. И далее записываем продукты данной реакции и расставляем коэффициенты. Напоминаю вам о том, что стехиометрические коэффициенты, которые вы получили в электронном балансе, должны иметь место в реакции! (в презентации обозначены красным и зеленым цветами).
2 KMnO 4 + 10 KI + 8 H 2 SO 4 2 MnSO 4 + 5 I 2 + 6 K 2 SO 4 + 8 H 2 O 4 + KNO 2 + H 2 SO 4
Учащиеся на доске и в тетрадях пишут уравнение реакции и самостоятельно расставляют коэффициенты методом электронного баланса.
А теперь, ребята, когда теоретический материал позади, давайте включим в работу визуальную память. Для этого я вам предлагаю посмотреть реакции восстановления перманганата калия в различных средах.
Учитель демонстрирует реакции взаимодействия растворов KMnO 4 и K 2 SO 3 в нейтральной, кислой и щелочной средах.
Итоги и выводы.
Мы познакомились с особенностями протекания окислительно-восстановительных реакций в различных средах.
Вспомнили, как расставлять коэффициенты методом электронного баланса.
Научились записывать продукты окислительно-восстановительных реакций с участием перманганата калия.
Задание на дом.
Допишите уравнение реакции и расставьте коэффициенты с помощью метода электронного баланса:
KMnO 4 + HBr
Список использованных источников:
Хомченко Г.П. Пособие по химии для поступающих в ВУЗы. – 4-е изд.,испр. и доп. – М.:ООО «Издательство Новая волна»,2004.-480 с.
Общая химия: Учебник/Под ред. Е.М.Соколовской и Л.С.Гузея. -3-е изд., перераб. и доп. – М.: Изд-во Московского университета, 1989. – 640 с.
ГИА 2011. Химия. 9 класс. Государственная итоговая аттестация (в новой форме). Типовые тестовые задания/А.С.Корощенко, Ю.Н.Медведев. –М.:Издательство «Экзамен», 2011. – 94 с.
ЕГЭ – 2011. Химия: типовые экзаменационные варианты: 30 вариантов/под. ред. А.А Кавериной. – М.: Национальное образование, 2011. – 368 с. – (ЕГЭ – 2011. ФИПИ – школе).
Конспект урока по химии в 9 классе: «Окислительно-восстановительные реакции»
Цель урока:
Рассмотреть сущность ОВР, повторить основные понятия о степени окисления, об окислении и восстановлении.
Оборудование и реактивы: Набор пробирок, растворы: CuSO4 , H2SO4, NaOH, H2O, Na2SO3.
Ход урока по химии в 9 классе
Организационный момент.
Сегодня на уроке мы продолжим ознакомление с окислительно-восстановительными реакциями , закрепим знания приобретенные на предыдущих занятиях, ознакомимся с реакциями окисления-восстановления, узнаем какую роль оказывает среда на протекание окислительно-восстановительные процессы. ОВР принадлежат к числу наиболее распространенных химических реакций и имеют огромное значение в теории и практике. ОВ процессы сопровождают круговороты веществ в природе, с ними связаны процессы обмена веществ, протекающие в живом организме, гниение, брожение, фотосинтез. Их можно наблюдать при сгорании топлива, в процессе выплавке металлов, при электролизе, в процессах коррозии. (слайды 1-7).
Тема окислительно-восстановительные реакции не нова, учащимся предлагалось повторить некоторые понятия и умения. Вопрос к классу? Что таксе степень окисления? (без этого понятия и умения расставлять степень окисления химических элементов не возможно рассмотрение данной темы.) Учащимся предлагается определить степень окисления в следующих соединениях:KCIO3, N2, K2Cr2O7, P2O5, KH, HNO3. Проверяют свои задания с записями на доске. Во всех ли случаях происходит изменение степени окисления. Для этого мы проведем лабораторную работу (на столах инструкции по выполнению опытов, инструктаж по т.б).
Провести опыты :1. CuSO4 + 2NaOH= Na2SO4 + Cu(OH)2
CuSO4 + Fe= Cu FeSO4
Расставляют со делают записи. Вывод: не все реакции относят к ОВР. (слайд 8).
В чем же заключается суть ОВР?(слайд 9).
ОВР-представляет собой единство двух противоположных процессов окисления и восстановления. В этих реакциях число отданных электронов восстановителем равно числу электронов присоединенных окислителем. Восстановитель повышает свою степень окисления, окислитель понижает.(не случайно выбран девиз урока.)Рассмотрим химическую реакцию(она имеет большое значение с точки зрения экологии т.к. позволяет при обычных условиях собрать случайно пролитую ртуть.
Н g0 + 2Fe+3Cl3-=2Fe+2Cl2-1 + Hg+2Cl2-1
Hg0 - 2ē → Hg+2
Fe+3+ē→ Fe+2
Учащимся предлагается решить задачу. Как среда влияет на поведение одного и того же окислителя, например: KMnO4
Выполняется лабораторная работа 2 по вариантам:
2KMnO4+ 5Na2SO3 +3H2SO4 = 2MnSO4 + 5Na2SO4 + K2SO4 +3H2O
2KMnO4+ Na2SO3 2KOH= 2K2Mn04+Na2SO4 H2O
2KMnO4 +3Na2SO3 +H2O= 2KOH +3Na2SO4+ 2MnO2
Вывод: среда влияет на окислительные свойства веществ.(слайд 10)
KMnO4 в кислой среде-Mn+2 -бесцветный раствор.
В нейтральной среде -MnO2 -бурый осадок,
В щелочной среде -MnO4-2 -зеленого цвета.
В зависимости от РН раствора KMnO4 окисляет различные вещества, восстанавливаясь до соединений Mn разной степени окисления.
Подводятся итоги урока. Выставляются оценки.
Рефлексия.
Класс высказывает свое мнение о работе на уроке.
Домашнее задание
Скачать презентацию к уроку по химии: «Окислительно-восстановительные реакции»



 –2
–2

 ;
;
 - 6
- 6

 ;
;
 - 8
- 8

 восстановитель
восстановитель

 +
2
+
2


 –4
–4

 ;
; -
6
-
6




 +
4
+
4 

 ;
; +
6
+
6


 -2
-2

 восстановитель
восстановитель

 +
2
+
2

 ;
;
 + 6
+ 6

 ;
; +
8
+
8