Chemische Eigenschaften von Alkenen Herstellungsoption 1. Physikalische Eigenschaften von Alkenen, Anwendung, Herstellungsverfahren
Alkene sind ungesättigte Kohlenwasserstoffedie eine Doppelbindung zwischen Atomen haben. Ihr anderer Name ist Olefine, er ist mit der Entdeckungsgeschichte dieser Verbindungsklasse verbunden. Grundsätzlich kommen diese Substanzen nicht in der Natur vor, sondern werden vom Menschen für praktische Zwecke synthetisiert. In der IUPAC-Nomenklatur wird der Name dieser Verbindungen nach dem gleichen Prinzip wie bei Alkanen gebildet, nur das Suffix "an" wird durch "en" ersetzt.
In Kontakt mit
Alkenstruktur
Zwei Kohlenstoffatome, die an der Bildung einer Doppelbindung beteiligt sind, befinden sich immer in der sp2-Hybridisierung, und der Winkel zwischen ihnen beträgt 120 Grad. Die Doppelbindung wird durch überlappende π -π-Orbitale gebildet und ist nicht sehr stark, so dass diese Bindung leicht zu brechen ist, was für die chemischen Eigenschaften von Substanzen verwendet wird.
Isomerie
Im Vergleich zu den Grenzwerten ist dies bei diesen Kohlenwasserstoffen möglich mehr Typen, sowohl räumlich als auch strukturell. Strukturisomerie kann auch in verschiedene Typen eingeteilt werden.
Die erste existiert auch für Alkane und besteht in einer anderen Reihenfolge der Verbindung von Kohlenstoffatomen. Isomere können also Penten-2 und 2-Methylbuten-2 sein. Und die zweite ist eine Änderung der Position der Doppelbindung.
Eine räumliche Isomerie in diesen Verbindungen ist aufgrund des Auftretens einer Doppelbindung möglich. Es gibt zwei Arten - geometrische und optische.
Die geometrische Isomerie ist eine der am weitesten verbreiteten Arten in der Natur, während geometrische Isomere fast immer radikal unterschiedliche physikalische und chemische Eigenschaften aufweisen. Unterscheiden cis- und trans-Isomere.Im ersteren befinden sich die Substituenten auf einer Seite der Mehrfachbindung, während sie sich in den trans-Isomeren in verschiedenen Ebenen befinden.
Alkene-Produktion
 Sie wurden wie viele andere Substanzen zunächst völlig zufällig gewonnen.
Sie wurden wie viele andere Substanzen zunächst völlig zufällig gewonnen.
Der deutsche Chemiker und Forscher Becher untersuchte Ende des 17. Jahrhunderts die Wirkung von Schwefelsäure auf Ethylalkohol und erkannte dies erhielt ein unbekanntes Gas, das reaktiver als Methan ist.
Später ähnliche Studien Unter der Leitung mehrerer weiterer Wissenschaftler erfuhren sie auch, dass dieses Gas bei Wechselwirkung mit Chlor eine ölige Substanz bildet.
Daher war anfangs diese Verbindungsklasse gegeben den Namen Olefine, was übersetzt als ölig. Bestimmen Sie aber trotzdem die Zusammensetzung und Struktur diese Verbindung Die Wissenschaftler hatten keinen Erfolg. Dies geschah nur fast zwei Jahrhunderte später, am Ende des neunzehnten Jahrhunderts.
Derzeit gibt es viele Möglichkeiten, Alkene zu erhalten.
Industrielle Methoden
Empfang industrielle Methoden:
- Dehydrierung von gesättigten Kohlenwasserstoffen. Diese Reaktion ist nur unter Einwirkung von hohen Temperaturen (etwa 400 Grad) und Katalysatoren möglich - entweder Chromoxid 3 oder Aluminiumoxid-Platin-Katalysatoren.
- Dehalogenierung von Dihalogenalkanen. Es tritt nur in Gegenwart von Zink oder Magnesium auf und wann hohe Temperaturen.
- Dehydrohalogenierung von Halogenalkanen. Es wird mit Natrium- oder Kaliumsalzen organischer Säuren bei erhöhten Temperaturen durchgeführt.
Wichtig! Diese Verfahren zur Gewinnung von Alkenen ergeben kein reines Produkt, das Ergebnis der Reaktion ist ein Gemisch aus ungesättigten Kohlenwasserstoffen. Die vorherrschende Verbindung unter ihnen wird unter Verwendung der Zaitsev-Regel bestimmt. Es heißt, dass Wasserstoff höchstwahrscheinlich von dem Kohlenstoffatom abgespalten wird, das die geringsten Bindungen mit den Wasserstoffatomen aufweist.
Dehydration von Alkoholen. Es kann nur beim Erhitzen und in Gegenwart von Lösungen starker Mineralsäuren mit wasserentfernender Eigenschaft durchgeführt werden.
Hydrierung von Alkinen. Nur in Gegenwart von Paladiumkatalysatoren möglich.
Chemische Eigenschaften von Alkenen
Alkene sind sehr chemisch aktive Substanzen.Dies ist hauptsächlich auf das Vorhandensein einer Doppelbindung zurückzuführen. Die charakteristischsten Reaktionen für diese Verbindungsklasse sind die elektrophile und radikalische Addition.
- Halogenierung von Alkenen - bezieht sich auf die klassischen Reaktionen der elektrophilen Addition. Es tritt nur in Gegenwart inerter organischer Lösungsmittel auf, meistens Tetrachlorkohlenstoff.
- Hydrohalogenierung. Das Fügen dieser Art erfolgt nach der Markovnikov-Regel. Das Ion bindet an den stärker hydrierten Kohlenstoff nahe der Doppelbindung, und dementsprechend bindet sich das Halogenidion an den zweiten Kohlenstoff. Diese Regel wird in Gegenwart von Peroxidverbindungen verletzt - der Harrosh-Effekt. Die Zugabe von Halogenwasserstoff erfolgt völlig entgegen der Markovnikov-Regel.
- Hydroborieren. Diese Reaktion ist von erheblicher praktischer Bedeutung. Daher der Wissenschaftler, der es sogar entdeckt und studiert hat erhielt den Nobelpreis. Diese Reaktion wird in mehreren Stufen durchgeführt, während die Zugabe des Borions nicht der Markovnikov-Regel folgt.
- Alkenhydratation oder -zugabe. Diese Reaktion verläuft ebenfalls nach der Markovnikov-Regel. Das Hydroxidion ist in der Doppelbindung an das am wenigsten hydrierte Kohlenstoffatom gebunden.
- Die Alkylierung ist eine weitere in der Industrie übliche Reaktion. Es besteht in der Zugabe von gesättigten Kohlenwasserstoffen zu ungesättigten unter dem Einfluss niedriger Temperaturen und Katalysatoren, um die Atommasse der Verbindungen zu erhöhen. Starke Mineralsäuren sind meist der Katalysator. Diese Reaktion kann auch durch einen Radikalmechanismus ablaufen.
- Die Alkenpolymerisation ist eine weitere Reaktion, die für gesättigte Kohlenwasserstoffe nicht charakteristisch ist. Dabei werden zahlreiche Moleküle miteinander verbunden, um eine starke Verbindung herzustellen, die sich in ihren physikalischen Eigenschaften unterscheidet.
 n bei dieser Reaktion ist die Anzahl der Moleküle, die eine Bindung eingegangen sind. Voraussetzung für die Umsetzung ist eine saure Umgebung, erhöhte Temperatur und erhöhter Druck.
n bei dieser Reaktion ist die Anzahl der Moleküle, die eine Bindung eingegangen sind. Voraussetzung für die Umsetzung ist eine saure Umgebung, erhöhte Temperatur und erhöhter Druck.
Alkene sind auch durch andere elektrophile Additionsreaktionen gekennzeichnet, die haben keine so umfangreiche praktische Verbreitung erhalten.
Zum Beispiel die Reaktion der Zugabe von Alkoholen zu Ethern.
Oder die Zugabe von Säurechloriden unter Erhalt ungesättigter Ketone - die Kondakov-Reaktion.
Beachten Sie!Diese Reaktion ist nur in Gegenwart eines Zinkchloridkatalysators möglich.
Die nächste Hauptklasse von Reaktionen, die für Alkene charakteristisch sind, sind Radikaladditionsreaktionen. Diese Reaktionen sind nur möglich, wenn unter dem Einfluss hoher Temperaturen, Strahlung und anderer Einwirkungen freie Radikale gebildet werden. Die charakteristischste Radikaladditionsreaktion ist die Hydrierung unter Bildung gesättigter Kohlenwasserstoffe. Es tritt ausschließlich unter Temperatureinfluss und in Gegenwart eines Platinkatalysators auf.
Aufgrund des Vorhandenseins einer Doppelbindung sind Alkene für verschiedene sehr charakteristisch oxidationsreaktionen.
- Die Verbrennung ist eine klassische Oxidationsreaktion. Es läuft gut ohne Katalysatoren. Je nach Sauerstoffmenge sind unterschiedliche Endprodukte möglich: von Kohlendioxid zu Kohlenstoff.
- Oxidation mit Kaliumpermanganat in einem neutralen Medium. Die Produkte sind mehrwertige Alkohole und braunes Mangandioxid. Diese Reaktion wird für Alkene als qualitativ angesehen.
- Eine milde Oxidation kann auch mit Wasserstoffperoxid, Osmiumoxid 8 und anderen Oxidationsmitteln in einer neutralen Umgebung durchgeführt werden. Für die milde Oxidation von Alkenen ist nur ein Bindungsbruch charakteristisch, das Reaktionsprodukt sind in der Regel mehrwertige Alkohole.
- Es ist auch eine starke Oxidation möglich, bei der beide Bindungen brechen und Säuren oder Ketone gebildet werden. Voraussetzung ist eine saure Umgebung, die am häufigsten verwendet wird schwefelsäureda auch andere Säuren oxidieren können, um Nebenprodukte zu bilden.
Physikalische Eigenschaften von Alkenen
 Die einzigen Gase unter normalen Bedingungen sind Ethylen, Propen und Buten.
Die einzigen Gase unter normalen Bedingungen sind Ethylen, Propen und Buten.
Von Penten bis Heptodecen sind alle Alkene in flüssigem Zustand.
Und alles andere sind Feststoffe.
Die Schmelz- und Siedepunkte steigen proportional mit zunehmendem Molekulargewicht an, können jedoch für Isomere variieren.
Alle Alkene Nicht in Wasser auflösen, lösen sich aber gut in inerten organischen Lösungsmitteln.
Anwendung von Alkenen
Alkene sind in der Industrie weit verbreitet und werden zur Synthese einer Vielzahl von Substanzen verwendet. Beispielsweise wird Ethylen verwendet, um Polyvinylchlorid (PVC), Styrol, Ethylenglykol, Ethanol, Polyethylen, Kautschuke und viele andere Substanzen zu synthetisieren. Das größte Propylenvolumen wird zur Herstellung von Polypropylen verwendet.
Alkene - Struktur, Eigenschaften, Anwendung
Wir untersuchen Chemie - Eigenschaften von Alkenen, Anwendung in der Industrie
Ausgabe
Generell können wir mit Sicherheit sagen, dass Alkene aufgrund ihrer chemischen Eigenschaften in der Industrie sehr gefragt sind. Sie sind an der Herstellung einer Vielzahl von Kunststoffen, Kautschuken und vielen anderen Substanzen beteiligt.
Niedrigere Alkene (C 2 - C 5) werden im industriellen Maßstab aus Gasen erhalten, die bei der thermischen Verarbeitung von Öl und Ölprodukten entstehen. Alkene können auch unter Verwendung von Laborsynthesemethoden erhalten werden.
4.5.1. Dehydrohalogenierung
Wenn Halogenalkane mit Basen in wasserfreien Lösungsmitteln behandelt werden, beispielsweise einer alkoholischen Lösung von ätzendem Kalium, wird Halogenwasserstoff eliminiert.
4.5.2. Dehydration
Wenn Alkohole mit Schwefel- oder Phosphorsäure erhitzt werden, tritt eine intramolekulare Dehydratisierung auf ( - beseitigung).
Die vorherrschende Reaktionsrichtung ist wie bei der Dehydrohalogenierung die Bildung des stabilsten Alkens (Zaitsev-Regel).
Die Dehydratisierung von Alkoholen kann durchgeführt werden, indem Alkoholdämpfe bei 300 bis 350ºC über einen Katalysator (Aluminium- oder Thoriumoxide) geleitet werden.
4.5.3. Dehalogenierung von vicinalen Dihalogeniden
Durch die Einwirkung von Zink in Alkohol können halogenhaltige Dibromide an benachbarten Atomen (vicinal) in Alkene umgewandelt werden.

4.5.4. Hydrierung von Alkinen
Wenn Alkine in Gegenwart von Platin- oder Nickelkatalysatoren hydriert werden, deren Aktivität durch Zugabe einer kleinen Menge Bleiverbindungen (katalytisches Gift) verringert wird, entsteht ein Alken, das nicht weiter reduziert wird.
4.5.5. Reduzierende Kombination von Aldehyden und Ketonen
Bei Behandlung mit Lithiumaluminiumhydrid und Titan (III) -chlorid werden aus zwei Molekülen Aldehyd oder Keton in guten Ausbeuten di- oder tetrasubstituierte Alkene gebildet.

5. ALKINS
Alkine sind Kohlenwasserstoffe mit einer dreifachen Kohlenstoff-Kohlenstoff-Bindung –CC–.
Die allgemeine Formel für einfache Alkine lautet C n H 2n-2. Der einfachste Vertreter der Klasse der Alkine ist Acetylen H - CC - H, daher werden Alkine auch als acetylenische Kohlenwasserstoffe bezeichnet.
5.1. Acetylenstruktur
Die Kohlenstoffatome von Acetylen sind in sp-Hybridzustand. Lassen Sie uns die Orbitalkonfiguration eines solchen Atoms darstellen. Beim Hybridisieren 2s-orbitale und 2p-orbitale werden durch zwei Äquivalente gebildet sp-Hybridorbitale auf einer geraden Linie und zwei nicht hybridisierten r.-orbital.

Zahl: 5.1 Schemaformationsp -Hybridorbitale des Kohlenstoffatoms
Richtungen und Formen von Orbitalen sr.-hybridisiertes Kohlenstoffatom: Hybridisierte Orbitale sind äquivalent und maximal voneinander entfernt
Im Acetylenmolekül eine einfache Bindung ( - bindung) zwischen Kohlenstoffatomen wird durch Überlappung von zwei gebildet sp-hybridisierte Orbitale. Zwei senkrecht zueinander - bindungen entstehen, wenn zwei Paare nicht hybridisiert sind 2p-orbitale, - elektronenwolken bedecken das Skelett, so dass die Elektronenwolke eine nahezu zylindrische Symmetrie aufweist. Bindungen mit Wasserstoffatomen entstehen durch sp-Hybridorbitale des Kohlenstoffatoms und 1 s-orbitale des Wasserstoffatoms, das Acetylenmolekül ist linear.

Zahl: 5.2 Acetylenmolekül
a - seitliche Überlappung 2porbitale ergeben zwei -Verbindungen;
b - das Molekül ist linear, - Die Wolke hat eine zylindrische Form
Es gibt eine einfache Verbindung in Propina - kommunikation mit sp -MIT sp3 kürzer als die analoge Verbindung C. sp -MIT sp2 bei Alkenen liegt dies daran, dass sp-orbital näher am Kern als sp 2 - Orbital .
Die Dreifach-Kohlenstoff-Kohlenstoff-Bindung C C ist kürzer als die Doppelbindung, und die Gesamtenergie der Dreifachbindung entspricht ungefähr der Summe der Energien einer einfachen CC-Bindung (347 kJ / mol) und zweier - Bindungen (259 · 2 kJ / mol) (Tabelle 5.1).
Das einfachste organische Verbindungen sind gesättigte und ungesättigte Kohlenwasserstoffe. Dazu gehören Substanzen der Klasse der Alkane, Alkine, Alkene.
Ihre Formeln enthalten Wasserstoff- und Kohlenstoffatome in einer bestimmten Reihenfolge und Menge. Sie sind in der Natur verbreitet.
Bestimmung von Alkenen
Ihr anderer Name ist Olefine oder Ethylenkohlenwasserstoffe. So wurde diese Verbindungsklasse im 18. Jahrhundert genannt, als eine ölige Flüssigkeit - Ethylenchlorid - entdeckt wurde.
Alkene sind Substanzen, die aus Wasserstoff- und Kohlenstoffelementen bestehen. Sie werden als acyclische Kohlenwasserstoffe klassifiziert. In ihrem Molekül gibt es eine einfache (ungesättigte) Doppelbindung, die zwei Kohlenstoffatome miteinander verbindet.
Alkenformeln
Jede Verbindungsklasse hat ihre eigene chemische Bezeichnung. In ihnen Symbole von Elementen periodensystem Die Zusammensetzung und Bindungsstruktur jeder Substanz ist angegeben.

Die allgemeine Formel der Alkene wird wie folgt bezeichnet: C n H 2n, wobei die Zahl n größer oder gleich 2 ist. Bei der Entschlüsselung ist zu erkennen, dass es für jedes Kohlenstoffatom zwei Wasserstoffatome gibt.
Molekülformeln von Alkenen aus der homologen Reihe werden durch die folgenden Strukturen dargestellt: C 2 H 4, C 3 H 6, C 4 H 8, C 5 H 10, C 6 H 12, C 7 H 14, C 8 H 16, C 9 H 18, C 10 H 20. Es ist ersichtlich, dass jeder nachfolgende Kohlenwasserstoff einen weiteren Kohlenstoff und zwei weitere Wasserstoff enthält.
Es gibt eine grafische Bezeichnung des Ortes und der Reihenfolge chemische Komponenten zwischen Atomen in einem Molekül, was durch die Strukturformel von Alkenen gezeigt wird. Mit Hilfe von Valenzstrichen wird die Bindung von Kohlenstoffen mit Wasserstoff angegeben.
Die Strukturformel von Alkenen kann, wenn überhaupt, in erweiterter Form gezeigt werden chemische Elemente und Kommunikation. Der präzisere Ausdruck für Olefine zeigt nicht die Verbindung von Kohlenstoff und Wasserstoff unter Verwendung von Valenzstrichen.
Die Skelettformel bezeichnet die einfachste Struktur. Die gestrichelte Linie stellt die Basis des Moleküls dar, in der die Kohlenstoffatome durch ihre Spitzen und Enden dargestellt sind, und die Verknüpfungen zeigen Wasserstoff an.
Wie Olefinnamen gebildet werden
CH 3 -HC \u003d CH 2 + H 2 O → CH 3 -OHCH-CH 3.
Wenn Alkene Schwefelsäure ausgesetzt werden, tritt der Sulfonierungsprozess auf:
CH 3 -HC \u003d CH 2 + HO-OSO-OH → CH 3 -CH 3 CH-O-SO 2 -OH.
Die Reaktion findet unter Bildung von sauren Estern statt, beispielsweise Isopropylschwefelsäure.
Alkene neigen während ihrer Verbrennung unter Einwirkung von Sauerstoff zur Bildung von Wasser und Kohlendioxidgas zur Oxidation:
2CH 3 -HC \u003d CH 2 + 9O 2 → 6CO 2 + 6H 2 O.
Die Wechselwirkung von olefinischen Verbindungen und verdünntem Kaliumpermanganat in Form einer Lösung führt zur Bildung von Glykolen oder zweiatomigen Alkoholen. Diese Reaktion ist auch oxidativ unter Bildung von Ethylenglykol und Verfärbung der Lösung:
3H 2 C \u003d CH 2 + 4H 2 O + 2KMnO 4 → 3OHCH-CHOH + 2MnO 2 + 2KOH.
Alkenmoleküle können mit einem radikalischen oder kationisch-anionischen Mechanismus an der Polymerisation beteiligt sein. Im ersten Fall wird unter dem Einfluss von Peroxiden ein Polymer vom Polyethylentyp erhalten.
Nach dem zweiten Mechanismus wirken Säuren als kationische Katalysatoren, und metallorganische Substanzen sind unter Freisetzung eines stereoselektiven Polymers anionisch.
Was sind Alkane?
Sie werden auch Paraffine oder gesättigte acyclische Kohlenwasserstoffe genannt. Sie haben eine lineare oder verzweigte Struktur, die nur gesättigte einfache Bindungen enthält. Alle Vertreter dieser Klasse haben allgemeine Formel C n H 2n + 2.

Sie enthalten nur Kohlenstoff- und Wasserstoffatome. Die allgemeine Formel für Alkene leitet sich aus der Notation gesättigter Kohlenwasserstoffe ab.
Die Namen der Alkane und ihre Eigenschaften
Der einfachste Vertreter dieser Klasse ist Methan. Es folgen Substanzen wie Ethan, Propan und Butan. Ihr Name basiert auf der Wurzel einer griechischen Zahl, zu der das Suffix -an hinzugefügt wird. Alkannamen sind in der IUPAC-Nomenklatur aufgeführt.
Die allgemeine Formel von Alkenen, Alkinen und Alkanen umfasst nur zwei Arten von Atomen. Dazu gehören die Elemente Kohlenstoff und Wasserstoff. Die Anzahl der Kohlenstoffatome in allen drei Klassen ist gleich, der Unterschied wird nur in der Anzahl der Wasserstoffatome beobachtet, die abgespalten oder gebunden werden können. Aus ungesättigten Verbindungen erhalten. Vertreter von Paraffinen im Molekül enthalten 2 mehr Wasserstoffatome als Olefine, was durch die allgemeine Formel von Alkanen, Alkenen, bestätigt wird. Die Alkenstruktur wird aufgrund des Vorhandenseins einer Doppelbindung als ungesättigt angesehen.
Wenn wir die Anzahl der Atome auf Wasser- und Kohlenstoffbasis in al-ka-nah korrelieren, ist der Wert im Vergleich zu anderen Klassen von Ang-le-vo-do-ro-dov max-si-mal-ny .
Von Methan bis Butan (von C 1 bis C 4) liegen Substanzen in gasförmiger Form vor.
In flüssiger Form werden Kohlenwasserstoffe im homologen Bereich von C 5 bis C 16 vorgestellt. Ausgehend von einem Alkan mit 17 Kohlenstoffatomen in der Hauptkette findet ein Übergang des physikalischen Zustands in eine feste Form statt.
Sie zeichnen sich durch Isomerie in aus kohlenstoffgerüst und optische Modifikationen des Moleküls.

In Paraffinen wird angenommen, dass Kohlenstoffvalenzen vollständig von benachbarten Winkeln oder Wasser-zu-Stäben besetzt sind, wobei eine Bindung vom σ-Typ gebildet wird. Aus Chi-Ch-Ch-Sicht bestimmt dies ihre schwachen Eigenschaften, weshalb Alkane als Pre-del-n-x- oder n-Sy-Schen-n-x-ug-le-vo-do-ro-Tauben ohne Affinität bezeichnet werden .
Sie gehen Substitutionsreaktionen ein, die mit radikalischer Halogenierung, Sulfochlorierung oder Nitrierung des Moleküls verbunden sind.
Paraffine werden bei hohen Temperaturen oxidiert, verbrannt oder zersetzt. Unter der Wirkung von Reaktionsbeschleunigern werden Wasserstoffatome eliminiert oder Alkane dehydriert.
Was sind Alkine?
Sie werden auch als acetylenische Kohlenwasserstoffe bezeichnet, die eine Dreifachbindung in der Kohlenstoffkette aufweisen. Die Struktur von Alkinen wird durch die allgemeine Formel C n H 2 n-2 beschrieben. Daraus ist ersichtlich, dass acetylenischen Kohlenwasserstoffen im Gegensatz zu Alkanen vier Wasserstoffatome fehlen. Sie werden durch eine Dreifachbindung ersetzt, die aus zwei π-Verbindungen besteht.
Diese Struktur bestimmt die chemischen Eigenschaften dieser Klasse. Die Strukturformel von Alkenen und Alkinen zeigt deutlich die Ungesättigtheit ihrer Moleküle sowie das Vorhandensein von Doppel- (H 2 C꞊CH 2) und Dreifachbindungen (HC≡CH).
Der Name der Alkine und ihre Eigenschaften
Das einfachste Beispiel ist Acetylen oder HC≡CH. Es wird auch Ethin genannt. Es kommt vom Namen eines gesättigten Kohlenwasserstoffs, in dem das Suffix -an entfernt und -in hinzugefügt wird. In den Namen langer Alkine gibt die Zahl den Ort der Dreifachbindung an.
Wenn man die Struktur von gesättigten und ungesättigten Kohlenwasserstoffen kennt, kann man bestimmen, unter welchem \u200b\u200bBuchstaben die allgemeine Formel von Alkinen angegeben ist: a) CnH2n; c) CnH2n + 2; c) CnH2n-2; d) CnH2n-6. Die dritte Option ist die richtige Antwort.
Beginnend mit Acetylen und endend mit Butan (von C 2 bis C 4) sind die Substanzen gasförmig.

Kohlenwasserstoffe im homologen Bereich von C 5 bis C 17 liegen in flüssiger Form vor. Ausgehend von Alkin, das 18 Kohlenstoffatome in der Hauptkette aufweist, erfolgt ein Übergang des physikalischen Zustands in eine feste Form.
Sie sind gekennzeichnet durch Isomerie im Kohlenstoffgerüst, in der Position der Dreifachbindung sowie durch Modifikationen des Moleküls zwischen den Klassen.
Durch chemische Eigenschaften Acetylenkohlenwasserstoffe ähneln Alkenen.
Wenn Alkin eine terminale Dreifachbindung aufweist, wirken sie als Säure unter Bildung von Alkinidsalzen, beispielsweise NaC≡CNa. Das Vorhandensein von zwei π-Bindungen macht das Natriumacetyledinmolekül zu einem starken Nucleophil, das Substitutionsreaktionen eingeht.
Acetylen wird in Gegenwart von Kupferchlorid zu Dichloracetylen chloriert, wobei unter Einwirkung von Halogenalkinen unter Freisetzung von Diacetylenmolekülen kondensiert wird.
Alkine sind an Reaktionen beteiligt, deren Prinzip die Grundlage für Halogenierung, Hydrohalogenierung, Hydratisierung und Carbonylierung ist. Solche Prozesse sind jedoch schwächer als die von Alkenen mit einer Doppelbindung.
Für acetylenische Kohlenwasserstoffe sind nukleophile Additionsreaktionen von Alkohol-, primären Amin- oder Schwefelwasserstoffmolekülen möglich.
4.3.b. Zugabe von Halogenwasserstoffen (Hydrohalogenierung)
Eine weitere wichtige Reaktion der elektrophilen Addition an Alkene ist die bekannte Hadrohalogenierung von Alkenen.
Nachfolgend sind typische Beispiele für die Zugabe von HCl, HBr und HI zu verschiedenen Alkenen aufgeführt.


Die Wirkung von Alkylsubstituenten auf die Doppelbindung auf die Bindungsrate wird durch die folgende Sequenz beschrieben:
R 2 C \u003d CHR\u003e RCH \u003d CHR\u003e RCH \u003d CH 2
Dies steht im Einklang mit einem Mechanismus, bei dem in der geschwindigkeitsbestimmenden Phase der Reaktion ein Carbokation gebildet wird, da die Stabilität von Alkylkationen in der tertiären\u003e sekundären\u003e primären Ordnung abnimmt. Daher muss der Additionsmechanismus die Zwischenbildung entweder eines freien Carbokations, das selten beobachtet wird, oder eines Zwischenprodukts mit Carbokationscharakter umfassen. Der letztere Fall ist der typischste.
Wenn die Addition über die "freie Carbokation" erfolgen würde, wäre die Reaktion vollständig nicht stereoselektiv, da Alkylkationen eine planare Struktur aufweisen. Die Hydrohalogenierung verläuft jedoch in der Regel stereoselektiv und je nach Alkentyp selektiv anti-Verbindung, selektiv syn- oder gemischt syn-anti-verbinden.
Für Alkene, bei denen die Doppelbindung nicht an den aromatischen Ring konjugiert ist, ist dies charakteristisch anti-Zusatz von Halogenwasserstoff. Anti-Zusatz von Chlorwasserstoff und Bromid, Deuteriumchlorid und Bromid wird für Cyclohexen, Cyclopenten, 1,2-Dimethylhexen, 1,2-Dimethylpenten beobachtet, cis- und trance-Buten-2, Hexen-3 und viele andere einfache Alkene und Cycloalkene.

Im Additionsprodukt befinden sich die gleichen Substituenten (Methylgruppen) auf verschiedenen Seiten der Mittelebene des Cyclohexanrings, daher gehört es dazu trance- neben. Anti-addition ist kaum kompatibel mit dem Mechanismus, bei dem die Bildung einer diskreten Carbokation angenommen wird. Für eine planare Carbokation ist der nukleophile Angriff des Halogenidions auf beiden Seiten der Ebene gleich wahrscheinlich, was zur Bildung eines Produktgemisches führen sollte syn- und anti-Verbindung. Die Kinetik der Alkenhydrohalogenierung weist auch auf einen komplexeren Additionsmechanismus hin. Für nicht konjugierte Alkene wird die Reaktionsgeschwindigkeit durch eine Gleichung dritter Ordnung mit Halogenwasserstoff zweiter Ordnung beschrieben, d. H. Sie entspricht dem Ad E 3 -Mechanismus.
v \u003d k [Alken] 2
Die Antiaddition und die zweite Ordnung der Reaktion in Bezug auf Halogenwasserstoff stimmen gut mit dem Ad E 3 -Mechanismus überein, bei dem ein Alken mit zwei Molekülen Halogenwasserstoff interagiert, von denen eines als elektrophiles Mittel und das andere wirkt als nukleophiles Mittel.

Dieser trimolekulare Mechanismus nimmt an, dass zunächst ein Komplex aus einem Alken und einem Molekül Halogenwasserstoff gebildet wird, gefolgt von einem Angriff des zweiten HX-Moleküls auf diesen Komplex mit anti-Seiten ohne die Bildung einer diskreten Carbokation. Es sollte besonders beachtet werden, dass jeder trimolekulare Mechanismus aus zwei aufeinanderfolgenden Stufen bestehen sollte, da die Kollision von drei Molekülen gleichzeitig äußerst unwahrscheinlich ist.

Antiaddition zeigt einen bevorzugten nukleophilen Angriff von Halogenwasserstoff von der Seite an, die der Seite entgegengesetzt ist, von der das Alken protoniert wird. Anstelle von Halogenwasserstoff kann die Funktion des nukleophilen Mittels in der Endstufe auch von einem Halogenidion wahrgenommen werden. Tatsächlich steigt die Reaktionsgeschwindigkeit gewöhnlich direkt proportional zur Konzentration des in das Reaktionsgemisch eingebrachten Halogenidions in Form von Tetraalkylammoniumhalogeniden NR 4+ X an - oder Lithium LiX. In diesem Fall gibt es eine stereospezifische anti-verbinden.
Für Alkane, bei denen eine Doppelbindung an einen aromatischen Ring konjugiert ist, ist dies charakteristisch syn-verbinden oder gemischt syn-anti-Zusatz von Halogenwasserstoff, zum Beispiel:

Syn-Anhaftung ist der dominierende Prozess für cis- und trance-Isomere von 1-Phenylpropen, 1-Phenyl-4-alkylcyclohexenen, Acenaphthylen, Inden. Wenn solche Alkene protoniert werden, werden Carbokationen vom Benzyltyp gebildet, die stabiler sind als reine Alkylkationen, die aus der Protonierung herkömmlicher Alkene und Cycloalkene entstehen. Die Kinetik der Reaktion wird in diesem Fall üblicherweise durch eine einfachere Gleichung zweiter Ordnung v \u003d k [Alken] beschrieben, dh sie entspricht dem bimolekularen Ad E 2 -Mechanismus. Ad E 2 - Der Mechanismus beinhaltet die Bildung eines Ionenpaars, einschließlich eines Carbokations und eines Halogenidions.

Es ist nicht zu erwarten, dass der Additionsmechanismus mit Ionenpaaren hoch stereoselektiv ist. Wenn sich das Ionenpaar schneller in das Endprodukt umwandelt, als es sich um eine einfache Kohlenstoff-Kohlenstoff-Bindung dreht, ist das Endergebnis syn-Addition, bei der ein Proton und ein Halogenidion an dieselbe Seite der Doppelbindung gebunden sind. Ansonsten wird die Bildung von Produkten als beobachtet syn- so und anti-Anschluss HX. Dies ist bei der Hydrohalogenierung der Fall paar-substituierte Styrole Z-C 6 H 4 -CH \u003d CH 2. Das hier beobachtete Muster ist das syn-Addition ist nur für solche Olefine typisch, die bei Protonierung eine relativ stabile Carbokation ergeben, d. h. im Fall von Donorsubstituenten Z.
Für Hydrohalogenierungsreaktionen, die nach dem Ad E 2 -Mechanismus ablaufen, ist die Konkurrenz zwischen den Prozessen der konjugierten Addition und Umlagerung charakteristisch, da ein Carbokation oder Ionenpaar als Zwischenprodukt gebildet wird.

Als Beispiel für Umlagerungen mit 1,2-Migration der Alkylgruppe und des Hydridions präsentieren wir die Hydrohalogenierungsreaktionen von tert-Butylethylen bzw. Isopropylethylen.

Bei Durchführung der gleichen Reaktion ohne Lösungsmittel in der Kälte (-78 ° C) entsteht eine Mischung aus 33% normalen und 67% abnormalen (umgelagerten) Additionsprodukten.

4.3.c. Orientierung. Markovnikovs Regel
Im Gegensatz zu symmetrischen Elektrophilen (Hal 2) sind Halogenwasserstoffe asymmetrische elektrophile Reagenzien. Die Zugabe eines unsymmetrischen Elektrophils (HBr, ICl, H 2 O, Hg (OAc) 2 usw.) zu einem unsymmetrischen Alken könnte im Prinzip eine Mischung aus zwei alternativen Produkten ergeben, in der Praxis wird jedoch normalerweise nur eines davon gebildet. Betrachten Sie als Beispiel die Zugabe von Bromwasserstoff zu Propylen.

Bereits 1870 war V.V. Markovnikov formulierte eine Faustregel, nach der asymmetrische Alkene so an HX gebunden sind, dass überwiegend ein Produkt gebildet wird, bei dem Wasserstoff an das am wenigsten substituierte Ende und X an das am meisten substituierte Ende der Doppelbindung gebunden ist.
Normalerweise erklärt sich Markovnikovs Regel durch den Unterschied in der Stabilität zweier alternativer Carbokationen. Zum Beispiel im obigen Beispiel die normale n-Propylkation ist viel weniger stabil als Isopropylkation, und daher verläuft die Reaktion auf dem zweiten Weg.
Die Markovnikov-Regel wurde ursprünglich nur für die Fälle der Zugabe von HX zu Kohlenwasserstoffsubstraten verwendet, kann jedoch im Prinzip auf die Reaktionen anderer substituierter Alkene ausgedehnt werden. Die Zugabe von HCl zu CF 3 CH \u003d CH 2 ergibt also anti- Markovnikian "-Produkt CF 3 CH 2 CH 2 Cl. Dies ist zu erwarten, da das Kation CF 3 CH + CH 3 aufgrund des starken (-I) -Effekts weniger stabil ist als das Kation CF 3 CH 2 CH 2+ der CF 3 -Gruppe Das Kation CF 3 CH 2 CH 2+ wird überwiegend gebildet, es wird jedoch auch, wenn auch in geringerem Maße, durch die induktive Wirkung der CF 3 -Gruppe destabilisiert, wodurch die Zugabe von HCl erfolgt zu Trifluormethylethylen ist viel langsamer als die Zugabe zu unsubstituiertem Ethylen.
Aus einem ähnlichen Grund fügen Vinyltrialkylammoniumkationen HBr auch gegen Markovnikovs Regel hinzu:
Die Zugabe von HX zu Alkenen mit starken (-I) und (-M) -Substituenten, beispielsweise zu Acrylnitril oder Nitroethylen, sollte ebenfalls gegen die Markovnikov-Regel verstoßen. In diesem Fall ist die Doppelbindung jedoch gegenüber elektrophilen Reagenzien so stark deaktiviert, dass diese Reaktionen nur unter sehr rauen Bedingungen ablaufen. Vinylchlorid CH 2 \u003d CHCl ergibt immer ausschließlich "Markovnikov-Addukte". Wenn es beispielsweise mit HCl reagiert, wird nur 1,1-Dichlorethan (geminales Dichlorid) CH 3 CHCl 2 gebildet. Chlor hat ähnlich wie die CF 3 -Gruppe einen starken (-I) -Effekt, und auf den ersten Blick scheint es, dass die Addition aus diesem Grund eine anti-markovsche Orientierung haben sollte, da das + CH 2 CH 2 Cl-Kation sollte stabiler sein als das Kation CH 3 CH + Cl. Im Gegensatz zur CF 3 -Gruppe hat Chlor jedoch neben dem (-I) -Effekt auch einen entgegengesetzten (+ M) -Effekt (da es einzelne Paare aufweist). Die Erfahrung zeigt, dass das Ausmaß des mesomeren Effekts völlig ausreicht, um die Energie des 1-Chlorethylkations unter das Energieniveau des 2-Chlorethylkations zu senken, bei dem sich der + M-Effekt nicht manifestiert.
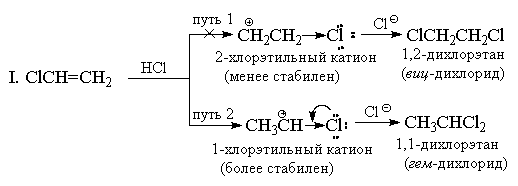
II. Vom Standpunkt der Resonanztheorie aus kann die Struktur des 1-Chlorethylkations wie folgt dargestellt werden:
Trotzdem erfolgt die Addition an Vinylchlorid unter den gleichen Bedingungen langsamer als an Ethylen, dh gemäß dem Gesamteffekt (-I\u003e + M) bleibt Chlor im Vergleich zu Wasserstoff und dem 1-Chlorethylkation ein elektronenziehender Substituent ist weniger stabil als C 2 H 5 +. Andere Vinylhalogenide reagieren ähnlich mit HX.
Vinylether CH 2 \u003d CHOR addieren HX (X \u003d Hal) gemäß Markovnikovs Regel viel schneller als alle oben aufgeführten substituierten Alkene. Dies ist auf den signifikanten + M-Effekt der RO-Gruppe zurückzuführen. Im Gegensatz zum Chloratom ist die RО-Gruppe durch den gesamten elektronischen Effekt (+ M\u003e -I) ein starker Elektronendonorsubstituent, der das benachbarte Carbokationszentrum wirksam stabilisiert. Die Struktur der Carbokation kann in diesem Fall auch als Satz von zwei Resonanzstrukturen dargestellt werden
Der Angriff des Oxoniumkations mit einem Halogenidanion führt zur Bildung von α-Halogenester vom Typ CH 3 CH (Hal) OR.
4.3.y. Alkenhydratation
Die säurekatalysierte Hydratisierung von Alkenen führt zur Bildung von Alkoholen. Die Richtung der Hydratation von Alkenen wird durch die Markovnikov-Regel bestimmt, daher wird angenommen, dass bei dieser Reaktion ein Carbokation als Zwischenpartikel gebildet wird.
Die Umlagerungstendenz von sekundären Alkylcarbokationen verhindert, dass die Hydratisierung von Alkenen zur Herstellung von sekundären Alkoholen verwendet wird.

Diese Methode im Labor hat ein begrenztes Anwendungsgebiet nur für die Herstellung von tertiären Alkoholen gefunden. Die Hydratationsreaktion ist in diesem Fall weitgehend reversibel und tertiäre Alkohole werden in geringen Ausbeuten (40-45%) gebildet.


Die Hydratisierung der einfachsten Alkene Ethylen und Propylen ist ein wichtiges industrielles Verfahren zur Herstellung von Ethyl- und Isopropylalkoholen.

In der Laborpraxis hat die direkte Hydratisierung von Alkenen sowohl aufgrund rauer Bedingungen als auch aufgrund der Bildung einer signifikanten Menge isomerer Alkohole keine breite Anwendung gefunden. Gegenwärtig wird für die regioselektive Herstellung von Alkoholen aus Alkenen üblicherweise eine verwandte Reaktion der Hydroxyquecksilberung, Demercuration, verwendet.
4.3.d. Hydroxymercurization-Demercurization
Ein elektrophiler Angriff auf eine Alken-Doppelbindung kann durch Metallionen ausgeführt werden, unter denen das Quecksilber (II) -Kation eine Sonderstellung einnimmt. Quecksilberacetat wird unter sehr milden Bedingungen bei 20 ° C zu Alkenen in wässrigem Tetrahydrofuran (THF) oder wässriger Essigsäure gegeben, um Organomercury-Verbindungen zu bilden. Die Zugabe von Quecksilberacetat an der Doppelbindung erfolgt regiospezifisch in strikter Übereinstimmung mit der Markovnikov-Regel, d. H. Das Quecksilberkation ist an das am wenigsten substituierte Kohlenstoffatom gebunden.
Die C-Hg-Bindung in Organomercury-Verbindungen kann leicht durch Einwirkung von Natriumborhydrid NaBH 4 unter Bildung von Quecksilber und neuem gespalten werden kommunikation C-H... Es wird angenommen, dass ein Alkylquecksilberhydrid als instabiles Zwischenprodukt erhalten wird, das sich unter Freisetzung eines metallischen Quecksilbers durch einen Radikalmechanismus weiter zersetzt.

Insgesamt stellt dieser zweistufige Hydroxyquecksilber-Demercurations-Prozess letztendlich eine regiospezifische Hydratisierung eines Alkens gemäß Markovnikovs Regel unter extrem milden Bedingungen dar, wenn die Bildung von Nebenprodukten auf das maximal mögliche Minimum reduziert wird. Dies kann durch die folgenden Beispiele deutlich veranschaulicht werden, in denen die Gesamtausbeute der Reaktionsprodukte 90-98% beträgt. Die angegebenen digitalen Daten bedeuten in diesem Fall nicht die Ausbeuten der resultierenden Verbindungen, sondern deren Verhältnis in der Mischung.




Wie aus den obigen Beispielen ersichtlich ist, liefert die Hydroxyquecksilber-Demercuration von Alkenen in den meisten Fällen eine regiospezifische Hydratisierung von Alkenen unter Bildung von praktisch nur einem der beiden isomeren Alkohole. Es ist zu beachten, dass die Organomercury-Verbindung nicht abgetrennt werden muss und beide Prozesse direkt nacheinander durchgeführt werden können.
Die Hydroxymercurisierung unsymmetrischer Alkene beginnt offenbar mit dem Angriff des AcOHg + -Kations und der Bildung eines unsymmetrischen cyclischen Mercuriniumkations als Zwischenprodukt (ein Analogon eines asymmetrischen Halogenoniumions), das sich dann infolge eines nukleophilen Angriffs durch Wasser öffnet am am meisten substituierten Kohlenstoffatom, das eine höhere positive Ladung trägt.

Das verbrückende Quecksilberion kann in einem nicht nukleophilen, stark sauren Medium auch bei 20 ° C unter Zusatz eines stärkeren elektrophilen Mittels - Quecksilbertrifluoracetat - in einer Mischung aus Fluorsulfonsäure und Antimonpentafluorid fixiert werden.

Das Mercuriniumkation kann nicht nur durch Einwirkung von Wasser, sondern auch durch andere Elektronendonorlösungsmittel gespalten werden: Alkohole, essigsäure, Acetonitril usw. Das Endprodukt der Reaktion sind in diesem Fall Ether, Acetate oder N-substituierte Amide der Essigsäure, zum Beispiel:


Wenn verzweigte sekundäre oder tertiäre Alkohole in der Alkoxymercuration-Demercuration-Reaktion verwendet werden, sind Trifluoracetat Hg (OCOCF 3) 2 oder Quecksilbertriflat Hg (OSO 2 CF 3) 2 wirksamer als Quecksilberacetat.

Somit ist die Hydroxy- und Alkoxymercuration-Demercuration eine der besten präparativen Methoden zur Synthese von Alkoholen und Ethern mit verzweigten Alkylradikalen.
Die Zugabe von Quecksilbersalzen zu Alkenen ist das auffälligste Beispiel für eine konjugierte Addition an eine Doppelbindung, bei der ein Lösungsmittel als externes nukleophiles Mittel wirkt. Die Stereochemie des Doppelhydroxyquecksilber-Demercurationsprozesses hängt von der Stereochemie jedes einzelnen Schritts ab. Die Hydroxymercurisation ist gekennzeichnet durch anti-Zusatz wie bei anderen Reaktionen mit einem cyclischen Kation. Eine radikale Demercuration ist jedoch nicht sehr stereoselektiv. Daher ist der gesamte Prozess insgesamt auch nicht stereospezifisch.
4.3.e. Zugabe von Alkenen (kationische Dimerisierung und Polymerisation von Alkenen)
Die meisten interessantes Beispiel Diese Art der Reaktion ist die Dimerisierung und Polymerisation von Isobutylen in Gegenwart von Schwefelsäure.

Der technische Name für diese Mischung von Alkenen lautet "Diisobutylen". Diese Reaktion verläuft nach einem kationischen Mechanismus, ähnlich dem Mechanismus der Addition von Mineralsäuren an die Doppelbindung von Alkenen. In der ersten Stufe wird dem Isobutylenmolekül ein Proton zugesetzt, um ein relativ stabiles zu bilden reibt-Butylkation. Weiter gebildet reibtDas β-Butylkation (Lewis-Säure) reagiert mit einem Isobutylenmolekül (Lewis-Base) unter Bildung eines neuen stabilen tertiären Octylkations.

Unter diesen Bedingungen verliert die Octylcarbokation unter Einwirkung von Basen (H 2 O, HSO 4 - -Ionen) schnell ein Proton und verwandelt sich in eine Mischung isomerer Pentene, da die Ablösung eines Protons aus zwei verschiedenen Positionen erfolgt:

Die vorherrschende Bildung eines thermodynamisch weniger stabilen Alkens - 2,4,4-Trimethylpenten-1 (80% im Reaktionsgemisch) ist mit der größeren räumlichen Zugänglichkeit von Methylgruppen für den Angriff durch die Base im Vergleich zu den Wasserstoffatomen der Methylengruppe. In der Industrie wird "Diisobutylen" an Ni-Raney hydriert und "Isooctan" (der technische Name für den 2,2,4-Trimethylpentan-Kohlenwasserstoff) erhalten, der als Kraftstoff mit hoher Oktanzahl für Verbrennungsmotoren verwendet wird.
Wann hohe Konzentrationen Die kationische Polymerisation von Isobutylen mit Schwefelsäure (mehr als 80%) erfolgt unter Bildung eines Polymers namens Polyisobutylen (-CH 2 C (CH 3) 2 -) n. Dieses gummiartige Polymer wird verwendet, um Korrosionsschutz- und Abdichtungsbeschichtungen, Dichtungsmittel usw. zu erhalten.
Zusätzlich zu Isobutylen werden 3-Methylbuten-1, Vinylether und einige Styrolderivate, die relativ stabile Carbokationen bilden können, durch den kationischen Mechanismus polymerisiert. Fluorwasserstoff und Lewis-Säuren werden auch als Katalysatoren für die kationische Polymerisation verwendet: BF 3, AlCl 3, AlBr 3 usw. in Gegenwart sehr kleiner Mengen Wasser.
4.3.j. Zugabe von Alkanen (Alkylierung von Alkenen)
Ein anderes industrielles Verfahren zur Synthese von "Isooctan" basiert auf der Wechselwirkung von Isobutylen mit einem Überschuss an Isobutan in Gegenwart von konzentrierter Schwefelsäure oder in wasserfreiem Fluorwasserstoff bei 0 10 0 C.

Diese Reaktion verläuft ebenfalls über einen kationischen Mechanismus und ist, was besonders interessant ist, ein Beispiel für einen kationischen Kettenprozess. Zunächst dimerisiert Isobutylen unter den Reaktionsbedingungen unter Bildung des tertiären Octylkations (CH 3) 3 CCH 2 C + (CH 3) 2. Der Mechanismus seiner Bildung ist im vorherigen Abschnitt ausführlich beschrieben. Ferner findet ein schneller Transfer von Wasserstoff (in Form eines Hydridions) von Isobutan zu einem Octylkation unter Bildung eines Moleküls "Isooctan" und eines neuen tert-Butylkations statt, das wiederum schnell mit Isobutylen reagiert bilden ein neues Octylkation usw.

Neben der Synthese von Isooctan wird dieses Alkylierungsverfahren in der petrochemischen Industrie zur Synthese von hochsiedenden verzweigten Kohlenwasserstoffen aus verzweigten Alkenen und niedrigsiedenden Alkanen durch thermische Crackfraktion eingesetzt.
Alkene sind ungesättigte aliphatische Kohlenwasserstoffe mit einer oder mehreren Kohlenstoff-Kohlenstoff-Doppelbindungen. Eine Doppelbindung wandelt zwei Kohlenstoffatome in eine planare Struktur mit Bindungswinkeln zwischen benachbarten Bindungen bei 120 ° C um:
Die homologe Reihe von Alkenen hat eine allgemeine Formel: Die ersten beiden Elemente sind Ethen (Ethylen) und Propen (Propylen):

Mitglieder der Reihe von Alkenen mit vier oder mehr Kohlenstoffatomen weisen eine Bindungspositionsisomerie auf. Zum Beispiel hat ein Alken der Formel drei Isomere, von denen zwei Bindungspositionsisomere sind:
Beachten Sie, dass die Nummerierung der Alkenkette von diesem Ende aus erfolgt, das näher an der Doppelbindung liegt. Die Position der Doppelbindung wird durch die niedrigere der beiden Zahlen angegeben, die den beiden durch eine Doppelbindung gebundenen Kohlenstoffatomen entsprechen. Das dritte Isomer hat eine verzweigte Struktur:

Die Anzahl der Isomere eines Alkens nimmt mit der Anzahl der Kohlenstoffatome zu. Beispielsweise hat Hexen drei Bindungspositionsisomere:
diene sind Buta-1,3-dien oder nur Butadien:
Verbindungen mit drei Doppelbindungen werden Triene genannt. Verbindungen mit mehreren Doppelbindungen haben gemeinsamen Namen Polyene.
Physikalische Eigenschaften
Alkene haben etwas niedrigere Schmelz- und Siedepunkte als ihre entsprechenden Alkane. Zum Beispiel hat Pentan einen Siedepunkt. Ethylen-, Propen- und drei Butenisomere sind bei Raumtemperatur und Normaldruck gasförmig. Alkene mit einer Anzahl von Kohlenstoffatomen von 5 bis 15 sind unter normalen Bedingungen in flüssigem Zustand. Ihre Flüchtigkeit nimmt wie die von Alkanen mit der Verzweigung in der Kohlenstoffkette zu. Alkene mit mehr als 15 Kohlenstoffatomen sind unter normalen Bedingungen Feststoffe.
Beschaffung unter Laborbedingungen
Die beiden Hauptmethoden zur Herstellung von Alkenen im Labor sind die Dehydratisierung von Alkoholen und die Dehydrohalogenierung von Halogenalkanen. Zum Beispiel kann Ethylen durch Dehydratisierung von Ethanol durch Einwirkung eines Überschusses an konzentrierter Schwefelsäure bei einer Temperatur von 170 ° C erhalten werden (siehe Abschnitt 19.2):
Ethylen kann auch aus Ethanol erhalten werden, indem Ethanoldampf über die Oberfläche von erhitztem Aluminiumoxid geleitet wird. Zu diesem Zweck können Sie die in Abb. 1 schematisch dargestellte Installation verwenden. 18.3.
Das zweite weit verbreitete Verfahren zur Gewinnung von Alkenen basiert auf der Dehydrohalogenierung von Halogenalkanen unter basischen Katalysebedingungen
Der Mechanismus dieser Art von Eliminierungsreaktion ist in Kap. 17.3.
Alkenreaktionen
Alkene haben viel höher reaktivitätals Alkane. Dies ist auf die Fähigkeit von Doppelbindungselektronen zurückzuführen, Elektrophile anzuziehen (siehe Abschnitt 17.3). Daher sind die charakteristischen Reaktionen von Alkenen hauptsächlich Reaktionen der elektrophilen Addition an eine Doppelbindung:

Viele dieser Reaktionen haben ionische Mechanismen (siehe Abschnitt 17.3).
Hydrierung
Wenn irgendein Alken, beispielsweise Ethylen, mit Wasserstoff gemischt wird und diese Mischung bei Raumtemperatur über die Oberfläche eines Platinkatalysators oder eines Nickelkatalysators bei einer Temperatur von etwa 150ºC geleitet wird, erfolgt die Zugabe
wasserstoff an der Doppelbindung von Alken. Dies bildet das entsprechende Alkan:

Diese Art der Reaktion ist ein Beispiel für eine heterogene Katalyse. Sein Mechanismus ist in Kap. 9.2 und schematisch in Abb. 9.20.
Anlagerung von Halogenen
Chlor oder Brom werden leicht an die Alken-Doppelbindung gebunden; Diese Reaktion findet in unpolaren Lösungsmitteln wie Tetrachlormethan oder Hexan statt. Die Reaktion verläuft über einen Ionenmechanismus, der die Bildung eines Carbokations einschließt. Die Doppelbindung polarisiert das Halogenmolekül und verwandelt es in einen Dipol:

Daher verfärbt sich eine Lösung von Brom in Hexan oder Tetrachlormethan beim Schütteln mit einem Alken. Das gleiche passiert, wenn das Alken mit Bromwasser geschüttelt wird. Bromwasser ist eine Lösung von Brom in Wasser. Diese Lösung enthält hypobrome Säure. Das hypobrome Säuremolekül bindet an die Doppelbindung des Alkens und das Ergebnis ist ein Bromalkohol. beispielsweise

Verbindung von Halogenwasserstoffen
Der Reaktionsmechanismus dieses Typs ist in Kap. 18.3. Betrachten Sie als Beispiel die Zugabe von Chlorwasserstoff zu Propen:
Beachten Sie, dass das Produkt dieser Reaktion 2-Chlorpropan und nicht 1-Chlorpropan ist:
![]()
Bei solchen Additionsreaktionen ist immer das elektronegativste Atom oder die elektronegativste Gruppe an das Kohlenstoffatom gebunden, an das gebunden ist
die kleinste Anzahl von Wasserstoffatomen. Dieses Muster wird als Markovnikov-Regel bezeichnet.
Die bevorzugte Bindung eines elektronegativen Atoms oder einer elektronegativen Gruppe an das Kohlenstoffatom, das an die niedrigste Anzahl von Wasserstoffatomen gebunden ist, beruht auf einer Erhöhung der Stabilität der Carbokation, wenn die Anzahl der Alkylsubstituenten am Kohlenstoff zunimmt. Diese Erhöhung der Stabilität erklärt sich wiederum aus dem induktiven Effekt der Alkylgruppen, da sie Elektronendonoren sind:

In Gegenwart eines organischen Peroxids reagiert Propen mit Bromwasserstoff unter Bildung, dh nicht nach Markovnikovs Regel. Ein solches Produkt heißt Anti-Markovnikov. Es entsteht durch eine Radikalreaktion, nicht durch einen Ionenmechanismus.
Flüssigkeitszufuhr
Alkene reagieren mit kalter konzentrierter Schwefelsäure unter Bildung von Alkylhydrogensulfaten. beispielsweise

Diese Reaktion ist eine Addition, da sie die Addition einer Säure an einer Doppelbindung beinhaltet. Es ist die umgekehrte Reaktion auf die Dehydratisierung von Ethanol unter Bildung von Ethylen. Der Mechanismus dieser Reaktion ähnelt dem Mechanismus der Addition von Halogenwasserstoffen an die Doppelbindung. Es beinhaltet die Bildung eines intermediären Carbokations. Wenn das Produkt dieser Reaktion mit Wasser verdünnt und vorsichtig erhitzt wird, hydrolysiert es unter Bildung von Ethanol:
Die Reaktion der Zugabe von Schwefelsäure zu Alkenen folgt Markovnikovs Regel:

Reaktion mit angesäuerter Kaliumpermanganatlösung
Die violette Farbe der angesäuerten Kaliumpermanganatlösung verschwindet, wenn diese Lösung in einer Mischung mit einem beliebigen Alken geschüttelt wird. Das Alken wird hydroxyliert (die Einführung einer durch Oxidation gebildeten Hydroxylgruppe), die in ein Diol umgewandelt wird. Wenn beispielsweise eine überschüssige Menge Ethylen mit einer angesäuerten Lösung geschüttelt wird, wird Ethan-1,2-diol (Ethylenglykol) gebildet

Wenn das Alken mit einer überschüssigen Menge der β-Ionenlösung geschüttelt wird, oxidativer Abbau Alken, das zur Bildung von Aldehyden und Ketonen führt:
Die resultierenden Aldehyde werden weiter oxidiert, um Carbonsäuren zu bilden.
Die Hydroxylierung von Alkenen zu Diolen kann ebenfalls unter Verwendung von durchgeführt werden alkalische Lösung Kaliumpermanganat.
Reaktion mit Perbenzoesäure
Alkene reagieren mit Peroxysäuren (Persäuren) wie Perbenzoesäure unter Bildung von cyclischen Ethern (Epoxyverbindungen). beispielsweise

Wenn Epoxyethan vorsichtig mit einer verdünnten Lösung von etwas Säure erhitzt wird, entsteht Ethan-1,2-diol:

Reaktionen mit Sauerstoff
Wie alle anderen Kohlenwasserstoffe verbrennen Alkene und bilden bei reichlich vorhandenem Luftzugang Kohlendioxid und Wasser:
Bei eingeschränktem Luftzugang führt die Verbrennung von Alkenen zur Bildung von Kohlenmonoxid und Wasser:
Da Alkene einen höheren relativen Kohlenstoffgehalt als die entsprechenden Alkane haben, verbrennen sie unter Bildung einer rauchigeren Flamme. Dies ist auf die Bildung von Kohlenstoffpartikeln zurückzuführen:
Wenn Sie ein Alken mit Sauerstoff mischen und dieses Gemisch über die Oberfläche eines Silberkatalysators leiten, entsteht Epoxyethan bei einer Temperatur von etwa 200 ° C:
Ozonolyse
Wenn gasförmiges Ozon bei Temperaturen unter 20 ° C durch eine Lösung eines Alkens in Trichlormethan oder Tetrachlormethan geleitet wird, entsteht Ozonid des entsprechenden Alkens (Oxiran)

Ozonide sind instabile Verbindungen und können explosiv sein. Sie werden hydrolysiert, um Aldehyde oder Ketone zu bilden. beispielsweise

In diesem Fall reagiert ein Teil des Methanals (Formaldehyd) mit Wasserstoffperoxid unter Bildung von Methan (Ameisensäure):
Polymerisation
Die einfachsten Alkene können unter Bildung von Verbindungen mit hohem Molekulargewicht polymerisieren, die dieselbe empirische Formel wie das ursprüngliche Alken haben:
Diese Reaktion findet bei hohem Druck, einer Temperatur von 120 ° C und in Gegenwart von Sauerstoff statt, der als Katalysator wirkt. Die Ethylenpolymerisation kann jedoch bei niedrigeren Drücken unter Verwendung eines Ziegler-Katalysators durchgeführt werden. Einer der häufigsten Ziegler-Katalysatoren ist eine Mischung aus Triethylaluminium und Titantetrachlorid.
Die Polymerisation von Alkenen wird in Abschn. 18.3.








