Aromatiniai angliavandeniliai yra izomerijos tipai. Arenos
Fizinės savybės
Benzenas ir artimiausi jo homologai yra bespalviai skysčiai, turintys specifinį kvapą. Aromatiniai angliavandeniliai yra lengvesni už vandenį ir jame netirpsta, tačiau lengvai ištirpsta organiniuose tirpikliuose - alkoholyje, eteryje, acetone.
Benzenas ir jo homologai patys yra geri daugelio organinių medžiagų tirpikliai. Visose arenose dega dūminė liepsna dėl didelio anglies kiekio jų molekulėse.
Kai kurių arenų fizinės savybės pateikiamos lentelėje.
Lentelė. Kai kurių arenų fizinės savybės
|
vardas |
Formulė |
t °. pl., |
t °. virti, |
|
Benzenas |
C 6 H 6 |
5,5 |
80,1 |
|
Toluolas (metilbenzenas) |
C6H5CH3 |
95,0 |
110,6 |
|
Etilbenzenas |
C6H5C2H5 |
95,0 |
136,2 |
|
Ksilenas (dimetilbenzenas) |
C6H4 (CH3) 2 |
||
|
orto- |
25,18 |
144,41 |
|
|
meta- |
47,87 |
139,10 |
|
|
pora- |
13,26 |
138,35 |
|
|
Propilo benzenas |
C6H5 (CH2) 2CH3 |
99,0 |
159,20 |
|
Kumenas (izopropilbenzenas) |
C6H5CH (CH3) 2 |
96,0 |
152,39 |
|
Stirenas (vinilbenzenas) |
C6H5CH \u003d CH2 |
30,6 |
145,2 |
Benzenas - mažai verdantis ( t ryšulys\u003d 80,1 ° C), bespalvis skystis, netirpus vandenyje
Dėmesio! Benzenas - nuodai, veikia inkstus, keičia kraujo formulę (ilgai veikiant), gali sutrikdyti chromosomų struktūrą.
Dauguma aromatinių angliavandenilių kelia pavojų gyvybei ir yra toksiški.
Arenų (benzeno ir jo homologų) gavimas
Laboratorijoje
1. Benzenkarboksirūgšties druskų susiliejimas su kietais šarmais
C6H5-COONa + NaOH t →C6H6 + Na2C03
natrio benzoatas
2. Würzui tinkanti reakcija: (čia G yra halogenas)
C 6H 5 -G + 2Na + R-G →C 6 H 5 - R + 2 NaD
NUO 6 H5-Cl + 2Na + CH3-Cl → C6H5-CH3 + 2NaCl
Pramonėje
- izoliuotas nuo naftos ir anglies frakciniu distiliavimu, reformuojant;
- iš akmens anglių deguto ir kokso krosnies dujų
1. Alkanų dehidrociklinimas turintys daugiau nei 6 anglies atomus:
C 6 H 14 t , kat→ C6H6 + 4H2
2. Trimetinimas acetilenu (tik benzolui) - r. Zelinskis:
3C 2 H 2 600 ° C , Aktas. anglis → C6H6
3. Dehidrinimas cikloheksanas ir jo homologai:
Sovietų akademikas Nikolajus Dmitrijevičius Zelinsky nustatė, kad benzenas susidaro iš cikloheksano (dehidrinant cikloalkanus).
C 6 H 12 t, kat→ C6H6 + 3H2

C6H11-CH3 t , kat→ C6H5-CH3 + 3H2
metilcikloheksantholuenas
4. Benzeno alkilinimas (gauti benzeno homologus) - p Friedel-Crafts.
C6H6 + C2H5 -Cl t, AlCl3→ C6H5 -C2H5 + HCl
chloretanas etilbenzenas

Cheminės arenų savybės
Aš... OKSIDAVIMO REAKCIJOS
1. Degimas (dūminė liepsna):
2C6H6 + 15O2 t → 12CO 2 + 6H 2 O + Q
2. Normaliomis sąlygomis benzenas nekeičia bromo vandens ir vandeninio kalio permanganato tirpalo
3. Benzeno homologus oksiduoja kalio permanganatas (nuspalvina kalio permanganatą):
A) rūgščioje terpėje iki benzenkarboksirūgšties
Veikiant kalio permanganatui ir kitiems stipriems oksidatoriams benzeno homologams, šoninės grandinės oksiduojasi. Nesvarbu, kokia sudėtinga yra pakaitinė grandinė, ji yra sunaikinta, išskyrus a-anglies atomą, kuris yra oksiduojamas iki karboksilo grupės.
Benzeno homologai su viena šonine grandine duoda benzenkarboksirūgštį:
Homologai, turintys dvi šonines grandines, suteikia dviejų rūgščių rūgštis:
5C 6 H 5 -C 2 H 5 + 12KMnO 4 + 18H 2 SO 4 → 5C 6 H 5 COOH + 5CO 2 + 6K 2 SO 4 + 12MnSO 4 + 28H 2 O
5C6H5-CH3 + 6KMnO4 + 9H2SO4 → 5C6H5COOH + 3K2SO4 + 6MnSO4 + 14H2O
Supaprastinta :
C6H5-CH3 + 3O KMnO4→ C6H5COOH + H20
B) neutraliose ir šiek tiek šarminėse benzoinės rūgšties druskose
C6H5-CH3 + 2KMnO4 → C6H5COOК + K ОН + 2MnO 2 + H 2 O
II... PAPILDOMOS REAKCIJOS (sunkiau nei alkenai)
1. Halogeninimas
C6H6 + 3Cl2 h ν → C6H6Cl6 (heksachlorcikloheksanas - heksachloranas)
2. Hidrinimas
C6H6 + 3H2 t , Pt arba Ni → C6H12 (cikloheksanas)
3. Polimerizacija
III. PAKEITIMO REAKCIJOS - joninis mechanizmas (lengvesni už alkanus)
b) benzeno homologai švitinant ar kaitinant
Pagal chemines savybes alkilo radikalai yra panašūs į alkanus. Juose esančius vandenilio atomus laisvųjų radikalų mechanizmas pakeičia halogenu. Todėl, kaitinant ar švitinant UV spinduliais, nėra katalizatoriaus, šoninėje grandinėje vyksta radikalaus pakaitalo reakcija. Benzeno žiedo poveikis alkilo pakaitalams lemia tai, kad vandenilio atomas ties anglies atomu, tiesiogiai sujungtu su benzeno žiedu (a-anglies atomas), visada pakeičiamas.
1) C6H5-CH3 + Cl2 h ν → C6H5-CH2-Cl + HCl
c) benzeno homologai, esant katalizatoriui
C6H5-CH3 + Cl2 AlCl 3 → (orto mišinys, darinių pora) + HCl
2. Nitratavimas (su azoto rūgštimi)
C6H6 + HO-NO2 t, H2SO4→ C6H5-NO2 + H20
nitrobenzenas - kvapas migdolai!
C6H5-CH3 + 3HO-NO2 t, H2SO4→ NUO H3-C6H2 (NO2) 3 + 3H202,4,6-trinitrotoluenas (tol, TNT)
Benzeno ir jo homologų naudojimas
Benzenas C6H6 yra geras tirpiklis. Benzenas kaip priedas gerina variklių degalų kokybę. Tarnauja kaip žaliava gaminant daugelį aromatinių organinių junginių - nitrobenzenas C 6 H 5 NO 2 (tirpiklis, iš jo gaunamas anilinas), chlorbenzenas C 6 H 5 Cl, fenolis C 6 H 5 OH, stirenas ir kt.
Toluolas C 6 H 5 –CH 3 - tirpiklis, naudojamas dažų, vaistų ir sprogmenų gamybai (TNT (tol) arba 2,4,6-trinitrotolueno TNT).
KsilenasC6H4 (CH3) 2. Techninis ksilenas yra trijų izomerų mišinys ( orto-, meta- ir pora- ksilenai) - naudojamas kaip tirpiklis ir pradinis produktas daugelio organinių junginių sintezei.
Izopropilbenzenas C6H5-CH (CH3) 2 naudojamas fenoliui ir acetonui gauti.
Benzeno chloro dariniai naudojamas augalų apsaugai. Taigi, benzeno H atomų pakeitimo chloro atomais produktas yra heksachlorbenzenas С 6 Сl 6 - fungicidas; jis naudojamas sausiems kviečių ir rugių sėklų padažams nuo kietų purvų. Chloro pridėjimo į benzeną - heksachlorcikloheksano (heksachlorano) C 6 H 6 Cl 6 - insekticidas produktas; jis naudojamas kenksmingiems vabzdžiams naikinti. Minėtos medžiagos priklauso pesticidams - cheminėms medžiagoms, kovojančioms su mikroorganizmais, augalais ir gyvūnais.
Stirenas C 6 H 5 - CH \u003d CH 2 labai lengvai polimerizuojasi, susidaro polistirenas ir kopolimerizuojasi su butadieno - stireno butadieno kaučiukais.
VIDEO PATIRTIS
Aromatiniai angliavandeniliai (arenos) - angliavandeniliai, kurių molekulėse yra vienas ar keli benzeno žiedai. Arenų, turinčių vieną benzeno žiedą, sudėtis atitinka bendrą formulę C n H 2n-6 .
Paprasčiausio areno molekulėje - benzenas (C 6 H 6) - - ryšiai sudaro vieną delokalizuotą konjuguotą (aromatinę) ryšių sistemą.
Paprasčiausio areno - benzeno - molekulės struktūrą galima perteikti įvairių tipų struktūrinėmis formulėmis:
Izomerai ir homologai
| r | benzenas |
|||||
metilbenzenas (toluenas) |
||||||
etilbenzenas |
1,2-dimetilbenzenas ( orto-ksilenas) |
1,3-dimetilbenzenas ( meta-ksilenas) |
1,4-dimetilbenzenas ( pora-ksilenas) |
|||
propilbenzenas |
izopropilbenzenas |
1,2,4-tri-metilbenzenas |
1-metil-2-etilbenzenas |
1-metil-3-etilbenzenas |
1-metil-4-etilbenzenas |
|
| dYDIS | ||||||
Pakeisto benzeno darinio pavadinimas pagrįstas žodžiu „benzenas“. Benzeno žiedo atomai yra sunumeruoti pradedant nuo aukščiausio pakaitalo iki mažiausio. Pavyzdys: 1-metil-2-etilbenzenas, o ne 1-etil-2-metilbenzenas. Jei pakaitai yra vienodi, numeracija atliekama trumpiausiu keliu. Pavyzdys: 1,3-dimetilbenzenas, o ne 1,5-dimetilbenzenas.
Priešdėliai orto-, meta-, pora- (iš graikų „orthos“ - tiesioginis, meta - po, per, tarp poros - prieš, šalia, praeityje) organinių medžiagų pavadinimuose (sutrumpintai: apie-, m-, p-) yra naudojami dviejų pakaitų santykinei padėčiai ant benzeno žiedo nurodyti.
Fizikinės benzeno savybės: bespalvis vandenyje netirpus, savito kvapo skystis, lydymosi temperatūra 5,4 o C, virimo temperatūra 80,1 o C, tankis 0,88 g / cm 3. Benzeno garai yra nuodingi.
Cheminės savybės
Benzenas normaliomis sąlygomis nekeičia bromo vandens ir kalio permanganato tirpalo.
Kaip gauti arenas
Užduotys ir bandymai tema „3 tema.„ Aromatiniai angliavandeniliai “.
- Angliavandeniliai. Polimerai - Organinės medžiagos 8–9 klasė
Pamokos: 7 užduotys: 9 testai: 1
- - Žmogus medžiagų, medžiagų ir cheminių reakcijų pasaulyje, 8–9 klasės
Pamokos: 2 užduotys: 6 testai: 1
- Medžiagų klasifikavimas - neorganinių medžiagų klasės 8–9
Pamokos: 2 užduotys: 9 testai: 1
- Kristalinės grotelės - 8-9 klasės materijos struktūra
Pamokos: 1 Užduotys: 9 Testai: 1
- Sprendimų sudėtis - Sprendimai 8-9 kl
Pamokos: 3 užduotys: 8 testai: 1
Išnagrinėję temą turėtumėte: įvaldyti aromatinių angliavandenilių, aromatinių ryšių sąvokas, žinoti bendrą arenų formulę, nomenklatūros taisykles, pakaitinių reakcijų tipus (halogeninimas esant katalizatoriui, nitrinimas), papildymą (halogeninimas šviesoje, hidrinimas).
Patikrinkite, ar žinote, kaip atlikti skaičiavimus naudojant reakcijos lygtis ir išgauti medžiagų molekulines formules pagal elementų masės dalis, surasti reakcijos produkto išeigą ir išspręsti problemas, atsižvelgiant į priemaišų masės dalį.
1 pavyzdys. Angliavandenilyje, kurio garų tankis yra 15 vandenilio, yra 80% anglies. Raskite jo molekulinę formulę.
Atsakymas: C 2 H 6
2 pavyzdys. Iš 7,8 g benzeno gauta 8,61 g nitrobenzeno. Nustatykite reakcijos produkto išeigą.
Atsakymas: 70%
3 pavyzdys. Techninis kalcio karbidas, sveriantis 20 g, buvo apdorotas vandens pertekliumi. Koks acetileno tūris buvo gautas, jei priemaišų masės dalis techniniame karbide buvo 20%.
Atsakymas: 5,6 l
Įsitikinę, kad viskas, ko jums reikia, yra išmokta, pereikite prie temos užduočių. Linkime visokeriopos sėkmės.
Rekomenduojamas skaitymas:
- OS Gabrielyan ir kt. Chemija 10 ląstelių. M., Bustard, 2002;
- L. S. Guzei, R. P. Surovceva, G. G. Lysova. Chemija 11 kl. Bustardas, 1999 m.
- G. G. Lysova. Pagrindinės organinės chemijos pastabos ir testai. M., LLC „Glik plus“, 1999 m.
IRRENESAS
Aromatiniai angliavandeniliai (arenos) - cikliniai angliavandeniliai, sujungti aromatingumo sąvoka, kuri lemia bendras struktūros ir cheminių savybių savybes.
klasifikacija
Pagal benzeno žiedų skaičių areno molekulėje apie:
vienbranduolis
daugialypis

Nomenklatūra ir izomerija
Benzeno angliavandenilių struktūrinis pagrindas yra benzenas C 6 H 6iš kurių konstruojami sisteminiai homologų pavadinimai.
Monocikliniams junginiams paliekami šie nesisteminiai (trivialūs) pavadinimai:

Pakaitų padėtis nurodoma mažiausiais skaičiais (numeracijos kryptis nesvarbi),
|
|
|
o pakeistiems junginiams - žymėjimas orto, meta, pora.
|
|
|
|
Jei žiede yra trys pakaitai, tonas turėtų gauti mažiausią skaičių, t.y. eilutė "1,2,4" turi viršenybę prieš "1,3,4".


1,2-dimetil-4-etilbenzenas (teisingas pavadinimas) 3,4-dimetil-1-etilbenzenas (neteisingas)
Vienu metu pakeistų arenų izomerija yra dėl pakaito anglies skeleto struktūros; di- ir polipakeistuose benzeno homologuose pridedama izomerija, kurią sukelia skirtingas pakaitų išsidėstymas branduolyje.
C 9 H 12 kompozicijos aromatinių angliavandenilių izomerija:
|
|
|
|
|
Fizinės savybės
Arenų virimo ir lydymosi temperatūra yra aukštesnė nei alkanų, alkenų, alkinų, silpno poliškumo, netirpi vandenyje ir lengvai tirpsta nepoliniuose organiniuose tirpikliuose. Arenos yra skysčiai arba kietosios medžiagos, turinčios specifinių kvapų. Benzenas ir daugybė kondensuotų arenų yra toksiški, kai kurie iš jų pasižymi kancerogeninėmis savybėmis. Tarpiniai kondensuotų arenų oksidacijos produktai organizme yra epoksidai, kurie arba patys sukelia vėžį, arba yra kancerogenų pirmtakai.
Kaip gauti arenas
Daugelis aromatinių angliavandenilių turi didelę praktinę reikšmę ir yra gaminami dideliu pramonės mastu. Nemažai pramoninių metodų yra pagrįsti anglies ir naftos perdirbimu.
Aliejus susideda daugiausia iš alifatinių ir aliciklinių angliavandenilių; alifatiniams arba acikliniams angliavandeniliams paversti aromatiniais angliavandeniliais buvo sukurti aliejaus aromatinimo metodai, kurių chemines bazes sukūrė N.D. Zelinsky, B.A. Kazansky.
1. Ciklizacija ir dehidrinimas:
2. Hidrodesmetilinimas:

3. Benzeno homologai gaunami alkilinant arba acilinant, po to redukuojant karbonilo grupę.
a) Friedelio-amatų alkilinimas:

b) Friedelio-Craftso acilinimas:

4. Bifenilo gavimas naudojant „Würz-Fitting“ reakciją:
5. Difenilmetano gavimas pagal Friedelio-Craftso reakciją:
Struktūra ir cheminės savybės.
Kvapumo kriterijai:
Remiantis teoriniais skaičiavimais ir eksperimentiniais ciklinių konjuguotų sistemų tyrimais nustatyta, kad junginys yra aromatinis, jei jis turi:
- Plokščiasis ciklinis σ-skeletas;
- Konjuguota uždara π-elektronų sistema, apimanti visus ciklo atomus ir turinti 4n + 2, kur n \u003d 0, 1, 2, 3 ir kt. Ši formuluotė yra žinoma kaip hückelio taisyklė.Aromatiškumo kriterijai leidžia atskirti konjuguotas aromatines sistemas nuo visų kitų. Benzene yra π-elektronų sekstas ir jis atitinka Hükelio taisyklę n \u003d 1.
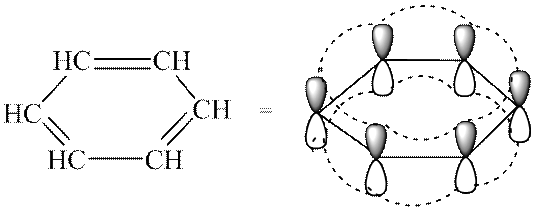
Kas suteikia aromatą:
Nepaisant didelio nesočiųjų laipsnio, aromatiniai junginiai yra atsparūs oksidatoriams ir temperatūrai, jie labiau linkę reaguoti į pakaitalą, o ne įpilti. Šie junginiai pasižymi didesniu termodinaminiu stabilumu, kurį suteikia didelė žiedo aromatinės sistemos konjugacijos energija (150 kJ / mol); todėl arenai yra labiau pageidautini, kad vyktų pakaitinės reakcijos, dėl kurių aromatas išlieka.
Elektrofilinių pakaitų reakcijų mechanizmas aromatiniame žiede:
Benzeno žiedo π-konjuguotos sistemos elektronų tankis yra patogus objektas elektrofilinių reagentų atakai.
Paprastai reakcijos metu elektrofiliniai reagentai susidaro naudojant katalizatorius ir atitinkamas sąlygas.
E - Y → E δ + - Y δ - → E + + Y -
Π-komplekso susidarymas.Pradinė žiedo π-elektronų debesies elektrofilo ataka lemia reagento koordinaciją su π sistema ir donoro-akceptoriaus tipo komplekso, vadinamo, susidarymą. π-kompleksas.Aromatinė sistema nėra sutrikusi:

Σ-komplekso susidarymas. Ribinė stadija, kai elektrofilas dėl žiedo π sistemos dviejų elektronų formuoja kovalentinį ryšį su anglies atomu, kurį lydi šio anglies atomo perėjimas iš sp 2 -į sp 3 -hibridinė būsena ir aromatinis sutrikimas, molekulė paverčiama karbokacija.

Σ-komplekso stabilizavimas. Jis atliekamas padalijant protoną iš σ-komplekso su pagrindu. Šiuo atveju uždara žiedo π sistema yra atkurta dėl dviejų nutrūkusios kovalentinės jungties C - H elektronų, t. molekulė grįžta į aromatinę būseną:

Pakaitų poveikis elektrofilinio pakaitalo reaktyvumui ir orientacijai
Benzeno žiedo pakaitalai sutrikdo pasiskirstymo tolygumą π- elektrono žiedo debesį ir taip paveikti žiedo reaktyvumą.
- Elektronus dovanojantys pakaitalai (D) padidina žiedo elektronų tankį ir padidina elektrofilinio pakaitalo greitį, tokie pakaitai vadinami aktyvuojantis.
- Elektronus pašalinantys pakaitalai (A) sumažina žiedo elektronų tankį ir sumažina reakcijos greitį nukenksminti.
1. Aromatinių angliavandenilių klasifikacija.
2. Homologinė monociklinių arenų serija, nomenklatūra, paruošimas.
3. Izomerija, benzeno struktūra ir jo homologai.
4. Arenų savybės.
Arenai yra daug anglies turintys cikliniai angliavandeniliai, kurių molekulėje yra benzeno branduolys ir pasižymi ypatingomis fizinėmis ir cheminėmis savybėmis. Pagal benzolo žiedų skaičių molekulėje ir žiedų sujungimo būdą arenai yra skirstomi į monociklinius (benzenas ir jo homologai) ir policiklinius (su kondensuotais ir izoliuotais žiedais) junginius.
Benzeno serijos arenai gali būti laikomi vandenilio atomų benzeno molekulėje pakeitimo alkilo radikalais produktais. Bendra tokių arenų formulė yra СnH 2 n- 6. Vienkartinai pakeistų arenų pavadinimas nurodo radikalo ir ciklo pavadinimą (benzenas):
benzeno metilbenzenas (toluenas) etilbenzenas.
Labiau pakeistose arenose radikalų padėtis nurodoma mažiausiu skaičiumi, nepakeistuose arenuose radikalų padėtis vadinama: 1,2 - orto ( o-) -, 1,3 - meta ( m-) - ir 1,4 - pora ( p-)-:

1,3-dimetilbenzenas 1,2-metiletilbenzenas
m-dimetilbenzenas ( m-ksilenas) apie-metiletilbenzenas ( apie-ksilenas)
Arenose trivialūs pavadinimai yra plačiai paplitę (kai kurie pavadinimai nurodyti skliausteliuose).
Buvimas gamtoje.
Aromatinių angliavandenilių yra augalų dervose ir balzamuose. Iš dalies arba visiškai hidrinto fenantreno yra daugelio natūralių junginių, pavyzdžiui, steroidų, alkaloidų, struktūrose.
Kaip gauti arenas:
1. anglies sausas distiliavimas;
2. cikloalkanų dehidrinimas

3. alkanų, turinčių 6 ar daugiau anglies atomų, dehidrociklinimas
4. alkilinimas

![]()
Izomerija.Benzeno homologams būdinga struktūrinė izomerija: kitokia šalutinio radikalo anglies skeleto struktūra ir kitokia radikalų sudėtis ir išsidėstymas benzeno žiede. Pavyzdžiui, aromatinių angliavandenilių, kurių kompozicija C9H12, izomerai (propilbenzenas, izopropilbenzenas, o-metiletilbenzenas ir 1,2,4-trimetilbenzenas):
Struktūra.Aromatiniai angliavandeniliai turi daugybę elektronų molekulių struktūros bruožų.
Pirmą kartą struktūrinę benzeno formulę pasiūlė A. Kekule. Tai šešių narių ciklas su kintančiomis dvigubomis ir viengubomis jungtimis, kurių dvigubos jungtys juda struktūroje:
![]()
Abiejose formulėse anglis yra keturvalentė, visi anglies atomai yra lygiaverčiai, o nepakeistas benzenas egzistuoja kaip trys izomerai ( orto-, meta-, pora-). Tačiau ši benzeno struktūra prieštaravo jo savybėms: benzenas neveikė nesočiųjų angliavandenilių būdingų adityvinių reakcijų (pavyzdžiui, bromo) ir oksidacijos (pavyzdžiui, su kalio permanganatu); jam ir jo homologams pagrindinis cheminio virsmo tipas yra pakaitinės reakcijos.
Šiuolaikinis požiūris į benzeno elektroninės struktūros aprašymą išsprendžia šį prieštaravimą taip. Anglies atomai benzeno molekulėje yra h 2 hibridizacijoje. Kiekvienas iš anglies atomų suformuoja tris kovalentinius σ ryšius - 2 ryšius su kaimyniniais anglies atomais (sp 2-sp 2 sutampančios orbitos) ir vieną su vandenilio atomu (sp 2 -s, sutampantys orbitalės). Hibridizuotos p-orbitalės dėl šoninio sutapimo suformuoja π-elektronų konjuguotą sistemą (π, π-konjugacija), kurioje yra šeši elektronai. Benzenas yra plokščias taisyklingas šešiakampis, kurio anglies-anglies jungties ilgis yra 0,14 nm, anglies-vandenilio ryšys yra 0,11 nm, jungties kampas - 120 0:

Benzeno molekulė yra stabilesnė nei cikliniai junginiai su izoliuotais dvigubais ryšiais, todėl benzenas ir jo homologai yra linkę į pakaitų reakcijas (benzeno žiedas išsaugotas), o ne įpilama ir oksiduojama.
Kiti cikliniai junginiai taip pat turi struktūros ir savybių (aromatiškumo) panašumų su benzenu. Kvapumo kriterijai (E. Hückel, 1931):
a) plokščia ciklinė struktūra, t.y. ciklą formuojantys atomai yra sp 2 hibridizacijoje; b) susieta elektroninė sistema; c) elektronų (N) skaičius žiede yra 4n + 2, kur n yra bet kuri sveiko skaičiaus reikšmė - 0,1,2,3 ir kt.
Kvapumo kriterijai taikomi tiek neutraliems, tiek įkrautiems cikliniams konjuguotiems junginiams, todėl aromatiniai junginiai bus, pavyzdžiui:
furano katijonas ciklopropenilo.
Benzenui ir kitiems aromatiniams junginiams ciklo metu būdingiausios vandenilio atomų pakeitimo reakcijos prie anglies atomų, o ciklo π jungties reakcijos yra mažiau tipiškos.
Fizinės savybės.
Benzenas ir jo homologai yra bespalviai skysčiai ir kristalinės medžiagos, turinčios savitą kvapą. Jie yra lengvesni už vandenį ir blogai jame ištirpsta. Nepolinis benzenas (μ \u003d 0), alkilbenzenai -
poliniai junginiai (μ ≠ 0).
Cheminės savybės.
Elektrofilinis pakaitalas.Būdingiausia arenų transformacija yra elektrofilinis pakaitalas - S E. Reakcija vyksta dviem etapais, susidarant tarpiniam σ-kompleksui:
Reakcijos sąlygos: temperatūra 60–80 0 С, katalizatoriai - Lewso rūgštys arba mineralinės rūgštys.
Tipiškos S E reakcijos:
a) halogeninimas(Cl 2, Br 2):
b) nitrinimas:
į) sulfoninimas(H 2 SO 4, SO 3, oleumas) :
d) Friedelio-Craftso alkilinimas (1877)(RHal, ROH, alkenai) :
e) Friedelio-Craftso alkilinimas(rūgščių halogenidai, karboksirūgšties anhidridai) :
Benzeno homologuose dėl šalutinio radikalo įtakos (+ I efektas, elektronų donorų grupė) benzeno žiedo π-elektronų tankis pasiskirsto netolygiai, padidėja 2,4,6 pozicijose. Todėl S E reakcijos vyksta kryptingai (2,4,6- arba apie-ir p-nuostatos). Benzeno homologai, palyginti su benzenu, pasižymi didesniu reaktyvumu tokio tipo reakcijose.
toluenas p-chlorotoluenas apie-chlorotoluenas
Šalutinės radikalios alkilbenzeno reakcijos (radikalų pakaitalas -S R ir oksidacija).
Radikalios pakaitų reakcijos vyksta, kaip ir sočiuose angliavandeniliuose, grandininiu mechanizmu ir apima iniciacijos, augimo ir grandinės nutraukimo stadijas. Chlorinimo reakcija vyksta nekryptingai, brominimo reakcija yra regioselektyvi - vandenilio pakaitalas vyksta prie α-anglies atomo.
Alkilbenzenuose šoninė grandinė oksiduojama kalio permanganatu, kalio dichromatu, kad susidarytų karboksirūgštys. Nepaisant šoninės grandinės ilgio, anglies atomas, susijęs su benzeno branduoliu (a-anglies arba benzilo anglies atomas), yra oksiduojamas, likę anglies atomai oksiduojami iki CO 2 arba karboksirūgščių.
etilbenzeno benzenkarboksirūgštis
p-metiletilbenzeno tereftalio rūgštis
Benzeno reakcijos pažeidžiant aromatinę sistemą.
Aromatiniai angliavandeniliai turi stiprų ciklą, todėl reakcijos su aromatinės sistemos pažeidimu (oksidacija, radikalų pridėjimas) vyksta atšiauriomis sąlygomis (aukšta temperatūra, stiprūs oksidatoriai).
a) radikalus papildymas:
1. hidrinimas
![]()
tolueno cikloheksanas
2.chlorinimas

benzenas 1,2,3,4,5,6-heksachlorcikloheksanas (heksachloranas).
Šios reakcijos produktas yra erdvinių izomerų mišinys.
Elektrofilinio pakaitalo aromatiniuose junginiuose orientacija.Benzeno žiedo pakaitalai yra suskirstyti į du tipus pagal jų orientacinę įtaką: orto-, pora-orientantai (1-os rūšies pakaitalai) ir meta-orientantai (2-os rūšies pakaitalai).
1-os rūšies pakaitalai yra elektronus dovanojančios grupės, kurios padidina žiedo elektronų tankį, padidina elektrofilinio pakaitalo reakcijos greitį ir suaktyvina benzeno žiedą šiose reakcijose:
D (+ I efektas): - R, -CH2OH, -CH2NH2 ir kt.
D (-I, + M-efektai): -NH2, -OH, -OR, -NR2, -SH ir kt.
Antrosios rūšies pakaitalai - elektronus traukiančios grupės, kurios sumažina žiedo elektronų tankį, sumažina elektrofilinio pakaitalo reakcijos greitį ir išjungia benzeno žiedą šiose reakcijose:
A (-I poveikis): -SO3H, -CF3, -CCl3 ir kt.
A (-I, -M -efektas): -HC \u003d O, -COOH, -NO2 ir kt.
Halogeno atomai užima tarpinę padėtį - jie sumažina žiedo elektronų tankį, sumažina elektrofilinio pakaitalo reakcijos greitį ir šiose reakcijose dezaktyvuoja benzeno žiedą, tačiau tai apie-,p-orentai.
Jei benzeno žiede yra du pakaitalai, jų orientacinis poveikis gali sutapti ( nuosekli orientacija) arba neatitinka ( nenuosekli orientacija). Vykstant elektrofilinėms pakaitų reakcijoms, nuoseklios orientacijos junginiai sudaro mažesnį izomerų skaičių, antruoju atveju susidaro didesnio izomerų skaičiaus mišinys. Pavyzdžiui:
 p-
hidroksibenzoinės rūgšties m-
hidroksibenzoinės rūgšties
p-
hidroksibenzoinės rūgšties m-
hidroksibenzoinės rūgšties
(nuosekli orientacija) (nenuosekli orientacija)
Policikliniai kondensuoti aromatiniai angliavandeniliai (naftalenas, antracenas, fenantrenas ir kt.) Savo savybėmis paprastai panašūs į benzeną, tačiau tuo pat metu jie turi tam tikrų skirtumų.
Naudojimas:
1. aromatiniai angliavandeniliai - žaliavos, skirtos dažams, sprogmenims, vaistams, polimerams, paviršinio aktyvumo medžiagoms, karboksirūgštims, aminams sintetinti;
2. Skysti aromatiniai angliavandeniliai yra geri organinių junginių tirpikliai;
3. arenos - priedai, skirti didelio oktaninio skaičiaus benzinui gaminti.
Ar tu tai žinai -1649 m. Vokiečių chemikas Johannas Glauberis pirmą kartą gavo benzeną.
1825 m. M. Faraday iš lempų dujų išskyrė angliavandenilį ir nustatė jo sudėtį - C 6 H 6.
1830 m. Justas Liebigas pavadino gautą junginį benzeną (iš arabiško Ven aromato + zoa sultys + lotyniškas olo aliejus).
1837 m. Auguste'as Laurentas pavadino benzeno radikalą C 6 H 5 - fenilu (iš graikų feniksų šviesos).
1865 m. Vokiečių organinis chemikas Friedrichas Augustas Kekule pasiūlė benzeno formulę su dvigubomis ir viengubomis jungtimis pakaitomis šešių narių cikle.
1865–70 m. V. Kerneris pasiūlė naudoti priešdėlius, kad būtų galima nurodyti abiejų pakaitų tarpusavio išsidėstymą: 1,2 padėtis - orto- (ortas - tiesus); 1,3- meta (meta - po) ir 1,4- pora (para - priešingai).
Aromatiniai angliavandeniliai yra labai toksiškos medžiagos, kurios apsinuodija ir pažeidžia kai kuriuos organus, pavyzdžiui, inkstus ir kepenis.
Kai kurie aromatiniai angliavandeniliai yra kancerogenai (vėžį sukeliančios medžiagos), pavyzdžiui, benzenas (sukeliantis leukemiją), vienas stipriausių yra benzopirenas (randamas tabako dūmuose).
20 TEMA. Aromatiniai benzeno grupės angliavandeniliai.
Homologinė serija. Bendroji formulė. Nomenklatūra. Izomerija.
Natūralūs šaltiniai ir gamybos metodai: iš alifatinių, aliciklinių ir aromatinių junginių. Würz-Fittig ir Friedel-Crafts reakcijos.
Fizikinės benzeno ir jo homologų savybės.
Cheminės savybės. Elektrofilinės pakaitų reakcijos: halogeninimas, nitrinimas, sulfoninimas, alkilinimas ir acilinimas. Vandenilio, halogenų, ozono pridėjimo reakcijos. Benzeno oksidavimas. Šoninės benzolo homologų grandinės reakcijos: halogeninimas, nitrinimas, oksidacija, dehidrinimas.
Homologinė serija. Bendroji formulė.
Pirmasis ir svarbiausias monociklinių aromatinių angliavandenilių (arenų) atstovas yra benzenasC 6 H 6.
Taigi aromatinių angliavandenilių homologinės serijos bendras pavadinimas - serija benzeno.
Bendroji formulėhomologinė benzeno serija: C pN 2p-6.
Arenų nomenklatūra.
Arenos dažnai vadinamos trivialiais pavadinimais: benzenas, toluenas, stirenas, kumenas ir kt.
Pagal tarptautinę pakaitinę nomenklatūrąarenai yra laikomi benzeno dariniais, kuriuose pakaitų padėtis nurodoma skaičiais, o anglies atomų, kuriuose yra pakaitai, skaičius turi būti mažiausias:
metilbenzenas etilbenzeno izopropilbenzenas
(toluenas) (kumenas)

vinilbenzeno etinilbenzeno
(stirenas) (fenilacetilenas)
Dviejų identiškų pakaitų atveju vietoj skaičių galite naudoti priešdėlius: 1,2- (orto-), 1,3- (meta-), 1,4- (para-):

1,2-dimetilbenzenas 1,3-dimetilbenzenas 1,4-dimetilbenzenas
(orto-ksilenas) (metak ksilenas) (para-ksilenas)